Carbazole : propriétés, production et utilisations

Le carbazole est un hydrocarbure aromatique hétérocyclique de formule chimique C12H9N. Il a été isolé pour la première fois du goudron de houille en 1872 par Graebe et Glaser. Sa structure comprend un dibenzopyrrole constitué d’un cycle azoté à cinq chaînons fusionné à deux cycles benzéniques.
Table des matières
1. Propriétés physiques du carbazole
Le carbazole est un solide cristallin blanc à jaune pâle avec une odeur distincte. Ses principales propriétés physiques incluent :
- Masse molaire : 167,21 g/mol
- Point de fusion : 246 °C
- Point d’ébullition : 354,8 °C à 101,3 kPa
- Densité : 1,1035 g/cm³ à 18 °C
- Morphologie des cristaux : plaques ou tables ; sublimable
- Solubilité :
- Très soluble : acétone, pyridine
- Modérément soluble : éther diéthylique, éthanol
- Légèrement soluble : chloroforme, acide acétique, tétrachlorure de carbone et disulfure de carbone
- Très soluble : acide sulfurique concentré
- Pratiquement insoluble : eau (≈ 1 mg/L à 25 °C)
- Propriétés thermodynamiques :
- Chaleur de fusion : 176,3 kJ/kg
- Chaleur de combustion : 3,719 × 10⁴ kJ/kg à 25 °C
2. Réactivité chimique du carbazole
Le carbazole présente une réactivité diversifiée en raison de sa nature aromatique et du doublet libre sur son atome d’azote. Voici un aperçu de ses principales réactions chimiques :
1. N-Substitution et alkylation
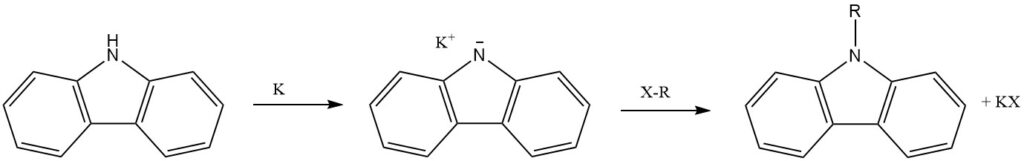
Le N-hydrogène du carbazole, agissant comme une amine secondaire, subit facilement une substitution par des métaux alcalins (Li, Na et K). Cela conduit à l’introduction d’autres groupes fonctionnels par d’autres réactions.
L’atome N du carbazole peut être alkylé, introduisant des substituants N-alkyle aux propriétés variables.
2. Halogénation, nitration et sulfonation

Les réactions de substitution électrophile comme l’halogénation, la nitration et la sulfonation ciblent préférentiellement les positions 3 et 6 du cycle carbazole en raison de leur densité électronique plus élevée. Des conditions difficiles sont nécessaires pour une substitution ultérieure aux positions 1, 8 et autres, conduisant aux dérivés 1,3,6 et 1,3,6,8.
Il peut également subir des réactions d’alkylation et d’acylation sur le cycle aromatique.
3. Hydrogénation
Le carbazole subit facilement une hydrogénation, donnant des dérivés partiellement ou totalement saturés. Selon les conditions de réaction, du 1,2,3,4-tétrahydro-, de l’hexahydro-, voire du dodécahydrocarbazole peut être formé.
4. Oxydation
L’oxydation avec des agents oxydants puissants comme les chromates ou les permanganates clive le cycle aromatique, formant différents produits dicarbazyl en fonction du site de clivage. Le 3,3′-dicarbazyl est formé par oxydation du chromate, tandis que le 9,9′-dicarbazyl est obtenu par oxydation avec du permanganate.
5. Carboxylation

Le traitement avec des carbonates de métaux alcalins et du dioxyde de carbone peut introduire des groupes acide carboxylique sur le cycle carbazole. La position du groupe carboxyle (3- ou 1-) dépend de la température de réaction.
3. Production de carbazole
Points clés:
- Le carbazole est facilement disponible dans le goudron de houille et peut être séparé de l’anthracène par diverses méthodes.
- Des voies synthétiques existent mais sont actuellement moins compétitives que l’extraction du goudron de houille.
- La cristallisation moderne à l’état fondu à haute température offre une approche prometteuse pour la production durable de carbazole
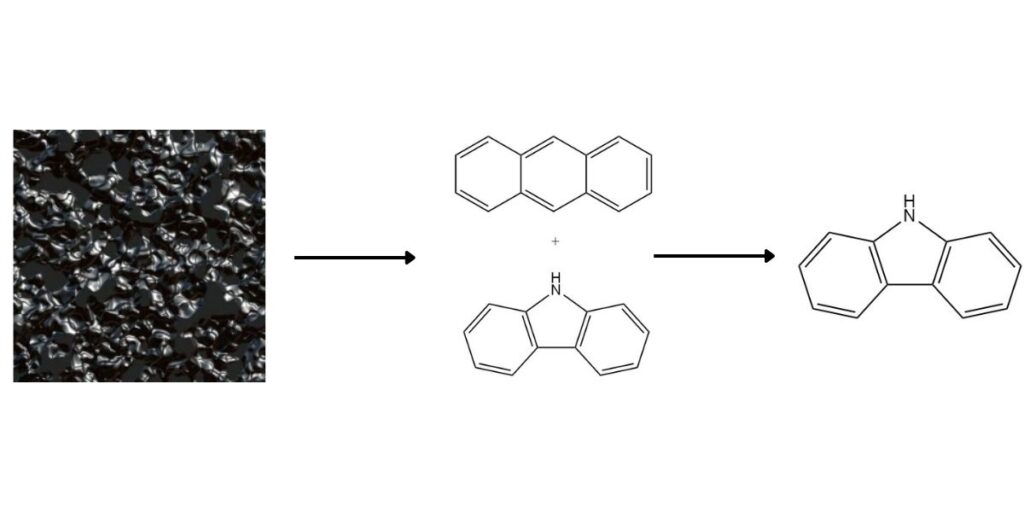
Le carbazole, en tant que composé aromatique hétérocyclique précieux, est présent dans le goudron de houille à haute température à une concentration moyenne de 0,9 %. Bien que traditionnellement obtenu en tant que coproduit lors de la production d’anthracène, plusieurs méthodes proposent une récupération dédiée du carbazole.
1. Séparation de l’Anthracène :
Le point d’ébullition plus élevé du carbazole et sa solubilité différentielle facilitent sa séparation de l’anthracène. Les méthodes courantes incluent :
- Extraction ou complexation : utilisation de solvants comme la pyridine, les cétones, mélanges de benzène/méthanol, ou d’agents spécifiques comme la N-méthylpyrrolidone, le diméthylacétamide, le dialkyle sulfoxydes ou dialkylformamides.
- Distillation azéotropique : Utilisation de l’éthylène glycol pour exploiter la formation d’un azéotrope avec le carbazole, permettant une séparation par distillation fractionnée.
- Hydrogénation sélective : Conversion de l’anthracène en dérivés hydrogénés sans affecter le carbazole.
2. Séparation chimique :
Historiquement, des méthodes telles que l’hydroxyde de potassium ou la fusion d’acide sulfurique concentré étaient utilisées pour la séparation du carbazole. Cependant, leur viabilité économique a diminué.
3. Purification à partir des liqueurs mères pyridine :
Les liqueurs mères de pyridine générées lors de la purification de l’anthracène peuvent être concentrées et recristallisées à partir du chlorobenzène pour produire du carbazole pur.
4. Voies synthétiques du carbazole
Il existe plusieurs méthodes de synthèse pour la production de carbazole, mais leur importance industrielle est limitée par rapport à l’extraction du goudron de houille :
- Conversion de la cyclohexanone azine en octahydrocarbazole suivie d’une déshydrogénation.
- Cyclisation réductrice du 2-nitrobiphényle.
- Déshydrogénation et cyclisation de divers précurseurs comme la diphénylamine, l’o-aminobiphényle ou la N-cyclohexylidèneaniline.
Une méthode moderne et efficace de récupération du carbazole à partir du goudron de houille est la cristallisation à l’état fondu à haute température et sans solvant. Ce procédé offre des avantages en termes d’impact environnemental et de rentabilité.
4. Utilisations du carbazole
Bien qu’il soit principalement extrait du goudron de houille (plus de 3 500 tonnes par an), le carbazole est utilisé dans diverses industries, notamment : les colorants et pigments, les pesticides et les polymères, les matériaux optiques et la lumière. -diodes électroluminescentes et dans la construction et les adhésifs.
Colorants et pigments :
- Hydron Blue : la condensation du carbazole avec p-nitrosophénol et la sulfuration ultérieure donnent ce colorant soufré bleu d’importance commerciale.
- Naphtol AS et Colorants anthraquinone : Le carbazole sert de précurseur à divers colorants azoïques et anthraquinoniques utilisés dans les applications textiles et industrielles.
- Colorants styryliques : le N-éthylcarbazole permet la synthèse de colorants styryliques vibrants utilisés dans divers matériaux et produits.
- Colorants et pigments dioxazine : le N-éthyl-3-aminocarbazole joue un rôle clé dans la création de ces précieux colorants pour les pigments organiques et les colorants azine.
- Le carbazole contribue à la production de colorants réactifs, connus pour leur forte liaison aux fibres synthétiques.
Pesticides et polymères :
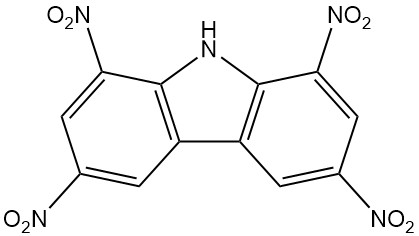
- Nirosan : le 1,3,6,8-tétranitrocarbazole, un insecticide efficace, est disponible dans le commerce depuis 1939.
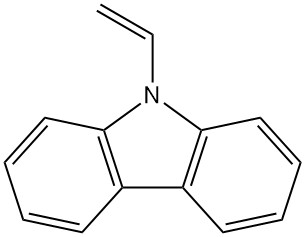
- Poly(vinylcarbazole) : La polymérisation du N-vinylcarbazole donne ce polymère thermiquement et chimiquement stable (Luvican, Polectron) utilisé pour les applications électriques en raison de sa faible perte diélectrique et sa photoconductivité.
Matériaux optiques et diodes électroluminescentes :
- Matériaux photoréfractifs : les polymères de méthacrylate carbazole combinent photoconductivité et propriétés électro-optiques, ce qui les rend idéaux pour le stockage de données haute densité, le traitement d’images, et l’informatique.
- Émetteurs triplet : les composés de carbazole sont utilisés comme matériaux hôtes pour les émetteurs triplet dans les diodes électroluminescentes organiques (OLED), améliorant ainsi leur efficacité et luminosité.
Construction et adhésifs :
- Résines Novolak : le carbazole réagit avec les phénols et le formaldéhyde pour former ces polymères résistants à la chaleur, précieux pour les adhésifs et les revêtements.
- Plastifiants pour béton : La cocondensation du carbazole avec des phénols et du formaldéhyde, suivie d’une sulfonation, donne des plastifiants efficaces pour le béton.
Polymères hautes performances :
- Polyamides : La condensation thermique du 3,6-diaminocarbazole avec des acides dicarboxyliques produit des polyamides élastiques et thermiquement stables avec diverses applications.
5. Dérivés de carbazole

| Dérivé | Numéro CAS | Formule | Masse molaire (g/mol) | Point de fusion (°C) | Synthèse |
|---|---|---|---|---|---|
| N-éthylcarbazole | 86-28-2 | C14H13N | 195.27 | 68 | Éthylation du carbazole avec du sulfate de diéthyle |
| 1,3,6,8-tétranitrocarbazole | 4543-33-3 | C12H5O8N5 | 347.20 | 312 | Nitration du carbazole avec de l'acide nitrique et sulfurique |
| N-Vinylcarbazole | 1484-13-5 | C14H11N | 193,25 | 65 | À partir de carbazole-potassium avec de l'oxyde d'éthylène ou du chlorure de vinyle, ou à partir de carbazole et d'acétylène |
6. Toxicologie du carbazole
Le carbazole présente une faible toxicité orale aiguë, avec des valeurs DL50 dépassant 5 000 mg/kg chez le rat. Cependant, l’administration intrapéritonéale chez la souris révèle une DL50 significativement inférieure de 200 mg/kg, ce qui suggère une toxicité dépendante de la voie.
L’exposition professionnelle au carbazole a été associée à la folliculite et aux comédons, bien que des études animales démontrent un potentiel d’irritation cutanée et oculaire minime, même sous photoactivation.
Le carbazole subit une glucuronidation puis une excrétion urinaire chez le rat et le lapin.
Une alimentation à forte dose de carbazole (270 à 1 050 mg/kg p.c./jour) pendant 96 semaines a induit des carcinomes du foie et du pré-estomac chez les souris B6C3F1, mais aucune activité tumorigène n’a été observée chez les souris nouveau-nées après des injections intrapéritonéales.
Sur la base de preuves limitées, le carbazole est classé dans le groupe 3 (inclassable quant à sa cancérogénicité pour l’homme) par le Centre international de recherche sur le cancer (CIRC). Il n’a eu aucune activité mutagène dans diverses analyses bactériennes.
Le 9-éthylcarbazole, un dérivé, a montré un faible effet mutagène dans une souche bactérienne mais était inactif dans une autre, ce qui suggère un potentiel mutagène limité.
L’application cutanée de carbazole jusqu’à 250 mg/kg p.c./jour pendant la grossesse n’a pas induit d’anomalies dans le développement fœtal du rat.
Références
- Carbazole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a05_059.pub2
- Carbazole; – https://www.sigmaaldrich.com/US/en/product/sigma/c5132
- https://en.wikipedia.org/wiki/Carbazole
