Benzylamine
La benzylamine est un composé organique de formule chimique C6H5CH2NH2. C’est un liquide incolore avec une odeur d’amine caractéristique. Il s’agit d’une amine primaire à laquelle est attaché un cycle benzénique.
Table des matières
1. Propriétés physiques de la benzylamine
| Propriété | Valeur |
|---|---|
| Synonymes | α-aminotoluène, phénylméthylamine |
| Formule chimique | C7H9N |
| Poids moléculaire | 107,16 g/mol |
| Apparence physique | Liquide incolore avec une légère odeur d'amine |
| Solubilité | Miscible avec l'eau, l'alcool et l'éther diéthylique |
| Point d'ébullition | 184,5 °C à 101,3 kPa 90 °C à 1,6 kPa |
| Point de solidification | < -30 °C |
| Pression de vapeur | env. 60 Pa à 20 °C env. 130 Pa à 30 °C 520 Pa à 50 °C |
| Chaleur de vaporisation | 49 kJ/mol |
| Chaleur de combustion | 4 058,7 kJ/mol à 101,3 kPa et 20 °C |
| Indice de réfraction à 20 °C | 1,5401 |
| Densité à 20 °C | 0,9813 |
| Constante diélectrique | 4,6 à 20,6 °C |
| Constante de dissociation électrolytique dans l'eau | 2,35 × 10-5 à 20 °C |
| Viscosité | 1,78 mPa·s à 21,2 °C 0,295 mPa·s à 178,2 °C |
| Tension superficielle | 38,82 × 10-5 N/cm à 21,1 °C 31,70 × 10-5 N/cm à 88 °C |
| Température d'auto-inflammation | 390 °C |
| Point d'éclair | 65 °C |
| Limite d'explosion | 0,9 % (inférieur) à 14 % (supérieur) |
| Moment dipolaire (20 °C) | 1,18 D (pur), 1,25 D dans le toluène, 1,29 D dans l'hexane, 1,30 D dans le cyclohexane, 1,33 D dans le benzène |
| Viscosité dynamique | 0,01596 g cm-1 s-1 à 25 °C |
| Absorption maximale lmax dans l'eau | 255,9 nm (e 249 L mol-1 cm-1) |
| Susceptibilité magnétique | −75,3 × 10-6 cm3/mol |
2. Réactions chimiques de la benzylamine
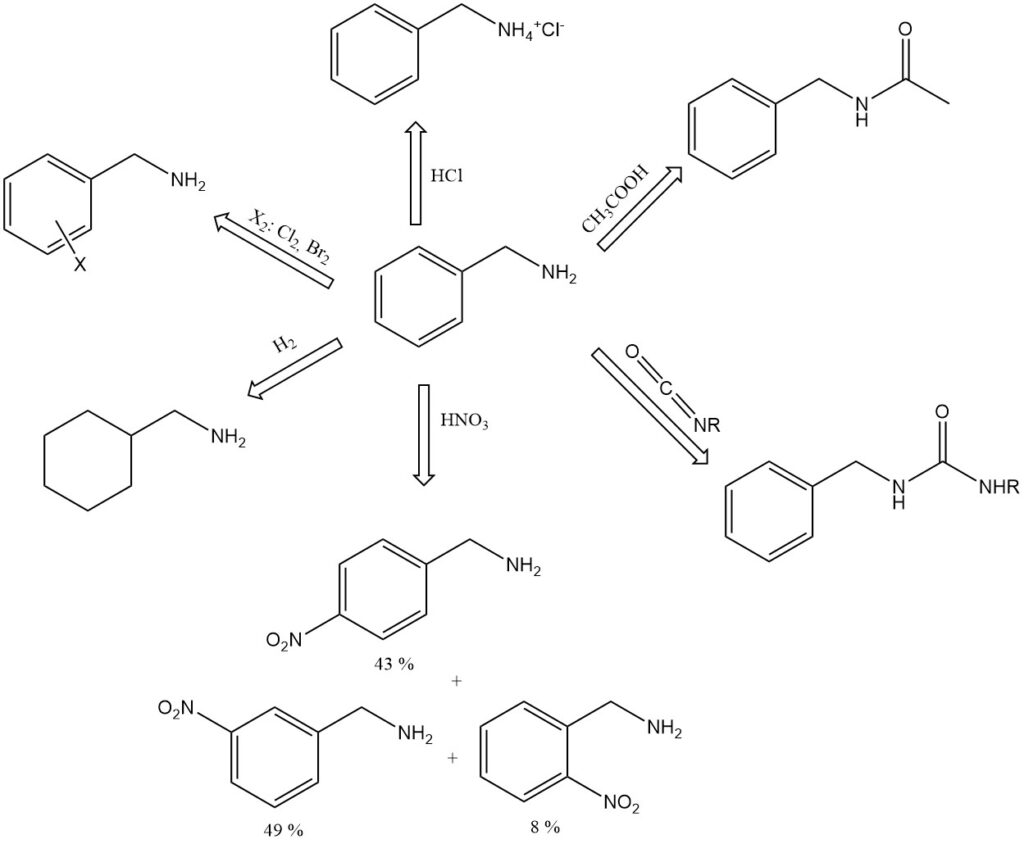
La benzylamine est une base plus forte que ses isomères de toluidine et est fortement alcaline même lorsqu’elle est diluée avec un peu d’eau (pH 11,6 dans 100 g/L d’eau).
Il forme des composés d’addition avec le phénol (1:3, mp 15,3 °C), le p-crésol (1:1, mp -6 °C) et l’acide formique (1:1, mp 81 °C). Des exemples de sels de benzylamine comprennent le chlorhydrate, C6H5CH2NH3+ Cl−, point de fusion 260 °C (décomp.), et le picrate, point de fusion 194 °C.
La benzylamine absorbe le dioxyde de carbone de l’air pour former un sel d’acide carbamique solide.
Lorsqu’elle est bouillie avec de l’acide acétique glacial, la benzylamine forme de la N-acétylbenzylamine.
La benzylamine réagit avec les isocyanates pour donner des urées substituées, C6H5CH2NHCONHR.
L’acide nitrique nitrate la benzylamine sur le noyau aromatique pour donner 8 % d’ortho-, 49 % de méta- et 43 % de para-nitrobenzylamine.
L’hydrogénation catalytique de la benzylamine donne l’hexahydrobenzylamine, C6H11CH2NH2.
La benzylamine peut subir des réactions aromatiques sur le cycle benzénique telles que l’alkylation, l’acylation, la sulfonation et l’halogénation.
3. Production de benzylamine
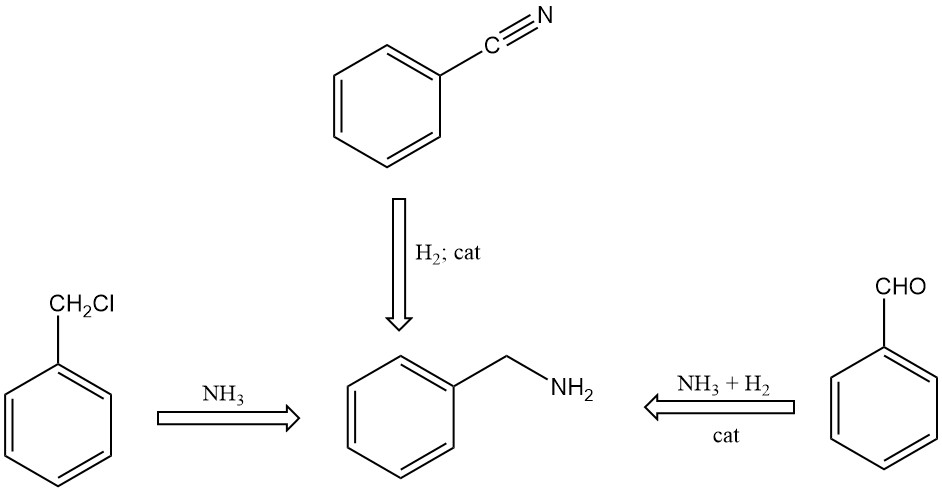
Il existe plusieurs méthodes de synthèse de la benzylamine :
- Réaction du chlorure de benzyle avec l’ammoniac dans une solution aqueuse
- Hydrogénation catalytique du benzonitrile
- Réaction du benzaldéhyde avec l’ammoniac en présence d’hydrogène et de catalyseurs, en utilisant des solvants organiques dans le mélange réactionnel
La benzylamine est produite par la voie du benzaldéhyde comme suit :
- Mélanger 8 kg de nickel de Raney (équivalent à environ 4 kg de Ni 100 %), 10 g d’acide acétique glacial, 110 kg d’ammoniac et un mélange de 250 kg de méthanol et 500 kg de benzaldéhyde dans un autoclave en acier de 1 200 L. .
- Hydrogéner le mélange à 100 °C et 15 MPa pendant 3 à 5 heures, en réapprovisionnant en hydrogène toutes les 10 minutes environ. Une fois la consommation d’hydrogène terminée, maintenir le récipient de réaction à la même température et pression pendant 30 minutes supplémentaires.
- Séparez le catalyseur des produits de réaction à l’aide d’un filtre sous pression. Le filtrat contient environ 470 kg de benzylamine pour un rendement de 93 %, ainsi que des traces d’alcool benzylique, de dibenzylamine, de base de Schiff (N-benzalbenzylamine), de méthanol, d’eau de réaction et d’ammoniac, pour un rendement de 93 %.
- La distillation sous vide est utilisée pour obtenir de la benzylamine de la pureté technique nécessaire.
La benzylamine a également été identifiée dans les feuilles et les fleurs de la plante Reseda media.
4. Utilisations de la benzylamine
La benzylamine est utilisée dans la production de textiles synthétiques, de peintures et d’inhibiteurs de corrosion. Il est également utilisé comme intermédiaire dans la production de produits pharmaceutiques et de pesticides. Dans ces cas, la benzylamine est souvent utilisée comme azote protégé.
La benzylamine est un intermédiaire polyvalent et un élément de base dans une variété d’applications, notamment les revêtements et la protection des cultures.
Il est utilisé dans la fabrication industrielle de nombreux produits pharmaceutiques, notamment l’alniditan, le lacosamide, la moxifloxacine et le nébivolol.
La benzylamine est également utilisée pour fabriquer l’explosif militaire hexanitrohexaazaisowurtzitane (HNIW).
5. Toxicologie de la benzylamine
La benzylamine est facilement biodégradable, mais elle est nocive pour les organismes aquatiques et a un effet faible (classe allemande pour les dangers en milieu aquatique : 1, WGK 1).
La toxicité aiguë de la benzylamine varie selon les organismes :
- Pseudomonas fluorescens (bactéries) : EC0 500 mg
- Scenedesmus quadricauda (algues) : CE10 96 h 6 mg
- Daphnia magna : CE50 48 h 60 mg
- Leuciscus idus (poisson) : CE0 48 h 20 mg
- Pimephals promelas (poisson) : CE50 96 h 102 mg
La benzylamine peut provoquer des brûlures de la peau et des yeux et entraîner une sensibilisation. En cas d’exposition à la benzylamine, rincer immédiatement à l’eau et laver la peau avec du savon. Une solution aqueuse à 5 % d’acide acétique doit être accessible pour neutraliser la peau contaminée.
En cas d’ingestion, diluer avec de l’eau potable et rincer la bouche. En cas de risque d’inhalation, utiliser des filtres ABEK dans les masques respiratoires (DIN 3181).
La benzylamine a donné un résultat négatif au test d’Ames, indiquant l’absence d’effet mutagène. Les valeurs DL50 aiguës par voie orale et percutanée pour les rats sont respectivement de 1 130 mg/kg et 1 340 mg/kg. Il est classé en classe de toxicité 3 en Suisse.
Les rats ont survécu pendant une période de deux semaines après 3 heures d’exposition par inhalation de tout le corps à la benzylamine, mais 17 % des rats sont morts après 5 heures d’exposition.
Références
- Benzylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_009.pub2
- https://products.basf.com/global/en/ci/benzylamine.html
