Acide mandélique : propriétés, production et utilisations
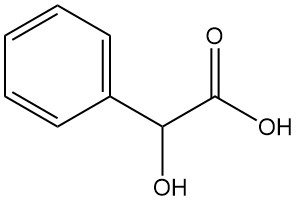
Qu’est-ce que l’acide mandélique ?
L’acide mandélique, également connu sous le nom d’acide α-hydroxyphénylacétique ou acide phénylglycolique, est un acide alpha-hydroxy aromatique de formule chimique C8H8O3. Il s’agit d’une poudre cristalline blanche à l’odeur légèrement sucrée.
L’acide mandélique a été découvert pour la première fois en 1831 par le pharmacien allemand Ferdinand Ludwig Winckler. Il l’a isolé en chauffant l’amygdaline, un composé présent dans les amandes amères, avec de l’acide chlorhydrique dilué.
Le nom « acide mandélique » est dérivé du mot allemand « Mandel », qui signifie amande.
Table des matières
1. Propriétés physiques de l’acide mandélique
L’acide (R,S)-mandélique racémique est un solide cristallin incolore qui est facilement soluble dans l’éthanol et l’éther diéthylique, moins soluble dans le chloroforme et insoluble dans l’éther de pétrole. Les solutions alcalines dissolvent l’acide mandélique en sels correspondants.
L’acide (R,S)-mandélique racémique peut être séparé en ses énantiomères par réaction avec la cinchonine dans une solution aqueuse, ce qui entraîne la précipitation de l’acide (S)-(+)-mandélique sous forme de sel tandis que l’acide (R)-(-)-mandélique reste en solution.
L’utilisation de S-(+)-aminodiol pour le processus de résolution conduit également à la cristallisation de l’acide (R)-(-)-mandélique, laissant l’énantiomère (S)-(+)-en solution.
Le tableau 1 résume les propriétés physiques de l’acide mandélique.
| Propriété | Acide (R,S)-mandélique | Acide (R)-(-)-mandélique |
|---|---|---|
| Numéro CAS | [611-72-3] | [611-71-2] |
| Formule chimique | C8H8O3 | C8H8O3 |
| Poids moléculaire | 152,15 g/mol | 152,15 g/mol |
| Point de fusion | 118-121 °C | 132-135 °C |
| Point d'ébullition | 321,8 °C | |
| Densité | 1,30 g/cm3 | |
| Indice de réfraction | 1,5204 | |
| Solubilité dans l'eau | 15 g/100 mL | |
| pKa | 3,41 | |
| Point d'éclair | 163 °C | |
| Rotation spécifique (c = 5) | [α]D20 =-154 à -157° |
2. Réactions chimiques de l’acide mandélique
L’acide mandélique devient brun lorsqu’il est exposé à la lumière. Il réagit avec les bases pour former des sels, comme le mandélate de sodium.
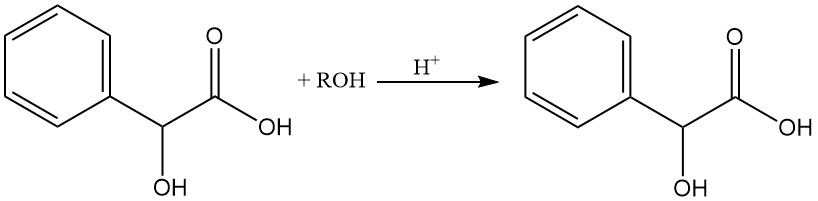
L’acide mandélique peut être estérifié facilement avec des alcools en présence de chlorure d’hydrogène.
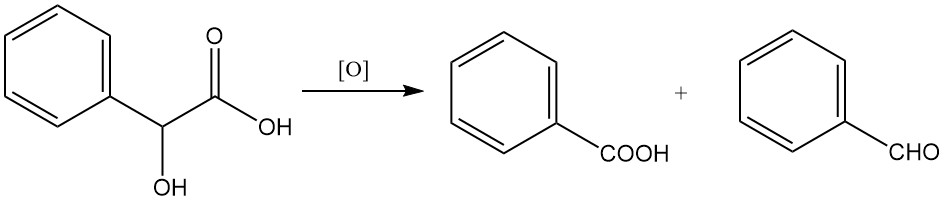
L’oxydation avec des agents oxydants puissants comme le permanganate de potassium ou l’acide chromique peut conduire à la formation de benzaldéhyde ou d’acide benzoïque.
Dans des conditions spécifiques, l’acide mandélique peut être décarboxylé pour former du benzène.
L’acide mandélique peut subir des réactions de substitution aromatique typiques telles que l’halogénation, l’alkylation, l’acylation, la nitration et la sulfonation.
3. Production d’acide mandélique
L’acide (R,S)-mandélique racémique est produit par l’hydrolyse du mandélonitrile à l’aide d’acide chlorhydrique.
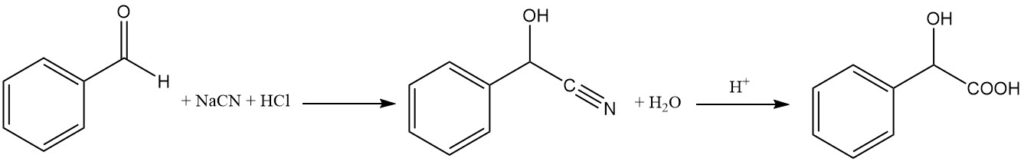
Le mandélonitrile est préparé par la réaction du benzaldéhyde et du cyanure d’hydrogène naissant (NaCN + HCl) à une température inférieure à 10 °C. Le bisulfite de sodium est utilisé comme catalyseur. Le mandélonitrile obtenu est un liquide huileux qui est séparé de la phase aqueuse.
Le mandélonitrile obtenu est traité avec de l’acide chlorhydrique concentré à température ambiante pendant environ 12 heures, puis l’excès d’eau et d’acide chlorhydrique est évaporé. Cette étape aboutit à la formation d’acide mandélique brut.
L’acide mandélique brut est purifié par extraction au benzène ou à l’éther. Le résidu solide contenant de l’acide mandélique est extrait plusieurs fois avec du benzène chaud ou de l’éther, et il est cristallisé par refroidissement.
Le rendement typique d’acide mandélique pur est d’environ 50 à 52 % par rapport au benzaldéhyde.
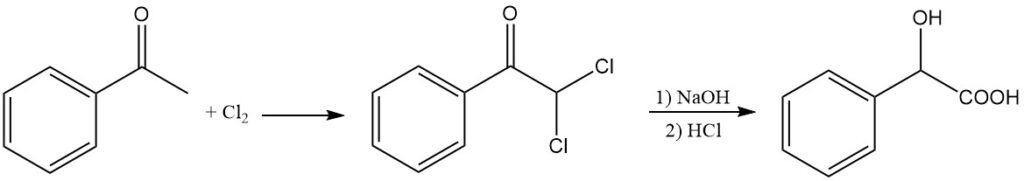
L’acide mandélique peut être synthétisé alternativement par hydrolyse alcaline de l’α,α-dichloroacétophénone. L’acétophénone réagit avec le chlore pour produire de la dichloroacétophénone, qui subit une hydrolyse alcaline par l’hydroxyde de sodium à 65 °C, suivie d’une acidolyse avec HCl.
L’acide (R)-mandélique peut être produit par un processus de biosynthèse qui utilise le styrène, la L-phénylalanine, le glycérol ou le glucose comme matières premières. En combinant plusieurs étapes enzymatiques, l’acide (R)-mandélique peut être produit efficacement à partir de ces matières premières renouvelables.
De plus, l’intégration de la biosynthèse de la L-phénylalanine dans le processus permet la conversion directe du glucose ou du glycérol en acide (R)-mandélique au sein d’un seul organisme. Cette méthode biocatalytique offre une alternative prometteuse aux méthodes de synthèse chimique traditionnelles, mais elle est encore en développement.
4. Utilisations de l’acide mandélique
L’acide mandélique est principalement utilisé pour produire ses esters, qui sont des agents analgésiques, antirhumatismaux et spasmolytiques. Par exemple, le cis-3,5,5-triméthylcyclohexyl mandelate est utilisé comme agent spasmolytique et vasodilatateur. L’ester de tropine d’acide mandélique (homatropine-HBr) est utilisé en ophtalmologie pour la dilatation de la pupille.
Le mandélate d’hexaméthylènetétramine, également connu sous le nom de mandélamine, mandropine, diuramine ou hexydaline, est utilisé dans le traitement des infections des voies urinaires.
L’acide mandélique est également utilisé dans les soins de la peau pour le traitement de l’acné, l’exfoliation, l’hyperpigmentation, l’anti-âge et l’amélioration de la texture de la peau.
L’acide mandélique a des propriétés bactériostatiques et est utilisé dans le traitement des infections des voies urinaires. Administré par voie orale sous forme de sels d’ammonium ou de calcium, il inhibe efficacement la croissance des bactéries Gram-négatives et de certains micro-organismes Gram-positifs.
Une activité antimicrobienne optimale est observée dans des conditions d’urine acide (pH inférieur à 5,5). Une solution d’acide mandélique à 1 % est utilisée comme solution de rinçage pour l’entretien des cathéters urinaires à demeure.
5. Toxicologie de l’acide mandélique
Les études de toxicité orale aiguë de l’acide mandélique chez le rat montrent une LDLo (voie orale, rat) de 3 000 mg/kg.
L’inhalation d’acide mandélique peut provoquer une irritation respiratoire, pouvant conduire à des symptômes de type asthmatique, à une bronchite ou à une pneumoconiose en cas d’exposition prolongée. Les personnes souffrant de problèmes respiratoires préexistants présentent un risque accru.
L’acide mandélique est un irritant oculaire grave.
Le contact cutané peut provoquer une inflammation cutanée ou aggraver une dermatite existante. Évitez tout contact avec des plaies ouvertes.
Une exposition répétée ou prolongée peut entraîner des lésions rénales et des effets cumulatifs sur la santé.
Références
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Method for synthesizing mandelic acid. – https://patents.google.com/patent/CN112321410A/en
- https://bioresourcesbioprocessing.springeropen.com/articles/10.1186/s40643-021-00374-6
- https://www.orgsyn.org/demo.aspx?prep=CV1P0336
- https://pubs.rsc.org/en/content/articlelanding/2017/ra/c6ra25562k
- https://www.sciencedirect.com/science/article/abs/pii/S1075628002290072
- https://patents.google.com/patent/DE2936416A1/en
- https://www.lgcstandards.com/DE/en/Resources/Articles/Pharma_roots_mandelic_acid
- https://datasheets.scbt.com/sc-205481.pdf
