Acide fluorosulfurique : propriétés, production et utilisations
Qu’est-ce que l’acide fluorosulfurique ?
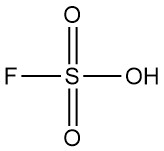
L’acide fluorosulfurique est un composé inorganique dont la formule chimique est HSO3F. Il s’agit d’un liquide incolore à jaune pâle avec une odeur piquante qui se dégage facilement dans l’air humide. Il est reconnu comme l’un des acides les plus puissants disponibles dans le commerce.
La liaison fluor-soufre est plus forte que celle de l’acide chlorosulfurique, de sorte que l’acide fluorosulfurique est hydrolysé plus lentement que l’acide chlorosulfurique. Dans des conditions optimales, la synthèse de sels d’acide fluorosulfurique en solution aqueuse est possible.
L’acide fluorosulfurique a été mentionné pour la première fois en 1892, avec une méthode de synthèse qui utilise du fluorure d’hydrogène et du trioxyde de soufre, qui reste le procédé de production préféré.
Historiquement, l’acide fluorosulfurique était utilisé dans les réactions de fluoration et comme catalyseur dans les processus d’alkylation et de cyclisation. Les processus industriels tels que la production de trifluorure de bore et la polymérisation du tétrahydrofurane utilisent l’acide fluorosulfurique. Il est également utilisé dans le polissage chimique du verre cristal au plomb depuis les années 1960.
L’acide fluorosulfurique commercial est composé d’environ 99,0 % de HSO3F, avec des impuretés mineures, notamment de l’acide sulfurique, du trioxyde de soufre, du dioxyde de soufre et du fer.
À ce jour, les sels et dérivés de l’acide fluorosulfurique ont une importance industrielle limitée.
Table des matières
1. Propriétés physiques de l’acide fluorosulfurique
L’acide fluorosulfurique est un liquide incolore soluble dans les solvants organiques polaires (par exemple, le nitrobenzène, l’acide acétique et l’acétate d’éthyle) mais peu soluble dans les solvants non polaires.
Les propriétés physiques de l’acide fluorosulfurique sont résumées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [7789-21-1] |
| Formule chimique | HSO3F |
| Poids moléculaire | 100,07 g/mol |
| Point de fusion | - 88,98 °C |
| Point d'ébullition |
à 101,3 kPa : 162,7 °C à 16,0 kPa : 110 °C à 2,5 kPa : 77 °C |
| Densité |
à 18 °C : 1,740 g/cm3 à 25 °C : 1,725 g/cm3 |
| Pression de vapeur à 25 °C | 330 Pa |
| Viscosité à 25 °C | 1,56 mPa.s |
| Chaleur de formation (liquide) | 792,45 kJ/mol |
2. Production d’acide fluorosulfurique
L’acide fluorosulfurique est produit industriellement en mélangeant du fluorure d’hydrogène et du trioxyde de soufre dans de l’acide fluorosulfurique comme solvant pour la réaction. L’acide fluorosulfurique est refroidi pour maintenir la température dans le réacteur constante à < 100 °C, comme le montre la figure 1.
HF + SO3 → HSO3F
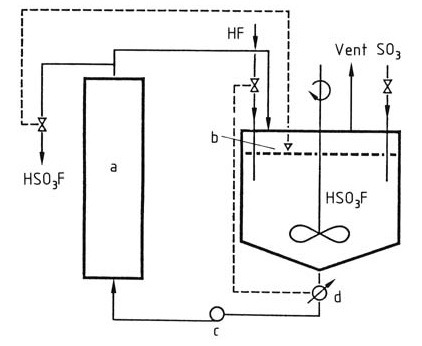
Figure 1 : Production d'acide fluorosulfurique
a) Refroidisseur ; b) Contrôle de niveau ; c) Pompe ; d) Conductimètre
L’acide fluorosulfurique peut également être synthétisé en faisant réagir du fluorure d’hydrogène de potassium ou du fluorure de calcium avec de l’oléum (acide sulfurique fumant) à des températures élevées (environ 250 °C).
Après la réaction, tout fluorure d’hydrogène restant est éliminé par purge avec un gaz inerte. L’acide fluorosulfurique obtenu peut ensuite être purifié par distillation dans un appareil en verre.
En raison de la nature corrosive de l’acide fluorosulfurique, sa production et sa manipulation nécessitent un équipement spécialisé et des protocoles de sécurité rigoureux.
3. Utilisations de l’acide fluorosulfurique
3.1. Utilisations de l’acide fluorosulfurique en chimie inorganique
L’acide fluorosulfurique est utilisé comme agent de fluoration qui présente une réactivité plus douce que l’acide fluorhydrique. Les exemples de réactions de fluoration comprennent la conversion du dioxyde de silicium en tétrafluorure de silicium, de l’acide borique en trifluorure de bore, du trioxyde d’arsenic en trifluorure d’arsenic et du perchlorate de potassium en fluorure de perchloryle. Ce dernier composé est utilisé comme agent de fluoration dans la synthèse organique.
3.2. Utilisations de l’acide fluorosulfurique dans le polissage du verre
L’acide fluorosulfurique est utilisé pour restaurer les bains de polissage du verre au plomb, qui comprennent 60 à 70 % d’acide sulfurique, 2 à 6 % d’acide fluorhydrique et de l’eau. Le processus de polissage consomme ces acides en dissolvant partiellement la surface du verre, comme le montrent les équations suivantes :
PbO + H2SO4 → PbSO4 + H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Lorsque de l’acide fluorosulfurique est ajouté au bain de polissage, il est hydrolysé pour reproduire ces acides dans le milieu acide en consommant une partie de l’eau formée.
HSO3F + H2O → H2SO4 + HF
Cette méthode réduit la consommation d’acide fluorhydrique d’environ 28 % et réduit également les déchets d’acide par rapport aux techniques de régénération traditionnelles utilisant les acides sulfurique et fluorhydrique.
3.3. Utilisations de l’acide fluorosulfurique en chimie organique
L’acide fluorosulfurique catalyse les réactions d’alkylation, de polymérisation et d’isomérisation en synthèse organique. L’intermédiaire réactif alkyl fluorosulfate est responsable de l’activité catalytique. Voici quelques exemples de cette réaction :
- Alkylation d’oléfines et d’isoparaffines
- Formation de carburants à indice d’octane élevé à partir d’hydrocarbures à faible indice d’octane
- Production d’aromatiques alkylées et alkylation du phénol en tert-butylphénol.
De plus, elle est utilisée dans des réactions de polymérisation, telles que la polymérisation du tétrahydrofurane, de l’éthylène en hydrocarbures insaturés à longue chaîne et du trioxane en polyoxyméthylène. L’isomérisation des hydrocarbures C7, du pentène et du méthylpentène est également catalysée par l’acide fluorosulfurique.
La production sélective de bêta-naphtol à partir de naphtalène par hydroxylation catalytique avec du peroxyde d’hydrogène est obtenue en utilisant une combinaison d’acide fluorosulfurique et de pentafluorure d’antimoine comme système catalyseur.
3.4. Utilisations de l’acide fluorosulfurique dans la purification du fluor
L’acide fluorosulfurique offre une alternative au fluorure de sodium pour éliminer le fluorure d’hydrogène du fluor élémentaire. Contrairement au fluorure de sodium, qui forme du fluorure d’hydrogène de sodium peu soluble, le produit formé avec l’acide fluorosulfurique peut être éliminé par distillation.
4. Risques de sécurité et manipulation de l’acide fluorosulfurique
L’acide fluorosulfurique présente des risques importants pour la santé humaine en raison de sa nature corrosive et de sa réactivité. Le contact avec les yeux, la peau ou les muqueuses peut entraîner de graves brûlures et des lésions tissulaires.
L’exposition aux vapeurs peut irriter les voies respiratoires. L’hydrolyse de l’acide fluorosulfurique en présence d’humidité génère du fluorure d’hydrogène et de l’acide sulfurique, ce qui aggrave les effets corrosifs.
Le fluorure d’hydrogène a des propriétés toxicologiques uniques ; il pénètre dans la peau et provoque des lésions tissulaires profondes. Sa capacité à chélater les ions calcium et magnésium perturbe le métabolisme cellulaire.
Le strict respect des protocoles de sécurité est impératif lors de la manipulation de l’acide fluorosulfurique. Un équipement de protection individuelle, comprenant une protection respiratoire, des gants résistants aux produits chimiques, une protection des yeux et une combinaison intégrale dans les cas graves, est obligatoire.
Les procédures d’urgence en cas d’incident d’exposition nécessitent une décontamination immédiate avec de l’eau et une solution de gluconate de calcium, suivie de soins médicaux. L’ingestion nécessite l’administration de lait de magnésie ou d’une solution de gluconate de calcium.
L’acide fluorosulfurique peut enflammer des matières organiques dans des conditions spécifiques. Les déversements doivent être manipulés avec une extrême prudence, en utilisant de grandes quantités d’eau pour la dilution tout en évitant la formation de brouillards corrosifs.
L’ajout d’acide sulfurique concentré froid, suivi d’une dilution et d’une neutralisation à la chaux, est recommandé pour les petits déversements.
Référence
- Acide fluorosulfurique ; Encyclopédie de chimie industrielle d’Ullmann. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a11_431.pub2
