Acide chloroacétique: réactions, production and utilisations
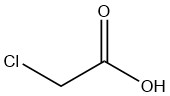
L’acide chloroacétique pur est un solide cristallin incolore, hygroscopique, qui se présente sous de nombreuses formes cristallines. Il n’existe pas dans la nature et a été découvert pour la première fois comme produit de chloration de l’acide acétique par N. LEBLANC en 1841. Il a été synthétisé en 1857 par R. HOFFMANN, qui a chloré l’acide acétique en utilisant la lumière du soleil pour initier la réaction.
L’acide chloroacétique et son sel de sodium sont les plus importants industriellement et économiquement des trois produits de chloration de l’acide acétique.
Table des matières
1. Propriétés de l’acide chloroacétique
L’acide chloroacétique a une excellente solubilité dans l’eau et une bonne solubilité dans le méthanol, l’acétone, l’éther diéthylique et l’éthanol, mais n’est que peu soluble dans les hydrocarbures et les hydrocarbures chlorés.
1.1. Réactions chimiques de L’acide chloroacétique
La grande réactivité du groupe acide carboxylique et la facilité de substitution de l’atome α-Cl sont directement liées. En conséquence, l’acide chloroacétique est un intermédiaire organique synthétique courant, soit sous forme d’acide lui-même, soit sous forme de dérivé d’acide (par exemple, sel, ester, anhydride, chlorure d’acyle, amide, hydrazide, etc.). Certaines réactions importantes utilisées pour les applications industrielles sont les suivantes.
La réaction avec des bases inorganiques, des oxydes et des carbonates ou avec des bases organiques donne des sels ; certains sels forment des adduits avec l’acide chloroacétique. Le chloroacétate de sodium est un produit commercial important.
Les esters d’acide chloroacétique sont obtenus par réaction avec des alcools ou des oléfines ; le chloroacétate de méthyle, le chloroacétate d’éthyle et le chloroacétate de tert-butyle sont également importants sur le plan industriel.
Le chlorure de chloroacétyle est produit à partir de l’acide par réaction avec POCl3, PCl3, PCl5, le chlorure de thionyle (SOCl2), le phosgène (COCl2), etc.
L’acide chloroacétique réagit avec le chlorure de chloroacétyle pour former de l’anhydride bis(chloroacétique), qui peut également être obtenu par déshydratation de l’acide chloroacétique avec P2O5 ou par réaction de l’acide chloroacétique avec l’anhydride acétique.
Le chlorure de chloroacétyle forme des anhydrides mixtes avec d’autres acides carboxyliques, par exemple l’anhydride chloroacétique acétique.
La substitution nucléophile de l’atome de chlore est une réaction importante lorsque le produit est utilisé comme intermédiaire dans les synthèses organiques. Par exemple, le chauffage de solutions aqueuses neutres ou basiques hydrolyse l’atome de chlore. Il s’agit d’une méthode industrielle de production d’acide glycolique (acide hydroxyacétique) et d’acide diglycolique (acide 2,2′-oxydiacétique).
Le chauffage des sels donne le glycolide, la 1,4-dioxine-2,5-dione. La réaction avec le sulfure d’hydrogène de sodium ou de potassium forme de l’acide thioglycolique et de l’acide thiodiglycolique.
La réaction avec l’ammoniac donne soit de l’acide aminoacétique (glycine) comme produit principal, soit, selon les conditions de réaction, de l’acide nitrilotriacétique. Si le chloroacétate de méthyle réagit avec l’ammoniac à basse température, on obtient du chloroacétamide.
Par réaction avec des amines tertiaires en solution alcaline, diverses bétaïnes commercialement importantes sont formées (par exemple, la N-lauryl bétaïne).
Les composés aromatiques, tels que le naphtalène, subissent une substitution électrophile avec de l’acide chloroacétique sur des catalyseurs appropriés pour former des acides arylacétiques.
La réaction avec le cyanure de potassium dans une solution neutre donne l’acide cyanoacétique commercialement important, qui est utilisé comme intermédiaire dans la production de caféine synthétique. La réaction avec l’iodure de potassium forme de l’acide iodoacétique.
Les acides phénoxyacétiques correspondants, dont certains ont une importance industrielle, sont fabriqués par éthérification du phénol en présence d’hydroxyde de sodium. Un autre procédé de formation d’éthers industriellement significatif donne des dérivés carboxyméthyliques à degré d’éthérification relativement élevé par réaction de polysaccharides, tels que cellulose, amidon, guar, etc., en milieu hydroxyde de sodium fortement alcalin.
2. Production d’acide chloroacétique
Une multitude de méthodes ont été proposées et brevetées pour la production d’acide chloroacétique. Historiquement, l’hydrolyse du 1,1,2-trichloroéthylène catalysée avec de l’acide sulfurique (1) et la chloration catalysée de l’acide acétique avec du chlore (2) ont été utilisées pour produire de l’acide chloroacétique à l’échelle industrielle, cependant, seul ce dernier (et plus ancien) est maintenant utilisé.
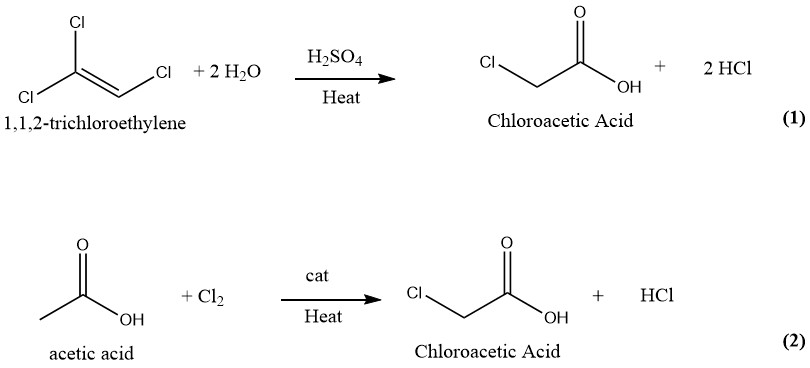
2.1. Hydrolyse du trichloroéthylène
Des quantités égales de trichloroéthylène et d’acide sulfurique à 75% sont mises à réagir à 130-140 ° C dans un processus continu de sorte qu’avec une conversion complète du trichloroéthylène, le mélange réactionnel résultant contienne environ 50% d’acide chloroacétique et 1 à 2% d’eau.
Ce mélange est distillé sous vide pour donner de l’acide chloroacétique pur. Au cours de ce processus, les vapeurs sont lavées avec de l’eau, qui est renvoyée à l’acide sulfurique comme diluant.
Le chlorure d’hydrogène gazeux résultant est lavé avec le trichloréthylène frais puis purifié par congélation et absorption dans l’eau. Le trichloroéthylène (1500–1850 kg) et le H2SO4 (600 kg, 95%) donnent 1000 kg de produit fini et 700–750 kg de gaz HCl comme sous-produit.
La méthode au trichloroéthylène produit de l’acide chloroacétique très pur sans acide di- ou trichloroacétique. La procédure de purification consiste en une séparation du trichloroéthylène, de l’acide sulfurique et de l’eau.
Malgré la pureté de l’acide chloroacétique formé, cette méthode est tombée en désuétude en raison du coût élevé du trichloroéthylène et de la grande quantité d’HCl produit.
2.2. Chloration de l’acide acétique
2.2.1. La synthèse
Cette méthode convertit l’acide acétique en acide chloroacétique avec une sélectivité élevée. Ceci est réalisé en utilisant des catalyseurs appropriés. Lorsque l’anhydride acétique est le catalyseur, le mécanisme de réaction est le suivant :
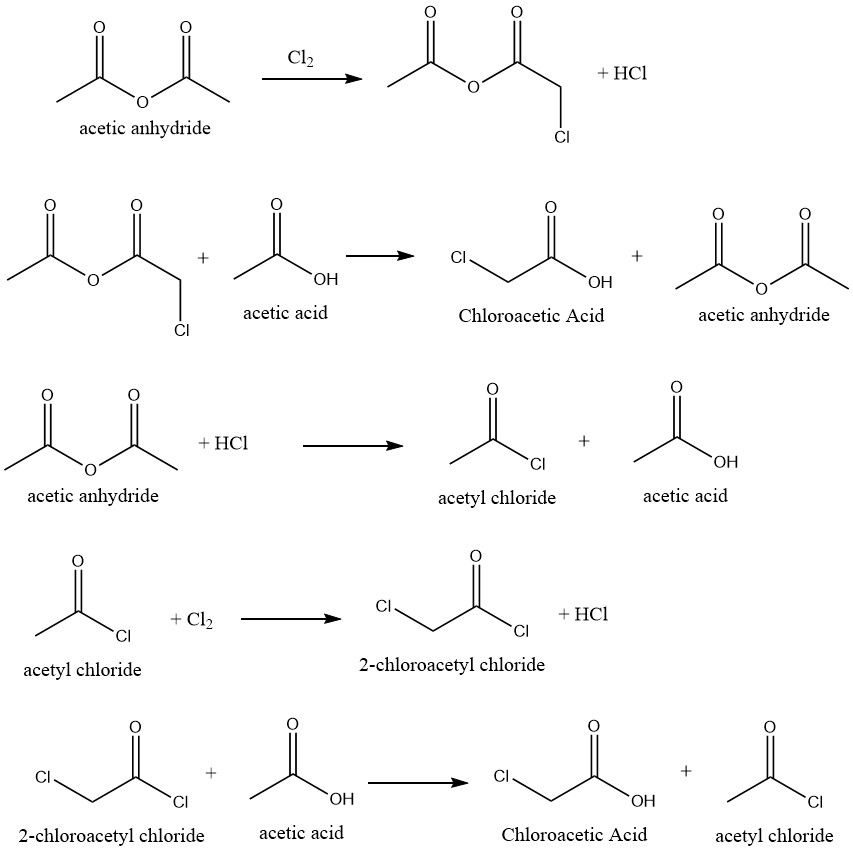
Divers inhibiteurs ont également été proposés pour éliminer la formation d’acide dichloroacétique, qui résulte de la chloration de l’acide chloroacétique dans le mélange brut. Cela élimine ou réduit le processus de purification pour les qualités techniques.
2.2.2. Purification
Le haut degré de pureté requis pour de nombreux produits ne peut être obtenu qu’en séparant les acides di- et trichloroacétiques.
La distillation fractionnée ne convient pas car les points d’ébullition des trois acides acétiques chlorés sont si proches. La distillation azéotropique et la distillation extractive ont été suggérées pour séparer l’acide dichloroacétique; il est cependant douteux que ces méthodes soient utilisées.
Un procédé de purification important sur le plan industriel est la cristallisation sans utilisation de solvant. Il est basé sur le point de fusion plus élevé de la modification α de l’acide chloroacétique. Les acides di- et trichloracétiques sont éliminés dans la liqueur mère.
La cristallisation s’effectue soit dans des cristalliseurs à doigts fixes, soit dans des cristalliseurs agités. Avec ce dernier, la liqueur mère est séparée de la suspension cristalline après cristallisation à l’aide d’une centrifugeuse.
Le produit est lavé avec de l’eau ou de l’acide acétique et évacué. L’acide chloroacétique est généralement fondu et transformé en flocons. Dans les machines fixes, la cristallisation est réalisée à l’aide de doigts froids.
Lorsque tout l’acide chloroacétique a cristallisé, la liqueur mère est vidangée ; le produit cristallin pur est ensuite fondu et réduit en flocons.
Une autre méthode de purification qui a été décrite est un procédé de cristallisation en couche mince avec la matière première. L’utilisation d’une teneur en eau de 5 à 25 % sans solvant organique est également possible.
Des solvants ont également été utilisés pour la cristallisation. Les solvants, tels que le tétrachlorure de carbone, le dichlorométhane ou les hydrocarbures à trois atomes de chlore (par exemple le trichloroéthylène), donnent des cristaux faciles à filtrer.
Le point commun à toutes ces méthodes de cristallisation est l’obtention d’une liqueur mère constituée d’acide acétique, d’acide chloroacétique et d’acides di- et trichloroacétique. Dans les cas les plus favorables, ce mélange est encore chloré pour former l’acide trichloroacétique industriellement utile.
Pendant ce temps, une méthode de purification plus importante est l’hydrodéchloration catalytique des sous-produits indésirables d’acide dichloro- et trichloroacétique. Les acides di- et trichloroacétiques dans l’acide brut chloré peuvent être déchlorés par hydrogénation catalytique à température élevée pour former de l’acide chloroacétique ou de l’acide acétique. Le palladium sur un support, tel que le carbone ou le gel de silice, est normalement employé.
Lorsque la réaction est effectuée en phase vapeur, l’acide dichloroacétique est déchloré principalement en acide acétique. Cependant, lorsque le Pd est utilisé sur un support inerte finement dispersé dans la phase liquide à 130–150°C, l’acide dichloroacétique est déchloré sélectivement pour former de l’acide chloroacétique.
Des modifications de cette procédure, telles que la pulvérisation de l’acide brut avec de l’hydrogène gazeux sous vide ou le ruissellement de l’acide sur le catalyseur dans le lit fixe, ont également été décrites.
La sélectivité est augmentée si HCl est mélangé avec l’acide brut avant lui et si l’hydrogène en circulation entre en contact avec le catalyseur dans le lit fixe. Les chlorures et anhydrides d’acides sont saponifiés avant déchloration.
Un catalyseur particulièrement actif et sélectif est le Pd sur gel de silice (taille des particules 40–200 mm). Des résultats particulièrement bons sont obtenus en utilisant un additif co-catalytiquement efficace, tel que l’acétate de sodium.
Le catalyseur peut être rendu plus efficace par enrichissement du métal noble à sa surface. Le catalyseur usé peut être réactivé par traitement au chlore. Les catalyseurs au Pd sur des supports de charbon actif optimisés donnent des quantités moindres de sous-produits de surréduction (aldéhydes, etc.).
Pour l’étape d’hydrogénation, un réacteur à boucle peut être utilisé.
Une réduction de l’acide dichloroacétique de 2000 à 210 ppm peut être obtenue par traitement de l’acide chloroacétique brut avec des catalyseurs de métaux non nobles sans hydrogène à des températures comprises entre 100 et 140°C.
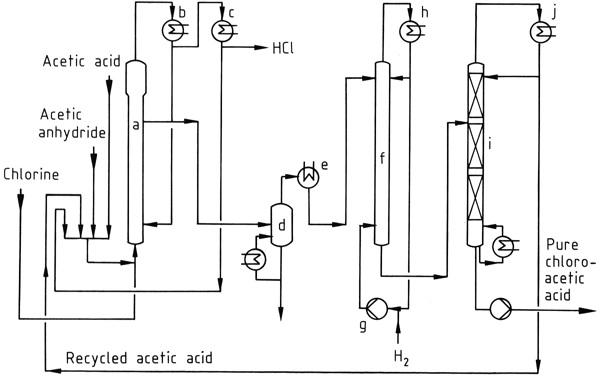
Un processus de chloration à l’échelle industrielle est illustré à la figure 1. Le mélange d’acide acétique, d’anhydride acétique et de chlorure d’acétyle recyclé est chloré à 90–140 ° C dans le réacteur (a) ou dans plusieurs réacteurs en cascade.
Seules des traces de chlore sont encore présentes dans le gaz HCl formé. L’acide chloroacétique, l’acide acétique et l’anhydride acétique sont condensés en utilisant des condenseurs refroidis à l’eau (b) puis renvoyés au réacteur.
Le chlorure d’acétyle entraîné dans le gaz HCl est condensé (c) dans un procédé ultérieur à basse température et recyclé. Le gaz HCl est ensuite purifié et généralement converti en acide chlorhydrique aqueux concentré.
Les acides acétiques bruts peuvent être distillés sous vide (d) avant l’étape d’hydrogénation mais cette étape de purification n’est pas obligatoire. Les acides di- et trichloroacétiques dans le matériau distillé brut sont déchlorés (f) en acide chloroacétique à 120–150°C, en utilisant un catalyseur au palladium et un grand excès d’hydrogène.
L’acide acétique est prélevé en tête de la colonne de fractionnement sous vide (i) ; le produit de fond est de l’acide chloroacétique pur.
Facultativement, l’acide chloroacétique peut être davantage purifié par distillation pour éliminer les impuretés à haut point d’ébullition telles que les produits de condensation des aldéhydes formés lors de l’étape d’hydrogénation.
3. Utilisations de l’acide chloroacétique
La majeure partie de l’acide chloroacétique produit est utilisée pour fabriquer plusieurs centaines de milliers de tonnes par an de carboxyméthylcellulose, CMC.
L’amidon peut être mis à réagir avec de l’acide chloroacétique pour donner du carboxyméthylamidon, qui est aussi largement utilisé que le CMC. D’autres polysaccharides modifiés avec de l’acide chloroacétique sont moins importants.
Une autre application majeure est la production d’herbicides à base d’acides arylhydroxyacétiques (acides chlorophénoxyalcanoïques). Ces herbicides sont parmi les plus largement utilisés.
L’acide chloroacétique et le chloroacétate de méthyle sont également utilisés pour fabriquer l’insecticide diméthoate et les herbicides bénazoline et b-naphtyloxyacétate de méthyle.
Un troisième débouché important pour l’acide chloroacétique est la fabrication de l’acide thioglycolique (acide mercaptoacétique), obtenu par réaction de l’acide chloroacétique avec de l’hydrogène sulfuré de sodium ou de potassium ou d’autres composés soufrés.
Il est utilisé sous forme de sel, d’ester ou d’un autre dérivé. La plus grande quantité est utilisée pour produire des stabilisants pour le poly(chlorure de vinyle). Par ailleurs, l’acide thioglycolique et ses esters sont utilisés en cosmétique capillaire.
Une autre application industrielle importante est la production de bétaïnes à longue chaîne comme la N-lauryl bétaïne qui sont utilisées comme tensioactifs pour les nettoyants ou les produits de soins personnels.
Une utilisation mineure de l’acide chloroacétique est dans la production d’acide glycolique par saponification avec un hydroxyde alcalin.
En dehors des grands domaines d’application mentionnés ci-dessus, l’acide chloroacétique et ses dérivés sont utilisés dans une multitude d’autres réactions de synthèse organique. Par exemple, la caféine et les barbituriques, qui sont d’importants hypnotiques, peuvent être fabriqués à partir d’acide cyanoacétique ou de ses esters.
L’acide chloroacétique se condense avec les hydrocarbures aromatiques pour former des acides arylacétiques. La réaction avec le naphtalène donne l’acide 1-naphtylacétique comme produit principal et l’acide 2-naphtylacétique comme sous-produit. Les deux substances favorisent la croissance des plantes.
L’acide chloroacétique est également important dans la synthèse de la coumarine et de la vitamine B6.
Référence
-
Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
