Tetrahidrofurano: Propiedades, Reacciones, Producción y Usos
El tetrahidrofurano (THF), también conocido como oxolano, es un éter cíclico con la fórmula química C4H8O. Tiene una amplia aplicación en la industria química.
Tabla de contenido
1. Propiedades físicas del tetrahidrofurano
El tetrahidrofurano (THF) es un líquido polar, volátil e incoloro disponible comercialmente con una pureza mínima del 99,9% en peso (cuando se destila). Posee un olor característico parecido a la acetona. El THF es completamente miscible con agua, alcoholes, éteres y otros disolventes comunes.
La Tabla 1 presenta algunas propiedades físicas del THF.
| Propiedad | Valor |
|---|---|
| Masa molar | 72,1 g/mol |
| Punto de ebullición | 66°C |
| Punto de fusión | -108,5 °C |
| Temperatura crítica | 267 °C |
| Presión crítica | 5,19 MPa |
| Densidad crítica | 0,322 g/cm3 |
| Densidad a 20 °C | 0,886 |
| Índice de refracción a 20 °C | 1,4073 |
| Capacidad calorífica específica | 1,765 J g⁻¹ K⁻¹ |
| Calor de vaporización (66 °C, 101,3 kPa) | 435 J/kg |
| Calor de combustión | -35.141 kJ/kg |
| Límites de explosividad en el aire (25 °C) | 1,5 % en volumen (inferior), 12,0 % en volumen (superior) |
| Punto de inflamación (Abel-Pensky) | -22 °C |
| Momento dipolar | 5,84 × 10⁻³⁰ C·m |
| Constante dieléctrica (20 °C) | 7.6 |
2. Reacciones químicas del tetrahidrofurano
El tetrahidrofurano es un valioso material de partida para reacciones importantes. Estos incluyen la polimerización catiónica con apertura simultánea de anillo de THF para producir éteres de glicol bifuncionales de alto peso molecular con varias longitudes de cadena.
Estos productos son de importancia económica en la producción de plásticos esenciales. Además, las reacciones de escisión del anillo de tetrahidrofurano son la base para la deshidratación a butadieno, la oxidación a ácido succínico, y carboxilación a ácido adípico, o γ-valerolactona.
THF es el medio de reacción preferido para realizar reacciones o reducciones de Grignard utilizando reactivos como LiAlH4. También se utiliza como ligando en complejos de coordinación, como los empleados ocasionalmente en polimerizaciones estereoespecíficas.
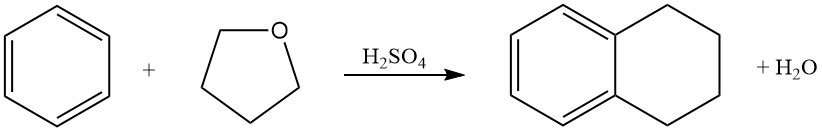
El benceno reacciona con tetrahidrofurano en ácido sulfúrico para producir tetralina (1,2,3,4-tetrahidronaftaleno).
Sin embargo, el THF reacciona fácilmente con el oxígeno (por ejemplo, al entrar en contacto con el aire), formando un hidroperóxido inestable como producto primario. La adición de hidroquinona o 2,6-di-terc-butil-p-cresol (BHT) (p. ej., 250 mg/kg) puede inhibir la formación de peróxido. La destilación de peróxidos que contienen tetrahidrofurano concentra los peróxidos, lo que genera un alto riesgo de explosión, incluso a escala de laboratorio.
3. Producción de tetrahidrofurano
3.1. Producción de tetrahidrofurano a partir de acetileno y formaldehído
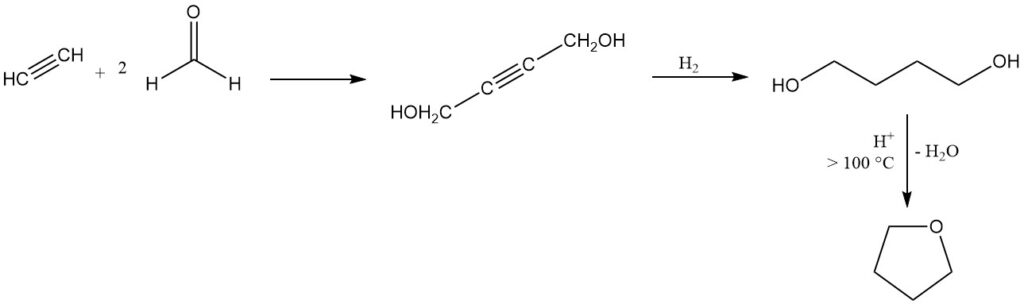
El tetrahidrofurano se produce mediante el proceso Reppe, desarrollado en la década de 1930, que sigue siendo un método industrial dominante en Europa y Estados Unidos.
En este proceso, el acetileno reacciona con formaldehído para producir 2-butino-1,4-diol, seguido de una hidrogenación a 1,4-butanodiol que luego se somete a una ciclación catalizada por ácido con eliminación de agua por encima de 100 °C para producir THF.
Para esta ciclación son adecuados varios catalizadores, entre ellos ácidos inorgánicos, aluminosilicatos ácidos y óxidos de metales terrestres o de tierras raras. Se puede lograr una conversión casi cuantitativa y un rendimiento cercano al 100 % en un proceso continuo a presión atmosférica utilizando alúmina como catalizador.
Esto requiere una destilación continua del tetrahidrofurano formado fuera de la mezcla de reacción y al mismo tiempo se alimenta 1,4-butanodiol puro con una tasa de consumo equivalente. Este método tiene una alta eficiencia del catalizador, lo que permite una producción significativa de THF por unidad de catalizador.
BASF había desarrollado un proceso de media presión para la conversión selectiva de butanodiol crudo en THF con una mínima energía adicional.
La mezcla de THF-vapor obtenida de la ciclación se rectifica primero para aislar el azeótropo correspondiente (5,3% en peso de agua, punto de ebullición 62,3 °C), que se trata con hidróxido alcalino, seguido de destilación para obtener THF anhidro.
Los procesos industriales pueden superar la formación de mezclas de azeótropos mediante destilación bajo presión.
3.2. Producción de tetrahidrofurano mediante acetoxilación de butadieno
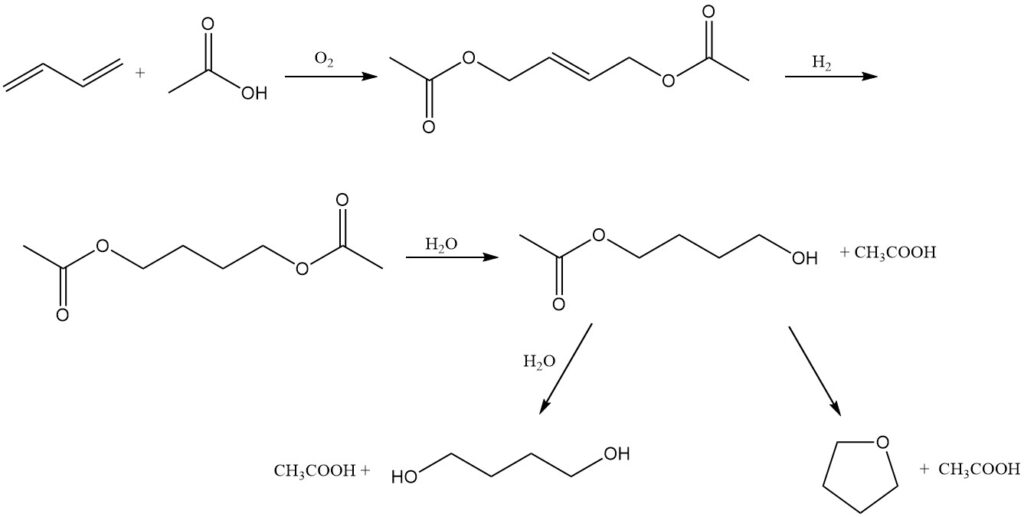
Mitsubishi-Kasei Corporation en Japón ofrece una ruta alternativa para la coproducción de 1,4-butanodiol y tetrahidrofurano, utilizando butadieno como material de partida. Este proceso se puede explicar por las siguientes reacciones:
Oxidación: el butadieno se oxida a 3 MPa y 80 °C en presencia de un catalizador de paladio-telurio, ácido acético y una mezcla de nitrógeno y oxígeno. Esta reacción produce 1,4-diacetoxi-2-buteno.
Hidrogenación: El 1,4-diacetoxi-2-buteno obtenido se hidrogena luego para formar 1,4-diacetoxibutano.
Hidrólisis: finalmente, el 1,4-diacetoxibutano se hidroliza a 1,4-butanodiol o THF.
3.3. Producción de tetrahidrofurano mediante proceso de óxido de propileno
Arco produce 1,4-butanodiol mediante un proceso que involucra los siguientes pasos:
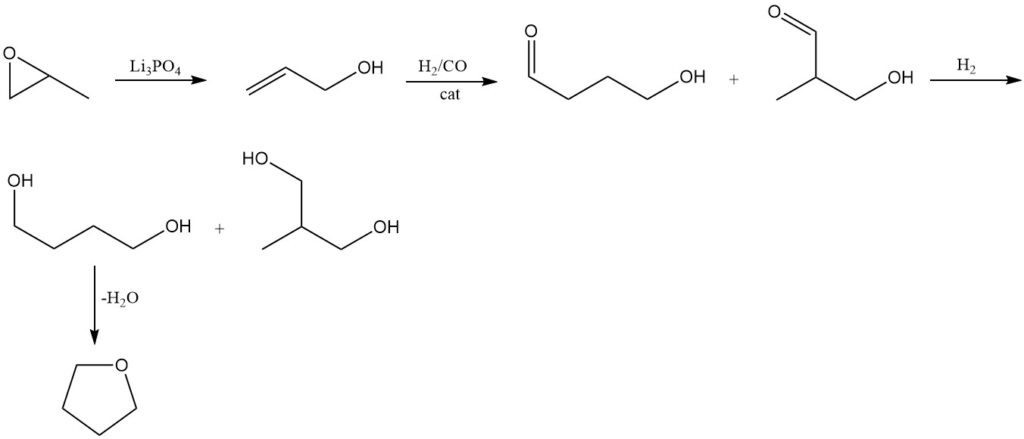
El óxido de propileno se isomeriza a alcohol alílico utilizando métodos convencionales a 250-300 °C y 1 MPa de presión sobre un catalizador de ortofosfato de trilitio (Li3PO4).
El alcohol alílico resultante se somete a hidroformilación mediante el proceso de Kuraray. Esta reacción produce 4-hidroxibutiraldehído como producto principal junto con 3-hidroxi-2-metilpropionaldehído como subproducto.
La hidrogenación posterior de los aldehídos obtenidos forma 1,4-butanodiol como producto principal, acompañado de la formación de 2-metil-1,3-propanodiol.
Como en los métodos anteriores, el tetrahidrofurano se produce deshidratando 1,4-butanodiol utilizando un catalizador ácido.
3.4. Producción de tetrahidrofurano mediante hidrogenación de anhídrido maleico
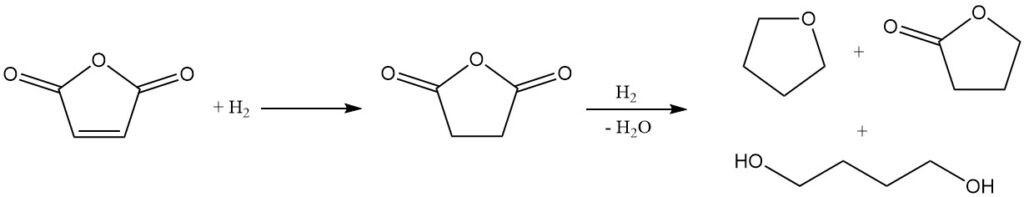
Debido a su estructura química, el anhídrido maleico es un material de partida prometedor para la síntesis de butanodiol, THF y γ-butirolactona. Mitsubishi-Kasei desarrolló e implementó originalmente un proceso a escala industrial utilizando anhídrido maleico. Sin embargo, desde entonces abandonaron este método en favor de su nuevo proceso de acetoxilación de butadieno.
Varias empresas, incluidas Davy-McKee Ltd., BP, Sohio y Shinwha Petrochemical, han adoptado procesos similares para la producción de butanodiol y tetrahidrofurano. Por ejemplo, Shinwha Petrochemical en Corea del Sur opera una planta basada en el proceso McKee, con una capacidad de 20.000 toneladas de butanodiol por año.
El paso inicial de este proceso es la hidrogenación en fase de vapor del maleato de etilo. Las condiciones de reacción se pueden manipular para controlar la proporción de THF a butanodiol en la mezcla del producto final.
Existe un interés creciente en el uso de anhídrido maleico como materia prima para la producción de tetrahidrofurano, y parece estar ganando terreno como posible reemplazo del proceso Reppe.
3.5. Producción de tetrahidrofurano mediante el proceso de n-butano-anhídrido maleico
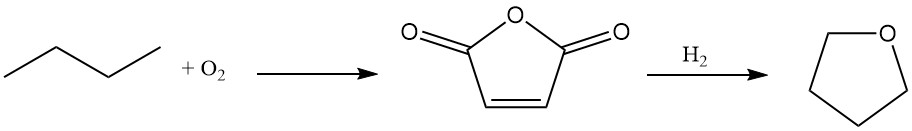
Du Pont ofrece un novedoso proceso de dos etapas para la síntesis de tetrahidrofurano utilizando n-butano como material de partida.
El n-butano se oxida a anhídrido maleico con un alto rendimiento (70–75 %) utilizando un catalizador de oxidación único, transportable y resistente a la abrasión.
La solución acuosa de ácido maleico resultante se hidrogena sobre un catalizador de paladio dopado con renio especializado. Este paso ofrece flexibilidad, permitiendo la producción selectiva de butanodiol o THF según los requisitos del proceso.
El proceso se ha puesto a prueba y se ha implementado con éxito en la provincia española de Asturias, con una capacidad de producción anual de 45.000 toneladas.
3.6. Producción de tetrahidrofurano mediante procesos de pentosano/furfural
El interés en la producción de tetrahidrofurano a partir de furfural ha aumentado debido al uso de recursos renovables. Los pentosanos, abundantes en los productos de desecho agrícolas, son los materiales de partida.
El proceso de producción de THF a partir de furfural implica dos pasos catalíticos:
- El furfural se somete a descarbonilación catalítica para formar furano.
- Luego se hidrogena el furano para producir THF.
4. Usos del tetrahidrofurano
El tetrahidrofurano se utiliza en una variedad de sectores, siendo el mayor volumen como monómero para el poli(óxido de tetrametileno) (PTMO), también conocido como poli(éter de tetrametileno glicol) (PTMEG) o politetrahidrofurano (PTHF). PTMO es un componente importante en la producción de:
- Poliuretanos termoplásticos
- Fibras elásticas
- Elastómeros moldeados
- Copoliésteres
- Copoliamidas
- Recubrimientos de poliuretano
El PTMO comercial está disponible con varios nombres comerciales, incluidos Terathane (DuPont), Politetrahidrofurano (BASF) y Polymeg (Quaker Oats).
Una porción más pequeña de THF se utiliza como disolvente para aplicaciones como recubrimientos, adhesivos y barnices especiales basados en materiales como poli(cloruro de vinilo) (PVC) o poliuretanos. y como cosolvente en tintas de impresión, como agente de extracción y como medio de reacción, particularmente para síntesis organometálicas en química orgánica.
También es un reactivo de laboratorio común y un intermediario en la síntesis química de productos industriales y de consumo, como nutricionales, farmacéuticos e insecticidas.
5. Toxicología del tetrahidrofurano
Una extensa investigación realizada por el Instituto de Farmacología e Higiene Industrial de BASF sugiere que el THF exhibe una toxicidad mínima, comparable a la acetona, lo que contrasta con informes anteriores probablemente basados en muestras impuras.
Los estudios en animales que implicaron exposición crónica (1 año a 1000 ppm, 2 años a 3000 ppm) al THF no revelaron síntomas de intoxicación significativos en ratas, gatos o conejos. Sin embargo, estas concentraciones (1000-3000 ppm) provocarían una irritación grave de las mucosas en humanos.
Al igual que el etanol, el cuerpo metaboliza rápidamente el THF.
Debido a sus fuertes propiedades disolventes, el tetrahidrofurano disuelve las capas externas de queratina de la piel y las membranas mucosas, penetrando rápidamente en los tejidos más profundos. Esta característica provoca una irritación grave pero no provoca sensibilización (reacción alérgica).
La formación de peróxido durante el almacenamiento puede exacerbar la irritación de la piel y el contacto con heridas o debajo de las uñas puede provocar un dolor significativo.
El THF se absorbe fácilmente a través de la piel, de forma similar al metanol. Se debe evitar el contacto prolongado con la piel y se recomienda una protección adecuada para las manos.
El límite de exposición laboral establecido al tetrahidrofurano es de 200 ppm (mL/m³). Este valor está establecido para abordar la irritación local de las membranas mucosas causada por los vapores de THF, no sus efectos narcóticos, que requieren concentraciones mucho más altas.
Referencias
- Tetrahydrofuran, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_221.pub3
- Polyethers, Tetrahydrofuran and Oxetane Polymers; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.2005201816182103.a01
- Tetrahydrofuran; Hamilton & Hardy’s Industrial Toxicology. – https://onlinelibrary.wiley.com/doi/10.1002/9781118834015.ch70
