Hidroquinona: producción, reacciones y usos
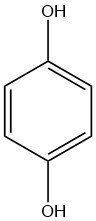
El descubrimiento de la hidroquinona se remonta a 1844, cuando WOEHLER informó por primera vez de su existencia. Es un sólido cristalino incoloro que se sintetiza añadiendo hidrógeno a la 1,4-benzoquinona.
La hidroquinona también se encuentra en la naturaleza como hidroquinona β-D-glucopiranósido (arbutina) en varias plantas, como la gayuba, el arándano rojo, la arándano rojo y ciertos tipos de pera, a menudo junto con su éter metílico, la metilarbutina.
En condiciones de ácido acuoso diluido y caliente, la arbutina se hidroliza fácilmente a hidroquinona y glucosa. De manera similar, la hidrólisis de metilarbutina da como resultado la formación de éter monometílico de hidroquinona y glucosa.
Tabla de contenido
1. Producción de hidroquinona
Se utilizan tres procesos para la producción industrial de hidroquinona: hidroperoxidación de p-diisopropilbenceno, hidroxilación de fenol y oxidación de anilina.
1.1. Hidroperoxidación de p-Diisopropilbenceno
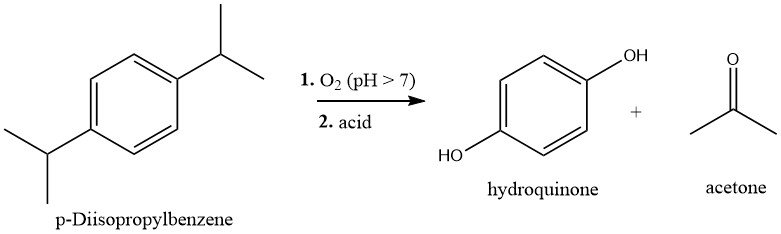
El p-diisopropilbenceno (p-DIPB) se sintetiza mediante la alquilación de Friedel-Crafts de benceno con propeno. El p-DIPB resultante se purifica y luego se oxida con aire en condiciones ligeramente alcalinas a 80-90°C para formar dihidroperóxido (DHP).
El DHP puede extraerse de la mezcla de reacción u obtenerse mediante cristalización y posteriormente escindirse para producir hidroquinona y acetona mediante un reordenamiento de Hock catalizado por ácido. Este proceso implica tratar la solución de DHP con catalizador de ácido sulfúrico (0,2-1,0%) a 60-80°C. A continuación se aísla y cristaliza la hidroquinona.
El rendimiento global de hidroquinona, referido a p-DIPB, es de aproximadamente el 80%.
1.2. Hidroxilación de fenol
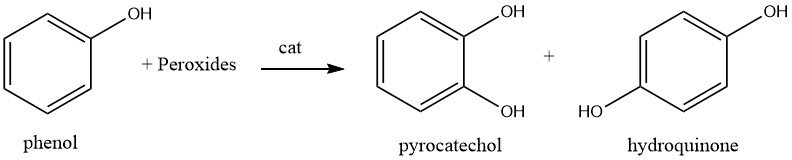
La hidroxilación del fenol utilizando peróxido de hidrógeno a una temperatura de alrededor de 80 °C y un catalizador como un ácido mineral fuerte, sal de hierro (II) o cobalto (II), da como resultado una mezcla de hidroquinona y catecol. La proporción de catecol a hidroquinona se puede variar de 3:1 a 0,1:1, con una proporción típica de 1,5:1 donde el catecol es el producto principal.
El mecanismo de la reacción es de naturaleza iónica, mediante el cual el peróxido de hidrógeno es polarizado por el catalizador ácido fuerte y posteriormente el fenol se hidroxila. Los isómeros resultantes se separan mediante una serie de extracciones y operaciones de extracción con disolvente.
La proporción de productos de hidroquinona y catecol puede verse afectada por la presencia de superácidos o zeolitas de forma selectiva. Por ejemplo, el uso de un polímero de perfluorosulfonato de Nafion modificado con vanadio en la oxidación de fenol dio como resultado una relación hidroquinona-catecol de 12,5:1.
El uso de una zeolita de forma selectiva en la hidroxilación de fenol condujo a una selectividad por hidroquinona del 99%.
1.3. Oxidación de la anilina
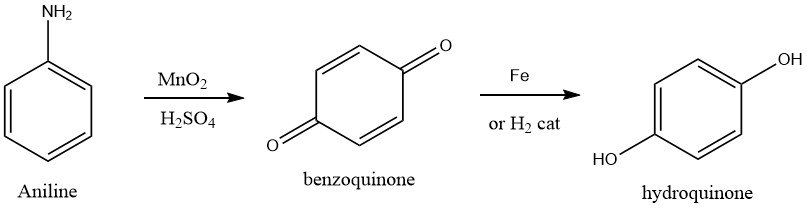
Históricamente, la producción de hidroquinona se ha logrado mediante oxidación de anilina, que se considera el proceso más antiguo conocido. Para lograr esto, la anilina se oxida con un exceso de 15-20 % de dióxido de manganeso en una solución acuosa de ácido sulfúrico mantenida a 0-5 °C.
Esta reacción produce p-benzoquinona, que se separa de la mezcla de reacción mediante extracción con vapor y se recoge. La reacción produce un subproducto, sulfato de manganeso, que puede obtenerse de la mezcla de reacción agotada y venderse para fines agrícolas.
Luego se obtiene hidroquinona a partir del intermedio de p-benzoquinona mediante reducción con hierro a 55-65 °C o mediante hidrogenación catalítica. Normalmente, el producto de calidad técnica se cristaliza, se aísla de la corriente acuosa mediante centrifugación y se seca usando un secador de vacío. El rendimiento global de hidroquinona a partir de anilina es aproximadamente del 85%.
La oxidación de anilina es un proceso por lotes y, como tal, requiere relativamente mucha mano de obra. Las condiciones de procesamiento también son altamente abrasivas porque se utiliza mineral de manganeso molido y hierro finamente dividido, lo que exige un mantenimiento constante.
La eliminación de coproductos inorgánicos, que constituyen aproximadamente el 85% del peso total de los productos, plantea un problema medioambiental importante.
1.4. Otros procesos
La oxidación de Baeyer-Villiger de una cetona aromática sustituida con 4-hidroxi da ésteres de carboxilato de dioles aromáticos con un alto rendimiento y una eficiencia del 97%.
La oxidación microbiológica del benceno o del fenol es altamente selectiva y produce hidroquinona con una selectividad notable.
La oxidación del fenol al aire en presencia de un catalizador de cobre proporciona p-benzoquinona con una selectividad superior al 90%. La oxidación del benceno a hidroquinona se puede lograr utilizando cloruro de cobre (I) o titanio.
La oxidación del benceno inducida por ozono en un medio acuoso da como resultado la formación de hidroquinona y p-benzoquinona.
Los métodos preparativos adicionales implican la hidrólisis ácida de nitrobenceno o p-nitrosofenol, carbonilación de acetileno, oxidación electroquímica de benceno o fenol en ácido sulfúrico diluido seguida de reducción e hidrogenación catalítica de nitrobenceno en solución ácida.
Además, el p-isopropenilfenol se puede obtener mediante craqueo alcalino de bisfenol A y luego hacerlo reaccionar con peróxido de hidrógeno acuoso al 30% en condiciones ácidas para producir hidroquinona.
2. Reacciones químicas de la hidroquinona
La mayoría de los agentes oxidantes pueden convertir fácilmente la hidroquinona en p-benzoquinona. Incluso las soluciones acuosas neutras de hidroquinona se oscurecerán al exponerse al aire.
La velocidad de oxidación de la hidroquinona por el aire se acelera en una solución alcalina. El producto de oxidación puede reaccionar con agua para formar 1,2,4-bencenotriol y una mayor oxidación puede conducir a la formación de ácidos húmicos.
El potencial redox E0 de la hidroquinona es de 699 mV, con un potencial de media onda E1/2 de 560 mV a pH 0 y 234 mV a pH 5-6. La pérdida de un electrón y la eliminación de un protón durante la oxidación de la hidroquinona da lugar a un radical semibenzoquinona relativamente estable, que permite que la hidroquinona actúe como antioxidante.
Una segunda transferencia de un electrón y la eliminación de un protón conducen a la formación de p-benzoquinona. El complejo equimolar de transferencia de carga quinhidrona está formado por hidroquinona y p-benzoquinona, siendo el complejo de quinhidrona típicamente de color negro verdoso oscuro y con un punto de fusión de 171 °C.
La hidroquinona es un agente reductor con potencial de reducción adecuado para reducir el haluro de plata. Los granos de haluro de plata que han sido expuestos a la luz se reducen mucho más rápido que los granos no expuestos o subexpuestos, debido a cambios en los cristales de haluro de plata expuestos que reducen la barrera energética para la reacción con la hidroquinona para formar plata elemental y p-benzoquinona.
Se agrega sulfito de sodio a la solución de desarrollo para prevenir la formación de quinhidrona al convertir la p-benzoquinona en 2,5-dihidroxibencenosulfonato de sodio, un agente de desarrollo más débil que la hidroquinona.
La reactividad de la hidroquinona es generalmente similar a la del fenol, pudiendo uno o ambos grupos hidroxilo convertirse en un éter o éster.
Los derivados de oxígeno comercialmente importantes incluyen éter monometílico de hidroquinona, éter dimetílico de hidroquinona y éter bis(2-hidroxietílico) de hidroquinona. Los ésteres de hidroquinona se someten al reordenamiento de Fries para dar hidroquinonas sustituidas con acilo.
La hidroquinona y sus éteres se pueden alquilar en C en condiciones de Friedel-Crafts para producir una variedad de productos mono y disustituidos, que incluyen 2-terc-butilhidroquinona, 2,5-bis[2-(2-metilbutil)]hidroquinona y 2 -terc-butil-4-metoxifenol (BHA).
La hidroquinona también reacciona con alquilaminas o arilaminas para formar arilaminas sustituidas, incluido el p-N-metilaminofenol (generalmente comercializado como sal sulfato) y la N,N’-difenil-p-fenilendiamina.
La hidroquinona se puede clorar con cloro o cloruro de sulfurilo para proporcionar derivados que van desde monoclorados hasta tetraclorados.
La carboxilación de Kolbe-Schmitt de hidroquinona con dióxido de carbono conduce a ácido 2,5-dihidroxibenzoico (ácido gentísico), mientras que la quinizarina (1,4-dihidroxiantraquinona) se puede preparar mediante la condensación de hidroquinona con anhídrido ftálico.
La hidrogenación catalítica de hidroquinona da 1,4-ciclohexanodiol.
La sulfonación de hidroquinona da como resultado la formación de ácido mono o disulfónico de hidroquinona, típicamente aislado como la correspondiente sal de potasio.
3. Usos de la hidroquinona
La hidroquinona y sus derivados encuentran una amplia aplicación en una variedad de campos, incluida la fotografía, la industria del caucho, tintes y pigmentos, antioxidantes, productos químicos agrícolas y otras aplicaciones especializadas.
Entre estos, la mayor demanda de hidroquinona surge de su uso como revelador fotográfico, principalmente en películas en blanco y negro, litografía, mecanizado fotoquímico, microfilmes y películas de rayos X.
Muchos derivados de hidroquinona, como la sal sulfato de p-N-metilaminofenol y el 2,5-dihidroxibencenosulfonato de potasio, también se emplean en aplicaciones fotográficas.
La industria del caucho es el segundo mayor consumidor de hidroquinona para la producción de antioxidantes y antiozonantes. En particular, para este fin se utilizan varios derivados de hidroquinona, tales como N,N’-diaril-p-fenilendiaminas, hidroquinonas dialquiladas, N-alquil-p-aminofenoles, dialquil-p-fenilendiaminas y aralquil-p-fenilendiaminas.
La hidroquinona, el éter monometílico de hidroquinona y la p-benzoquinona se utilizan ampliamente en la industria del monómero vinílico para inhibir la polimerización de radicales libres durante el procesamiento y el almacenamiento.
De manera similar, la hidroquinona y varios otros derivados, como la 2-terc-butilhidroquinona, la 2-metilhidroquinona y la 2,5-di-terc-butilhidroquinona, sirven como estabilizadores para resinas de poliéster insaturado.
Además, ciertos derivados de la hidroquinona, incluidos el éter dimetílico de hidroquinona, la quinizarina, el cloroneb y el etofumesato, se utilizan en la fabricación de tintes, pigmentos, fungicidas y herbicidas.
Fluazifop-butilo es un ejemplo de una nueva familia de herbicidas que utilizan hidroquinona como material de partida.
El éter bis(2-hidroxietil) de hidroquinona, formado al hacer reaccionar hidroquinona con óxido de etileno, actúa como extensor de cadena en polímeros de uretano termoestables.
La hidroquinona y varios derivados, como los de la hidroquinona C-alquilada o C-arilada, son monómeros útiles para la preparación de una variedad de polímeros, incluidos plásticos, compuestos y fibras de alto rendimiento.
Los materiales preparados utilizando monómeros de hidroquinona exhiben altas resistencias a la tracción y al impacto, buena resistencia a la intemperie, resistencia a los disolventes, retardo de llama, transparencia a la radiación de microondas y retención de resistencia a temperaturas elevadas.
La hidroquinona (grado U.S.P.) y varios derivados se utilizan como agentes blanqueadores y despigmentantes de la piel en formulaciones tópicas.
Las aplicaciones emergentes de la hidroquinona incluyen sus propiedades de eliminación de oxígeno que pueden aprovecharse para su uso en el tratamiento de agua de calderas.
Referencia
- Hydroquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_499
