Clorometano: Propiedades, Producción y Usos
El clorometano, también conocido como cloruro de metilo, es el derivado clorado más simple del metano con la fórmula química CH3Cl. Es un gas incoloro con un olor suave y dulce que se produce naturalmente en pequeñas cantidades pero que se produce principalmente de forma industrial.
Tabla de contenido
1. Propiedades físicas del clorometano
El clorometano es un gas incoloro, inflamable e inodoro. Su solubilidad en agua depende de la temperatura y forma un azeótropo con el agua. La siguiente tabla 1 representa su solubilidad a 0,1 MPa (1 bar):
| T (°C) | Solubilidad (g de CH3Cl/kg de H2O) |
|---|---|
| 15 | 9.0 |
| 30 | 6,52 |
| 45 | 4.36 |
| 60 | 2,64 |
Las propiedades físicas importantes del clorometano se enumeran en la siguiente tabla 2:
| Propiedad | Valor |
|---|---|
| Peso molecular (PM) | 50,49 g/mol |
| Punto de ebullición a 1 bar | -24,0 °C |
| Punto de fusión | -97,7 °C |
| Presión de vapor a 20°C | 4900 mbar |
| Entalpía de vaporización | 21,67 kJ/mol |
| Entalpía de fusión en el punto de fusión | 6,4 kJ/mol |
| Densidad del líquido (25°C) | 911 kg/m3 |
| Densidad del vapor en el punto de ebullición | 2,558 kg/m3 |
| Coeficiente de expansión cúbica del líquido (0–40°C) | 0,00209 K-1 |
| Entalpía de formación de vapor (25°C, 1 bar) | -80,83 kJ/mol |
| Energía libre de Gibbs de formación de vapor (25°C, 1 bar) | -57,37 kJ/mol |
| Capacidad calorífica específica del vapor (25°C, 1 bar) | 0,807 kJ kg-1 K-1 |
| Temperatura crítica (Tc) | 143°C |
| Presión crítica | 65,9 atmósferas |
| Volumen crítico | 0,13645 ml/mol |
| Conductividad térmica del vapor | 0,00841 W K-1 m-1 |
| Conductividad térmica del líquido (20°C) | 0,161 W K-1 m-1 |
| Tensión superficial a 20°C | 16,2 mN/m |
| Viscosidad del líquido a 20°C | 0,244 cP |
| Momento dipolar | 1,86D |
| Índice de refracción del líquido (25°C) | 1,3712 |
| Constante dieléctrica del vapor a 20°C | 1.01 |
| Constante dieléctrica del líquido a 20°C | 12.9 |
| Temperatura de ignición | 618°C |
| Límite inferior de inflamabilidad en el aire | 7,1 % en volumen |
| Límite superior de inflamabilidad en el aire | 18,5% vol. |
| Coeficiente de partición aire/agua (20°C) | 0,3 |
| Coeficiente de reparto n-octanol/agua (20°C) (log Pow) | 0,91 |
2. Propiedades químicas del clorometano
El clorometano es un compuesto de cloro alifático único que es térmicamente estable. A diferencia de muchos compuestos relacionados, resiste la descomposición hasta superar los 400°C, incluso en presencia de la mayoría de los metales.
Su temperatura de autoignición en el aire es de 632 °C medida en un aparato de acero. Si bien la combustión genera principalmente CO2 y HCl, también pueden formarse trazas de COCl2 y CO. La fotooxidación produce principalmente dióxido de carbono y fosgeno.
La hidrólisis del clorometano produce metanol y cloruro de hidrógeno; sin embargo, en condiciones neutras o ácidas a temperatura ambiente, es insignificante. Una fuerte presencia de álcali acelera el proceso, reduciendo la vida media del clorometano de décadas a apenas meses.
El clorometano participa fácilmente en reacciones organometálicas con elementos como litio, magnesio, zinc y aluminio, formando compuestos como CH3MgCl y Al( CH3)3⋅AlCl3. Estos compuestos tienen aplicaciones valiosas en química orgánica preparativa y catálisis de producción de polímeros.
Tiene la capacidad de actuar como agente metilante en numerosas reacciones químicas. Sirve como reactivo en la reacción de Friedel-Crafts con benceno para la síntesis de tolueno y metila fácilmente los grupos hidroxilo para formar éteres, incluida la metilcelulosa a partir de celulosa y varios éteres metílicos de fenol.
El monoclorometano también encuentra uso industrial en la producción de compuestos de metilamonio cuaternario mediante reacción con aminas terciarias y diversas metilaminas con amoníaco.
El cloruro de metilmagnesio, reactivo de Grignard, se sintetiza directamente a partir de clorometano y magnesio, mientras que la reacción de Wurtz con sodio produce etano.
Una reacción particularmente significativa involucra clorometano y silicio, produciendo metilclorosilanos (SiCl2(CH3)2) a través de la síntesis de Müller-Rochow. Estos silanos, a su vez, son materiales de partida importantes para la producción de silicona mediante conversión a siloxanos intermediarios.
Finalmente, el clorometano se puede convertir en metilmercaptano bajo presión y temperatura elevada utilizando sulfuro de hidrógeno y sodio o transformarse en tetrametilplomo mediante reacción con una aleación de plomo monosódico.
3. Producción de clorometano
El clorometano se produce mediante dos métodos principales: hidrocloración de metanol y cloración por sustitución de metano.
En el proceso de hidrocloración de metanol, el metanol (CH3OH) reacciona con cloruro de hidrógeno (HCl) para producir monoclorometano (CH3Cl) y agua (H2O).
CH3OH + HCl → CH3Cl + H2O
En la cloración de sustitución, el metano (CH4) reacciona con el cloro (Cl2) para producir una mezcla de clorometanos y cloruro de hidrógeno.
CH4 + Cl2 → CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl
Muchas plantas industriales combinan ambos métodos para optimizar la producción. La cloración por sustitución genera la mezcla de clorometano y HCl. La hidrocloración de metanol consume parte del HCl generado para producir más clorometano y reducir el consumo general de HCl.
3.1. Producción de clorometano mediante hidrocloración de metanol
En el proceso de hidrocloración de metanol, el grupo hidroxilo (–OH) del metanol se sustituye por un átomo de cloro del cloruro de hidrógeno (HCl). Esta reacción exotérmica genera monoclorometano (CH3Cl) y agua (H2O) con una liberación de calor de 33 kJ/mol:
CH3OH + HCl → CH3Cl + H2O ⇔ ΔH = -33 kJ/mol
Esta reacción se puede realizar en fase líquida o de vapor. Tanto los métodos catalíticos como los no catalíticos existen en la fase líquida, mientras que los procesos en fase de vapor típicamente emplean catalizadores para mejorar la velocidad de reacción. En la mayoría de los entornos industriales, se mantiene un exceso de HCl con respecto al metanol en la atmósfera de reacción para impulsar la conversión hacia la producción de monoclorometano.
3.1.1. Proceso de hidrocloración en fase gaseosa
El proceso de hidrocloración en fase gaseosa utiliza un catalizador ácido sólido bajo presión (0,3–0,6 MPa) y temperatura (280–350 °C) controladas. Esta conversión de metanol en monoclorometano se produce a través de un mecanismo de Eley-Rideal, donde el metanol quimisorbido reacciona con HCl en fase gaseosa en la superficie del catalizador.
La alta selectividad (0,2–1% de dimetiléter como subproducto) se atribuye a la abundancia de sitios ácidos que promueven la reacción deseada y suprimen la deshidratación competitiva con dimetiléter.
Los catalizadores comunes incluyen cloruro de zinc, cloruro de cobre y alúmina, a menudo soportados sobre soportes como carbono o sílice. El óxido de aluminio γ es una opción industrial común. Los estudios han investigado la cinética, el envejecimiento y la regeneración de estos catalizadores.
La reacción muestra una dependencia de primer orden del HCl pero una dependencia mínima de la presión del metanol. En particular, la constante de velocidad se correlaciona con el área de la superficie y las temperaturas más altas introducen limitaciones debido a la difusión de los poros.
El catalizador nuevo inicialmente se une al cloro, formando sitios ácidos para la adsorción de metanol. La difusión de los poros restringe la absorción de cloro, lo que provoca la presencia de sitios de óxido e hidrato de óxido.
El envejecimiento del catalizador se debe principalmente a la deposición de carbono debido a reacciones secundarias y al bloqueo de los poros, mientras que la sinterización reduce la superficie activa a altas temperaturas.
Las materias primas de alta pureza, incluido el metanol técnicamente puro y el HCl limpio, son cruciales para minimizar las reacciones secundarias y extender la vida útil del catalizador. Si el HCl proviene de un proceso de cloración adyacente, requiere una purificación rigurosa para eliminar los clorometanos residuales.
Los reactores de fase gaseosos típicos emplean numerosos tubos delgados de níquel llenos de catalizador. La transferencia de calor eficiente es esencial debido a la naturaleza exotérmica de la reacción.
Un diagrama de flujo simplificado (Figura 1) ilustra el proceso:
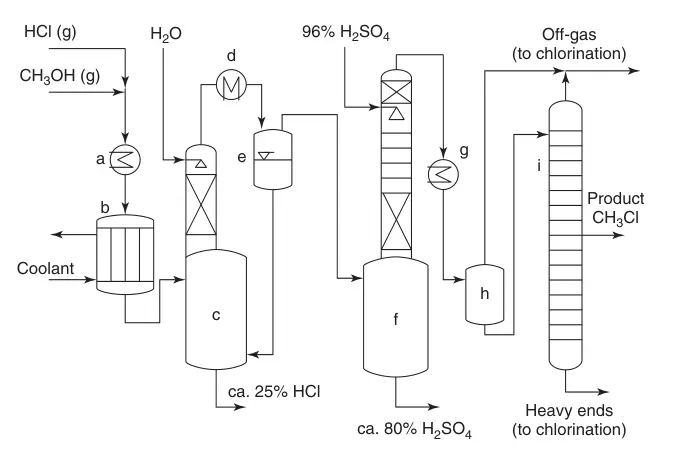
(a) Intercambiadores de calor; b) reactor de tubos múltiples; (c) Enfriamiento de la corriente de producto con agua y absorción del exceso de HCl; (d) Condensación; (e) Sistema de enfriamiento; (f) Eliminación de agua; (g) condensación de CH3Cl; h) tarea intermedia; y (i) Purificación de monoclorometano.
- Mezcla y calentamiento: HCl y metanol se mezclan, se calientan y se alimentan al reactor.
- Conversión y enfriamiento: el lecho del catalizador impulsa la conversión, y el exceso de HCl promueve la formación del producto deseado y suprime el dimetiléter. El gas de reacción se apaga con agua, absorbiendo el exceso de HCl.
- Absorción y enfriamiento de HCl: la corriente del producto pasa a través de un enfriador, condensa agua y absorbe más HCl. El HCl recuperado se recicla, mientras que la mezcla de agua y HCl se purifica posteriormente para recuperar el metanol.
- Eliminación de dimetiléter: la corriente del producto ingresa a una columna de ácido sulfúrico para eliminar el dimetiléter y el agua residual. El ácido gastado se puede utilizar en la producción de fertilizantes o en la descomposición del ácido sulfúrico.
- Condensación y destilación de clorometano: el clorometano seco y crudo se condensa y se purifica aún más a través de una columna de destilación de alta presión. Los gases de cabeza y los residuos de destilación se pueden reciclar.
Este proceso logra un alto rendimiento a base de metanol de aproximadamente el 99 %.
3.1.2. Proceso de hidrocloración en fase líquida
La hidrocloración de metanol a clorometano puede ocurrir en la fase líquida, ya sea catalítica o no catalíticamente. Ambos métodos implican un mecanismo de sustitución nucleófila bimolecular:
- Protonación: El paso inicial implica la protonación del alcohol por HCl, generando un intermedio cargado positivamente. (ROH + HCl → ROH2+ + Cl–)
- Ataque nucleofílico: en el segundo paso, un ion cloruro ataca al alcohol protonado, lo que provoca la escisión del enlace y la formación del producto deseado. (ROH2+ + Cl–) → [𝛿−Cl · · · R · · · 𝛿+OH2] → RCl + H2O
1. Proceso Catalítico
El método catalítico típico emplea un reactor agitado lleno de una solución acuosa de cloruro metálico, a menudo ZnCl2 (70–80 % en peso). y luego se alimentan al reactor metanol y gas HCl o ácido clorhídrico.
2. Proceso no catalítico
El proceso no catalítico, desarrollado por Shin-Estu y Dow, opera a temperaturas y presiones más bajas en comparación con el método catalítico, minimizando así la formación de dimetiléter como subproducto. Si bien existen variantes no catalíticas en fase gaseosa, el proceso en fase líquida domina las aplicaciones industriales.
El proceso no catalítico de Dow utiliza un reactor de lecho en ebullición mantenido bajo presión superatmosférica (7–21 bar) para mantener el medio de reacción líquido a la temperatura deseada (≥ 50 °C, preferiblemente entre 100 y 180 °C). Al reactor se alimentan metanol y al menos un exceso molar del 10% de HCl. Los productos vaporosos luego ingresan a una torre rectificadora, donde:
- Primero, el vapor de agua se une al producto de reflujo, que es rico en HCl, secando eficazmente el producto.
- Luego, el exceso de HCl reacciona con el éter dimetílico generado en el reactor, minimizando este subproducto no deseado.
3.2. Clorometano como subproducto
El clorometano se genera como coproducto en la producción de silicona mediante la hidrocloración con metanol catalizada por cobre de SiCl2(CH3)2. Se recupera del Si(OH)2(CH3)2 y luego se reintroduce en el proceso de formación de silano conocido como síntesis de Müller-Rochow.
4. Usos del clorometano
El clorometano es conocido por su uso como materia prima para una mayor cloración a diclorometano y triclorometano. Sin embargo, su principal uso industrial es la producción de siliconas, incluidos fluidos, elastómeros y resinas.
Estos materiales encuentran un uso generalizado en diversos sectores, desde agentes antiespumantes en procesos industriales hasta productos de consumo como recubrimientos, selladores e incluso cuidado personal.
El clorometano se utiliza en la síntesis de éteres de celulosa. Estos derivados de celulosa modificados, como la metilcelulosa, la hidroxipropilmetilcelulosa (HPMC) y la hidroxietilmetilcelulosa (HEMC), sirven como agentes espesantes, emulsionantes y gelificantes en una multitud de aplicaciones. Desde materiales de construcción y cosméticos hasta alimentos y productos farmacéuticos, mejoran la funcionalidad y estabilidad del producto.
Las propiedades metilantes del monoclorometano lo convierten en un reactivo esencial en la producción de polímeros catiónicos. Estos polímeros se utilizan ampliamente en el tratamiento de agua para diversos fines, incluida la floculación, coagulación y deshidratación de lodos.
También contribuye a la síntesis de compuestos de amonio cuaternario (quats), que se utilizan como suavizantes de telas y arcillas organomodificadas para la extracción de petróleo y gas, en productos fitosanitarios y en polímeros catiónicos utilizados en el tratamiento del agua.
Si bien su uso en refrigeración ha sido cancelado en los países desarrollados debido a preocupaciones de seguridad, el clorometano sigue siendo esencial en procesos industriales específicos. Sirve como disolvente criogénico en la producción de caucho butílico y en entornos de laboratorio.
Es importante señalar que la reintroducción de clorometano en las unidades de refrigeración a base de aluminio plantea un riesgo de seguridad importante. La lenta reacción similar a la de Grignard con el aluminio puede provocar explosiones con consecuencias potencialmente fatales.
De manera similar, el uso de monoclorometano para la producción de aditivos antidetonantes para combustibles como el tetraetilo de plomo y el tetrametilplomo se ha suspendido en gran medida debido a preocupaciones ambientales y de salud.
Sin embargo, el monoclorometano sigue siendo relevante en la producción de compuestos organometálicos como metillitio, cloruro de metilmagnesio, trimetilaluminio y compuestos de metil estaño.
Estos compuestos son intermediarios esenciales en la síntesis química fina y potentes catalizadores en diversas reacciones de polimerización. Además, el trimetilaluminio encuentra aplicación en la deposición química de vapor, lo que permite la creación de películas delgadas de óxido de aluminio dieléctrico y altamente resistente sobre diversos sustratos.
5. Toxicología del clorometano
El clorometano es un gas inodoro, lo que significa que la ruta principal de exposición es la inhalación, lo que plantea preocupaciones de seguridad únicas. Su impacto en el sistema nervioso central (SNC) está bien documentado; tanto estudios en animales como casos de exposición en humanos indican potencial de lesiones e incluso la muerte.
La sobreexposición al clorometano manifiesta síntomas similares a los de la intoxicación por alcohol, que incluyen alteraciones de la marcha, incoherencia, desorientación y cambios de personalidad. Estos efectos pueden ser prolongados en comparación con el alcohol, incluso permanentes en casos graves. Curiosamente, los voluntarios humanos expuestos a 10 ppm durante 2 horas no experimentaron irritación ni efectos en el SNC.
Toxicidad para la reproducción y el desarrollo: la exposición excesiva en ratas macho afecta los testículos, mientras que la toxicidad para el desarrollo y los posibles efectos cardíacos observados en animales se consideran menores. relevante para los humanos debido a los mayores niveles de exposición.
El clorometano muestra propiedades mutagénicas débiles in vitro; sin embargo, la evidencia in vivo de genotoxicidad aparece solo en concentraciones altas, que ya son tóxicas.
Los estudios de carcinogenicidad de dos años en roedores revelaron tumores renales sólo en ratones macho al nivel de exposición más alto (1000 ppm); Es probable que esto esté relacionado con lesiones repetidas de órganos. La Agencia Internacional para la Investigación del Cáncer (IARC) lo clasifica como «no clasificable en cuanto a su carcinogenicidad para los seres humanos (Grupo 3)».
Límites de exposición y seguridad: Los estudios de dosis repetidas en animales sugieren una concentración sin efectos adversos observados (NOAEC) superior a 150 ppm. Los límites de exposición ocupacional (OEL) varían a nivel mundial y generalmente oscilan entre 20 y 100 ppm.
Referencia
- Chloromethanes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_233.pub4
