Le chlorométhane, également connu sous le nom de chlorure de méthyle, est le dérivé chloré le plus simple du méthane de formule chimique CH3Cl. Il s’agit d’un gaz incolore avec une légère odeur sucrée qui se produit naturellement en quantités infimes mais qui est principalement produit industriellement.
Table des matières
1. Propriétés physiques du chlorométhane
Le chlorométhane est un gaz incolore et inflammable, sans odeur. Sa solubilité dans l’eau dépend de la température et forme un azéotrope avec l’eau. Le tableau 1 suivant représente sa solubilité à 0,1 MPa (1 bar) :
| T (°C) | Solubilité (g de CH3Cl/kg de H2O) |
|---|---|
| 15 | 9.0 |
| 30 | 6.52 |
| 45 | 4.36 |
| 60 | 2,64 |
Les propriétés physiques importantes du chlorométhane sont répertoriées dans le tableau 2 suivant :
| Propriété | Valeur |
|---|---|
| Poids moléculaire (MW) | 50,49 g/mol |
| Point d'ébullition à 1 bar | -24,0 °C |
| Point de fusion | -97,7 °C |
| Pression de vapeur à 20°C | 4900 mbar |
| Enthalpie de vaporisation | 21,67 kJ/mol |
| Enthalpie de fusion au point de fusion | 6,4 kJ/mol |
| Densité du liquide (25°C) | 911 kg/m3 |
| Densité de la vapeur au point d'ébullition | 2,558 kg/m3 |
| Coefficient de dilatation cubique du liquide (0–40 °C) | 0,00209 K-1 |
| Enthalpie de formation de vapeur (25°C, 1 bar) | -80,83 kJ/mol |
| Énergie libre de Gibbs de formation de vapeur (25°C, 1 bar) | -57,37 kJ/mol |
| Capacité thermique spécifique de la vapeur (25°C, 1 bar) | 0,807 kJ kg-1 K-1 |
| Température critique (Tc) | 143 °C |
| Pression critique | 65,9 guichets automatiques |
| Volume critique | 0,13645 ml/mol |
| Conductivité thermique de la vapeur | 0,00841 W K-1 m-1 |
| Conductivité thermique du liquide (20°C) | 0,161 W K-1 m-1 |
| Tension superficielle à 20°C | 16,2 mN/m |
| Viscosité du liquide à 20°C | 0,244 cP |
| Moment dipolaire | 1,86 D |
| Indice de réfraction du liquide (25°C) | 1.3712 |
| Constante diélectrique de la vapeur à 20°C | 1.01 |
| Constante diélectrique du liquide à 20°C | 12.9 |
| Température d'inflammation | 618 °C |
| Limite inférieure d'inflammabilité dans l'air | 7,1 % en volume |
| Limite supérieure d'inflammabilité dans l'air | 18,5 % en volume |
| Coefficient de partage air/eau (20°C) | 0,3 |
| Coefficient de partage n-octanol/eau (20°C) (log Pow) | 0,91 |
2. Propriétés chimiques du chlorométhane
Le chlorométhane est un composé de chlore aliphatique unique qui est thermiquement stable. Contrairement à de nombreux composés apparentés, il résiste à la décomposition jusqu’à dépasser 400 °C, même en présence de la plupart des métaux.
Sa température d’auto-inflammation dans l’air atteint 632 °C, mesurée dans un appareil en acier. Alors que la combustion génère principalement du CO2 et du HCl, des traces de COCl2 et CO peuvent également se former. La photooxydation produit principalement du dioxyde de carbone et du phosgène.
L’hydrolyse du chlorométhane produit du méthanol et du chlorure d’hydrogène ; cependant, dans des conditions neutres ou acides à température ambiante, cela est négligeable. Une forte présence d’alcali accélère le processus, réduisant la demi-vie du chlorométhane de plusieurs décennies à quelques mois seulement.
Le chlorométhane participe facilement aux réactions organométalliques avec des éléments comme le lithium, le magnésium, le zinc et l’aluminium, formant des composés comme CH3MgCl et Al( CH3)3⋅AlCl3. Ces composés ont des applications précieuses en chimie organique préparative et en catalyse de production de polymères.
Il a la capacité d’agir comme agent de méthylation dans de nombreuses réactions chimiques. Il sert de réactif dans la réaction de Friedel-Crafts avec benzène pour la synthèse du toluène et méthyle facilement les groupes hydroxyle pour former des éthers, y compris la méthylcellulose à partir de la cellulose et divers éthers méthyliques de phénol.
Le monochlorométhane trouve également une utilisation industrielle dans la production de composés de méthylammonium quaternaire par réaction avec des amines tertiaires et diverses méthylamines avec de l’ammoniac.
Le réactif de Grignard, chlorure de méthylmagnésium, est directement synthétisé à partir du chlorométhane et du magnésium, tandis que la réaction de Wurtz avec le sodium donne de l’éthane.
Une réaction particulièrement importante implique le chlorométhane et le silicium, produisant des méthylchlorosilanes (SiCl2(CH3)2) grâce à la synthèse de Müller-Rochow. Ces silanes, à leur tour, sont des matières premières importantes pour la production de silicone par conversion en siloxanes intermédiaires.
Enfin, le chlorométhane peut être converti en méthylmercaptan sous pression et à température élevée à l’aide d’hydrogène sulfuré de sodium ou transformé en tétraméthylplomb par réaction avec un alliage de plomb monosodique.
3. Production de chlorométhane
Le chlorométhane est produit par deux méthodes principales : l’hydrochloration du méthanol et la chloration de substitution du méthane.
Dans le processus d’hydrochloration du méthanol, le méthanol (CH3OH) réagit avec le chlorure d’hydrogène (HCl) pour produire du monochlorométhane (CH3Cl) et de l’eau (H2O).
CH3OH + HCl → CH3Cl + H2O
Dans la chloration de substitution, le méthane (CH4) réagit avec le chlore (Cl2) pour produire un mélange de chlorométhanes et chlorure d’hydrogène.
CH4 + Cl2 → CH3Cl + CH2Cl2 + CHCl3 + CCl4 + HCl
De nombreuses installations industrielles combinent les deux méthodes pour une production optimisée. La chloration par substitution génère le mélange de chlorométhane et de HCl. L’hydrochloration du méthanol consomme une partie du HCl généré pour produire plus de chlorométhane et réduire la consommation globale de HCl.
3.1. Production de chlorométhane par hydrochloration du méthanol
Dans le processus d’hydrochloration du méthanol, le groupe hydroxyle (–OH) du méthanol est remplacé par un atome de chlore provenant du chlorure d’hydrogène (HCl). Cette réaction exothermique génère du monochlorométhane (CH3Cl) et de l’eau (H2O) avec un dégagement de chaleur de 33 kJ/mol :
CH3OH + HCl → CH3Cl + H2O ⇔ ΔH = -33 kJ/mol
Cette réaction peut être réalisée en phase vapeur ou liquide. Des méthodes catalytiques et non catalytiques existent en phase liquide, tandis que les procédés en phase vapeur utilisent généralement des catalyseurs pour augmenter la vitesse de réaction.
Dans la plupart des operations industriels, un excès de HCl par rapport au méthanol est maintenu dans l’atmosphère de réaction pour favoriser la conversion vers la production de monochlorométhane.
3.1.1. Processus d’hydrochloration en phase gazeuse
Le processus d’hydrochloration en phase gazeuse utilise un catalyseur acide solide sous pression (0,3 à 0,6 MPa) et température (280 à 350°C) contrôlées. Cette conversion du méthanol en monochlorométhane se produit via un mécanisme d’Eley-Rideal, dans lequel le méthanol chimisorbé réagit avec le HCl en phase gazeuse à la surface du catalyseur.
La sélectivité élevée (0,2 à 1 % d’éther diméthylique comme sous-produit) est attribuée à l’abondance de sites acides favorisant la réaction souhaitée et supprimant la déshydratation concurrente en éther diméthylique.
Les catalyseurs courants incluent le chlorure de zinc, le chlorure de cuivre et l’alumine, souvent supportés par des supports comme le carbone ou la silice. L’oxyde d’aluminium γ est un choix industriel courant. Des études ont étudié la cinétique, le vieillissement et la régénération de ces catalyseurs.
La réaction présente une dépendance de premier ordre à l’égard du HCl mais une dépendance minimale à la pression du méthanol. Notamment, la constante de vitesse est en corrélation avec la surface, et des températures plus élevées introduisent des limitations dues à la diffusion des pores.
Le catalyseur frais lie initialement le chlore, formant des sites acides pour l’adsorption du méthanol. La diffusion interstitielle restreint l’absorption du chlore, conduisant à la présence de sites d’oxyde et d’hydrate d’oxyde.
Le vieillissement du catalyseur est principalement causé par le dépôt de carbone dû à des réactions secondaires et au blocage des pores, tandis que le frittage réduit la surface active à haute température.
Les matières premières de haute pureté, notamment le méthanol techniquement pur et le HCl propre, sont essentielles pour minimiser les réactions secondaires et prolonger la durée de vie du catalyseur. Si le HCl provient d’un processus de chloration adjacent, il nécessite une purification rigoureuse pour éliminer les chlorométhanes résiduels.
Les réacteurs en phase gazeuse typiques utilisent de nombreux tubes minces en nickel remplis de catalyseur. Un transfert de chaleur efficace est essentiel en raison de la nature exothermique de la réaction.
Un organigramme simplifié (Figure 1) illustre le processus :
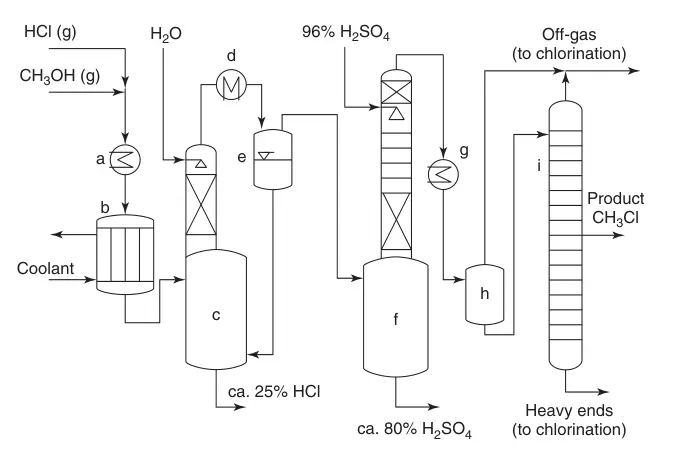
(a) Échangeurs de chaleur ; (b) Réacteur multitubes ; (c) Refroidissement du flux de produit avec de l'eau et absorption de l'excès de HCl ; (d) Condensation ; (e) Système de trempe ; f) Élimination de l'eau ; (g) condensation de CH3Cl ; (h) Tâche intermédiaire ; et (i) Purification du monochlorométhane
- Mélange et chauffage : le HCl et le méthanol sont mélangés, chauffés et introduits dans le réacteur.
- Conversion et trempe : le lit catalytique entraîne la conversion, l’excès de HCl favorisant la formation du produit souhaité et supprimant l’éther diméthylique. Le gaz de réaction est trempé avec de l’eau, absorbant l’excès de HCl.
- Absorption et refroidissement du HCl : le flux de produit passe à travers un refroidisseur, condensant l’eau et absorbant davantage le HCl. Le HCl récupéré est recyclé, tandis que le mélange eau-HCl subit une purification en aval pour la récupération du méthanol.
- Élimination de l’éther diméthylique : le flux de produit entre dans une colonne d’acide sulfurique pour éliminer l’éther diméthylique et l’eau résiduelle. L’acide usé peut être utilisé dans la production d’engrais ou dans le clivage de l’acide sulfurique.
- Condensation et distillation du chlorométhane : le chlorométhane brut et sec est condensé et purifié davantage dans une colonne de distillation à haute pression. Les gaz de tête et les résidus de distillation peuvent être recyclés.
Ce procédé permet d’obtenir un rendement élevé en méthanol d’environ 99 %.
3.1.2. Processus d’hydrochloration en phase liquide
L’hydrochloration du méthanol en chlorométhane peut se produire en phase liquide, de manière catalytique ou non catalytique. Les deux méthodes impliquent un mécanisme de substitution nucléophile bimoléculaire :
- Protonation : L’étape initiale implique la protonation de l’alcool par HCl, générant un intermédiaire chargé positivement. (ROH + HCl → ROH2+ + Cl–)
- Attaque nucléophile : Dans la deuxième étape, un ion chlorure attaque l’alcool protoné, conduisant au clivage de la liaison et à la formation du produit souhaité. (ROH2+ + Cl–) → [𝛿−Cl · · · R · · · 𝛿+OH2] → RCl + H2O
1. Processus catalytique
La méthode catalytique typique utilise un réacteur agité rempli d’une solution aqueuse de chlorure métallique, souvent du ZnCl2 (70 à 80 % en poids). puis du méthanol et du gaz HCl ou de l’acide chlorhydrique sont introduits dans le réacteur.
2. Processus non catalytique
Le procédé non catalytique, développé par Shin-Estu et Dow, fonctionne à des températures et des pressions plus basses que la méthode catalytique, minimisant ainsi la formation d’éther diméthylique comme sous-produit. . Bien qu’il existe des variantes non catalytiques en phase gazeuse, le procédé en phase liquide domine les applications industrielles.
Le procédé non catalytique de Dow utilise un réacteur à lit bouillant maintenu sous une pression superatmosphérique (7 à 21 bars) pour maintenir le milieu réactionnel liquide à la température souhaitée (≥ 50 °C, de préférence 100-180 °C). Du méthanol et un excès molaire d’au moins 10 % de HCl sont introduits dans le réacteur. Les produits vaporeux entrent ensuite dans une tour de rectification, où :
- Tout d’abord, la vapeur d’eau est liée au produit de reflux, qui est riche en HCl, séchant efficacement le produit.
- Ensuite, l’excès de HCl réagit avec tout éther diméthylique généré dans le réacteur, minimisant ainsi ce sous-produit indésirable.
3.2. Le chlorométhane comme sous-produit
Le chlorométhane est généré comme coproduit dans la production de silicone par hydrochloration au méthanol catalysée par le cuivre de SiCl2(CH3)2. Il est récupéré à partir de Si(OH)2(CH3)2 puis réintroduit dans le processus de formation de silane connu sous le nom de synthèse de Müller-Rochow. .
4. Utilisations du chlorométhane
Le chlorométhane est connu pour son utilisation comme matière première pour une chloration ultérieure en dichlorométhane et trichlorométhane. Cependant, sa principale utilisation industrielle concerne la production de silicones, notamment de fluides, d’élastomères et de résines.
Ces matériaux sont largement utilisés dans divers secteurs, depuis les agents antimousses dans les processus industriels jusqu’aux produits de consommation tels que les revêtements, les mastics et même les soins personnels.
Le chlorométhane est utilisé dans la synthèse des éthers de cellulose. Ces dérivés de cellulose modifiés, tels que la méthylcellulose, l’hydroxypropylméthylcellulose (HPMC) et l’hydroxyéthylméthylcellulose (HEMC), servent d’agents épaississants, émulsifiants et gélifiants dans une multitude d’applications. Des matériaux de construction aux cosmétiques en passant par les produits alimentaires et pharmaceutiques, ils améliorent la fonctionnalité et la stabilité des produits.
Les propriétés méthylantes du monochlorométhane en font un réactif essentiel dans la production de polymères cationiques. Ces polymères sont largement utilisés dans le traitement de l’eau à diverses fins, notamment la floculation, la coagulation et la déshydratation des boues.
Il contribue également à la synthèse de composés d’ammonium quaternaire (quats), utilisés comme assouplissants textiles et argiles organo-modifiées pour les forages pétroliers et gaziers, dans les produits phytopharmaceutiques et dans les polymères cationiques utilisés dans le traitement des eaux.
Bien que son utilisation en réfrigération ait été interdite dans les pays développés pour des raisons de sécurité, le chlorométhane reste essentiel dans certains processus industriels. Il sert de solvant cryogénique dans la production de caoutchouc butyle et en laboratoire.
Il est important de noter que la réintroduction du chlorométhane dans les unités de refroidissement à base d’aluminium présente un risque important pour la sécurité. La lente réaction de type Grignard avec l’aluminium peut conduire à des explosions aux conséquences potentiellement mortelles.
De même, l’utilisation du monochlorométhane pour la production d’additifs antidétonants pour carburants comme le plomb tétraéthyle et le plomb tétraméthyle a été largement abandonnée en raison de problèmes environnementaux et sanitaires.
Cependant, le monochlorométhane reste pertinent dans la production de composés organométalliques tels que les composés de méthyllithium, de chlorure de méthylmagnésium, de triméthylaluminium et de méthylétain.
Ces composés sont des intermédiaires essentiels dans la synthèse chimique fine et de puissants catalyseurs dans diverses réactions de polymérisation. De plus, le triméthylaluminium trouve une application dans le dépôt chimique en phase vapeur, permettant la création de films minces d’oxyde d’aluminium hautement résistant et diélectrique sur divers substrats.
5. Toxicologie du chlorométhane
Le chlorométhane est un gaz inodore, ce qui signifie que la principale voie d’exposition est l’inhalation, ce qui pose des problèmes de sécurité uniques. Son impact sur le système nerveux central (SNC) est bien documenté, avec des études animales et des cas d’exposition humaine indiquant un risque de blessure, voire de mort.
La surexposition au chlorométhane manifeste des symptômes similaires à ceux de l’intoxication alcoolique, notamment des troubles de la démarche, une incohérence, une désorientation et des changements de personnalité.
Ces effets peuvent être prolongés par rapport à l’alcool, voire permanents dans les cas graves. Il est intéressant de noter que les volontaires humains exposés à 10 ppm pendant 2 heures n’ont ressenti aucune irritation ni effet sur le SNC.
Toxicité pour la reproduction et le développement : Une exposition excessive chez les rats mâles affecte les testicules, tandis que la toxicité pour le développement et les effets cardiaques potentiels observés chez les animaux sont considérés comme moindres. pertinent pour les humains en raison de niveaux d’exposition plus élevés.
Le chlorométhane présente de faibles propriétés mutagènes in vitro ; cependant, les preuves in vivo de génotoxicité n’apparaissent qu’à des concentrations élevées, déjà toxiques.
Des études de cancérogénicité de deux ans chez les rongeurs ont révélé des tumeurs rénales uniquement chez les souris mâles au niveau d’exposition le plus élevé (1 000 ppm) ; ceci est probablement lié à des lésions répétées d’un organe. Le Centre international de recherche sur le cancer (CIRC) le classe comme « inclassable quant à sa cancérogénicité pour l’homme (Groupe 3) ».
Limites d’exposition et sécurité : Des études à doses répétées chez les animaux suggèrent une concentration sans effet nocif observé (CSENO) dépassant 150 ppm. Les limites d’exposition professionnelle (VLEP) varient à l’échelle mondiale, généralement comprises entre 20 et 100 ppm.
Référence
- Chloromethanes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_233.pub4




