Anhídrido maleico: propiedades, reacciones, producción y usos
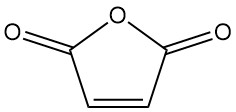
¿Qué es el anhídrido maleico?
El anhídrido maleico, también conocido como 2,5-furandiona, es un compuesto orgánico con la fórmula C4H2O3. Es un sólido incoloro o blanco con un olor fuerte e irritante que es industrialmente más importante en comparación con el ácido maleico.
Tabla de contenido
1. Propiedades físicas del anhídrido maleico
El anhídrido maleico forma cristales en forma de agujas ortorrómbicas. Es soluble en agua, acetona, etanol, xileno, acetato de etilo, cloroformo, benceno, tolueno, tetraclorometano y muchos otros disolventes orgánicos.
El anhídrido maleico es higroscópico e inflamable y puede formar mezclas explosivas con el aire. Puede sublimar. El pH de las soluciones acuosas de anhídrido maleico es 2,42 a 1×10-2 M, 2,62 a 5×10-3 M y 3,10 a 1×10-4 M.
Las propiedades físicas más importantes del anhídrido maleico se resumen en la siguiente tabla.
| Propiedad | Valor |
|---|---|
| Número CAS | 108-31-6 |
| Fórmula química | C4H2O3 |
| Masa molecular | 98,06 g/mol |
| Punto de fusión | 52,85 °C |
| Punto de ebullición (101,3 kPa) | 202,0 °C |
| Densidad | 1,48 g/cm3 |
| Densidad de vapor | 3,40 |
| Calor de combustión | -1391,2 kJ/mol |
| Calor específico (líquido) | -1,67 kJ mol-1 K-1 |
| Calor de evaporación | 54,8 kJ/mol |
| Calor de fusión | 13,66 kJ/mol |
| Punto de inflamación | 102 °C (vaso cerrado) 110 °C (vaso abierto) |
| Temperatura de autoignición | 477 °C |
2. Reacciones del anhídrido maleico
El anhídrido maleico presenta una alta reactividad debido a la presencia de un doble enlace y su grupo anhídrido.
El anhídrido maleico se hidroliza fácilmente con agua para formar ácido maleico. Esta reacción es exotérmica.
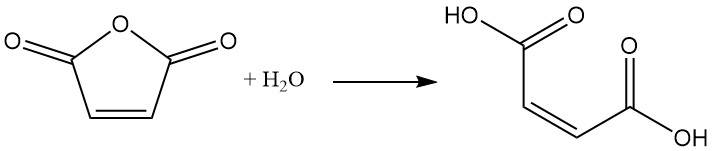
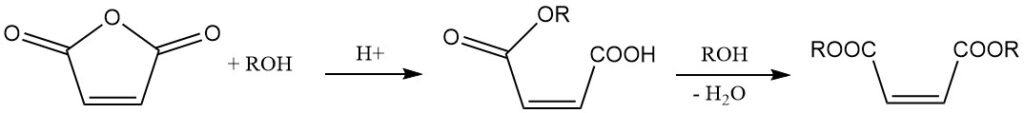
La reacción con alcoholes en presencia de un catalizador conduce a la formación de ésteres de ácido maleico. La elección del catalizador y la temperatura de reacción determinan el producto. A temperaturas más bajas, se forman semiésteres, mientras que a temperaturas más altas se favorece la formación de diésteres con eliminación de agua.
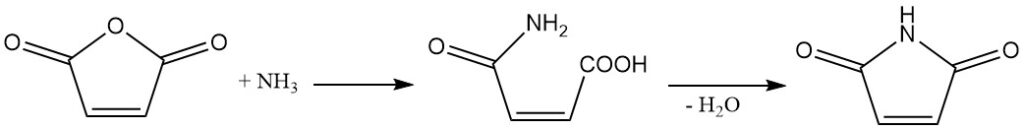
El anhídrido maleico reacciona con amoníaco o aminas para producir las semiamidas correspondientes. Una deshidratación posterior conduce a la formación de imidas cíclicas.
El doble enlace del anhídrido maleico sufre reacciones de adición con halógenos. Según las condiciones de reacción, se pueden formar anhídridos maleicos monohalogenados o dihalogenados o anhídridos succínicos dihalogenados.
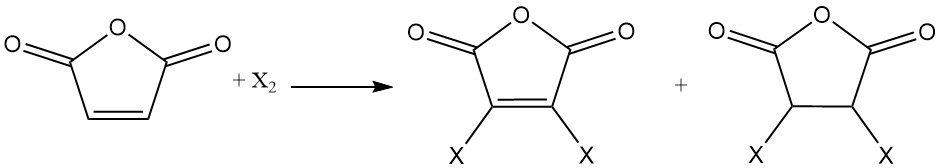
La hidrogenación del anhídrido maleico produce diversos productos, según las condiciones de reacción. Entre estos productos se encuentran el anhídrido succínico, el 1,4-butanodiol, el tetrahidrofurano o la butirolactona.

La adición de olefinas conduce a la formación de anhídridos alquenilsuccínicos.
El anhídrido maleico participa en reacciones de Diels-Alder con dienos conjugados.
El anhídrido maleico puede sufrir reacciones de homopolimerización y copolimerización.
En condiciones específicas, el anhídrido maleico puede dimerizarse para formar dianhídrido tetracarboxílico de ciclobutano (CBTA), que se utiliza en la producción de poliimidas.
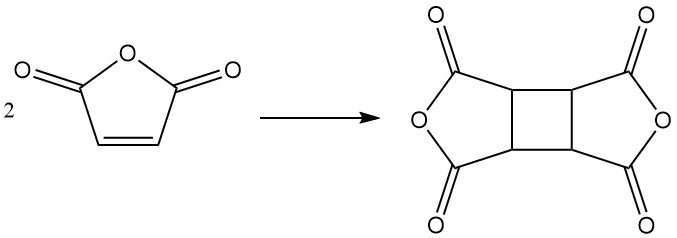
3. Producción de anhídrido maleico
El anhídrido maleico se produce por oxidación catalítica de hidrocarburos adecuados en fase gaseosa. Tradicionalmente, el benceno era la materia prima principal. Sin embargo, los hidrocarburos C4 (como el butano) han adquirido cada vez mayor importancia en los últimos años.
3.1. Producción de anhídrido maleico por oxidación de benceno
Para producir anhídrido maleico (Figura 1), el benzoeno se precalienta y se mezcla con una corriente de aire para formar una mezcla homogénea. Se utilizan reactores tubulares con tubos verticales llenos de un catalizador como óxidos de vanadio y molibdeno sobre un soporte inerte.
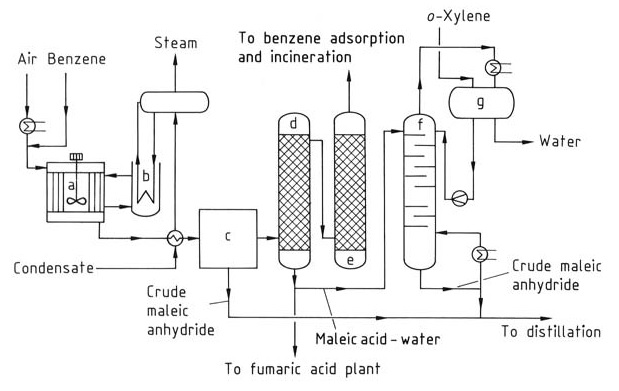
a) Reactor; b) Enfriador de baño de sal; c) Condensador parcial; d) Depurador de ácidos; e) Depurador de álcalis; f) Columna de deshidratación; g) Separador de fases
La reacción es exotérmica, y requiere un control de la temperatura de operación y una presión entre 0,15 y 0,25 MPa para optimizar el rendimiento de anhídrido maleico y minimizar la combustión de CO2 y CO. El calor generado durante la reacción (alrededor de 27 MJ por tonelada de benceno) se elimina utilizando sales fundidas circulantes, que posteriormente se enfrían con agua.
La siguiente reacción representa la producción de anhídrido maleico:
C6H6 + 4,5 O2 → C4H2O3 + 2 CO2 + 2 H2O (ΔH = -1875 kJ/mol)
Sin embargo, también se produce cierta combustión indeseable. El benceno que no reacciona se puede recuperar utilizando técnicas como la adsorción y reutilizar en el proceso. Aunque existen patentes para procesos que reciclan una porción mayor del gas de reacción después de la separación del anhídrido maleico, aún no se han adoptado ampliamente a nivel comercial.
Separación del anhídrido maleico crudo
El efluente del reactor se enfría inicialmente para evitar la condensación del anhídrido maleico y el agua. Luego se pueden utilizar dos métodos para el procesamiento posterior:
- Condensación parcial: la mezcla de gases se enfría a alrededor de 55 °C, lo que permite que el anhídrido maleico se condense y se separe como líquido. Sin embargo, el contacto prolongado con el gas que contiene agua puede provocar la formación de ácido maleico. Este enfoque generalmente recupera entre el 40 y el 60 % del anhídrido maleico.
- Lavado con agua: este método captura todo el anhídrido maleico en el gas de reacción como una solución de ácido maleico. Sin embargo, el paso de deshidratación posterior para recuperar el anhídrido maleico consume mucha energía y solo se prefiere para gases de reacción con alto contenido de agua (como los de la oxidación de C4).
3.2. Producción de anhídrido maleico mediante deshidratación de soluciones acuosas de ácido maleico
El anhídrido maleico se puede derivar de las soluciones de ácido maleico obtenidas al depurar el gas de reacción con agua.
A temperaturas superiores a 150 °C, incluso trazas de álcali en la solución de lavado pueden provocar la descarboxilación del anhídrido maleico. Por lo tanto, es necesaria agua de lavado libre de álcali.
La deshidratación del ácido maleico requiere temperaturas superiores a 100 °C (ΔH = +34,88 kJ/mol). Sin embargo, lograr una velocidad de reacción relevante a nivel industrial requiere temperaturas superiores a 130 °C. Este sistema de temperatura más alta también promueve la isomerización no deseada del ácido maleico a ácido fumárico.
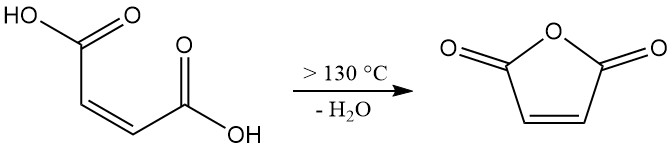
Si bien el ácido fumárico en sí no se descompone significativamente para formar anhídrido maleico por debajo de los 230 °C, su presencia reduce el rendimiento general del producto deseado. Para minimizar la isomerización, es fundamental un corto tiempo de residencia a temperaturas elevadas durante el proceso de deshidratación.
Se utilizan dos procesos principales para deshidratar soluciones acuosas de ácido maleico: el método del agente de arrastre y el proceso térmico sin un agente de arrastre.
3.2.1. Método del agente de arrastre
En este proceso, la solución acuosa de ácido maleico se introduce en la sección superior de una columna de destilación, donde se mezcla con una mezcla hirviendo de anhídrido maleico y un agente de arrastre como el xileno.
El agente de arrastre (xileno) forma una mezcla azeotrópica con agua, lo que permite que ambos se eliminen de la parte superior de la columna como una corriente de vapor. Esta corriente de vapor luego se separa en un decantador en fases orgánica y acuosa.
La fase orgánica que contiene el xileno se recicla de nuevo a la sección superior de la columna de destilación, mientras que la fase acuosa se devuelve al depurador de gases de reacción de la planta de oxidación.
La corriente de producto de fondo de la columna de destilación, que contiene anhídrido maleico (10-40%), xileno (1-5%), ácido maleico (1-3%) y ácido fumárico (1-3%), se somete a una destilación adicional para aislar el anhídrido maleico puro. Este proceso puede realizarse de forma continua o por lotes.
3.2.2. Proceso térmico sin agente de arrastre
Este método utiliza tecnología de evaporación de capa fina para lograr la deshidratación térmica de la solución acuosa de ácido maleico. La técnica permite una eliminación eficiente del agua en forma de vapor al tiempo que minimiza el tiempo de residencia del ácido maleico a altas temperaturas (150-200 °C). Este corto tiempo de exposición ayuda a suprimir la isomerización a ácido fumárico (solo 1-3%).
Las unidades de evaporadores de capa fina múltiples suelen estar dispuestas en serie. El anhídrido maleico líquido obtenido del condensador parcial también se puede introducir en la segunda etapa de este sistema para deshidratar cualquier resto de ácido maleico (1-5%).
Este proceso continuo produce anhídrido maleico de alta pureza (99%) después de un paso final de destilación. El producto de fondo del último evaporador contiene ácido fumárico y residuos de alto punto de ebullición, que se descartan.
Estas plantas de funcionamiento continuo requieren paradas periódicas para su limpieza.
3.3. Producción de anhídrido maleico mediante oxidación de hidrocarburos C4
En los últimos años, la oxidación de hidrocarburos C4, principalmente utilizando n-butano o mezclas de n-butano-n-buteno ricas en parafinas, ha surgido como una alternativa significativa a la oxidación tradicional del benceno para la producción de anhídrido maleico.
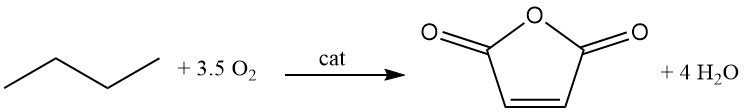
Se han desarrollado diferentes tipos de procesos, como los de lecho fijo, lecho fluidizado y lecho de transporte.
3.3.1. Proceso de lecho fijo
El proceso de lecho fijo es un método comercialmente establecido que utiliza catalizadores de óxido de vanadio-fósforo (V-P-O) empaquetados en reactores tubulares, de manera similar a la oxidación del benceno. La reacción es altamente exotérmica.
C4H10 + 3,5 O2 → C4H2O3 + 4 H2O (ΔH = -1260 kJ/mol)
Sin embargo, en comparación con la oxidación del benceno, se observan tasas de conversión más bajas del 80% y selectividades (70%). La recuperación de hidrocarburos C4 sin reaccionar es más desafiante que con el benceno.
3.3.2. Proceso de lecho fluidizado
El proceso de lecho fluidizado ofrece un control de temperatura más uniforme dentro del reactor, lo que minimiza los «puntos calientes» y mejora potencialmente la selectividad de la reacción. Sin embargo, el proceso de fluidización también implica una remezcla intensiva del producto, lo que puede contrarrestar el beneficio.
Otro desafío es la tensión mecánica en el catalizador V-P-O debido a la abrasión y la erosión. A pesar de estos inconvenientes, los lechos fluidizados pueden operar a concentraciones más altas de C4 (dentro del rango de explosión) debido a su eficacia como barreras de llama.
El proceso ALMA (Alusuisse, Lummus) es un ejemplo de un reactor de lecho fluidizado acoplado a una unidad de procesamiento no acuosa.
3.3.3. Proceso de lecho de transporte
Este proceso fue desarrollado por Monsanto y DuPont y utiliza dos reactores. El catalizador V-P-O consumido en la oxidación de C4 se regenera con oxígeno en el primer reactor. El catalizador regenerado reacciona luego con n-butano en el segundo reactor en condiciones casi estequiométricas con un mínimo de oxígeno atmosférico.
Este proceso logra una alta selectividad de formación de anhídrido maleico (75 mol %) mientras minimiza la remezcla de gases del producto, sin embargo, todavía está en desarrollo.
Debido a la mayor formación de agua en comparación con la oxidación del benceno, la licuefacción directa del anhídrido maleico del gas de reacción C4 a través de condensación parcial es limitada. Una porción más grande (65-70 %) debe recuperarse como ácido maleico mediante lavado con agua, seguido de deshidratación.
Un método de purificación alternativo utiliza la absorción de anhídrido maleico del gas de reacción con disolvente orgánico, lo que permite la separación sin una formación significativa de ácido maleico. La mezcla de disolvente y anhídrido maleico luego se somete a una destilación fraccionada para aislar el anhídrido maleico puro.
3.4. Purificación del anhídrido maleico crudo
Existen dos métodos principales para purificar el anhídrido maleico crudo: la destilación discontinua y la destilación continua.
3.4.1. Destilación discontinua
La destilación discontinua se utiliza para procesar anhídrido maleico separado directamente o mezclas obtenidas a partir de la deshidratación del agente de arrastre. El anhídrido maleico crudo se carga en una columna de destilación discontinua y se calienta inicialmente en condiciones de reflujo total. Esto logra una deshidratación completa de cualquier ácido maleico restante.
La pequeña cantidad de agua eliminada durante la deshidratación se condensa y se separa del agente de arrastre recirculante (generalmente xileno). Luego, el xileno se elimina por destilación. Finalmente, el anhídrido maleico purificado se recupera por destilación al vacío.
Para este proceso se utilizan comúnmente alambiques discontinuos con capacidades que van desde 50 a 150 metros cúbicos y columnas de destilación con 10 a 20 platos.
3.4.2. Destilación continua
La destilación continua es más económica para las instalaciones de producción de anhídrido maleico a gran escala.
En este proceso (Figura 2), se alimenta un flujo continuo de la mezcla de anhídrido maleico crudo al sistema de destilación. El xileno residual se elimina primero en una columna dedicada (f). Finalmente, el anhídrido maleico puro se aísla de la parte superior de una segunda columna (g) mediante destilación.
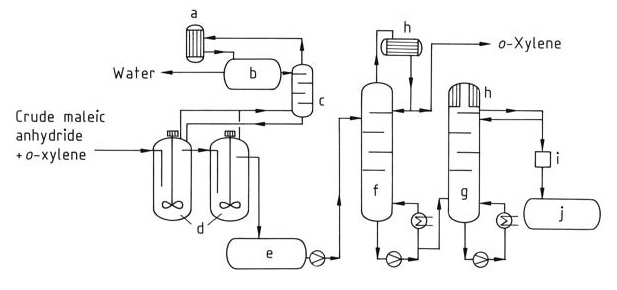
a) Condensador; b) Recipiente separador; c) Columna; d) Post deshidratación; e) Tanque intermedio; f) Columna de o-xileno; g) Columna de anhídrido maleico puro; h) Enfriador; i) Colorímetro; j) Recipiente de anhídrido maleico puro
4. Usos del anhídrido maleico
Las propiedades únicas del anhídrido maleico como anhídrido dicarboxílico con un doble enlace lo convierten en un componente básico versátil para diversas aplicaciones industriales.
El anhídrido maleico se utiliza principalmente para la producción de poliésteres y resinas alquídicas, que se utilizan en la producción de plásticos reforzados con fibra de vidrio para la construcción, aplicaciones eléctricas, tuberías y construcción marina. También se utiliza en la formulación de lubricantes y plastificantes.
El anhídrido maleico participa fácilmente en reacciones de copolimerización. Algunos ejemplos industrialmente importantes incluyen copolímeros de anhídrido maleico-estireno utilizados para plásticos de ingeniería y copolímeros de anhídrido maleico-ácido acrílico utilizados en la industria de los detergentes.
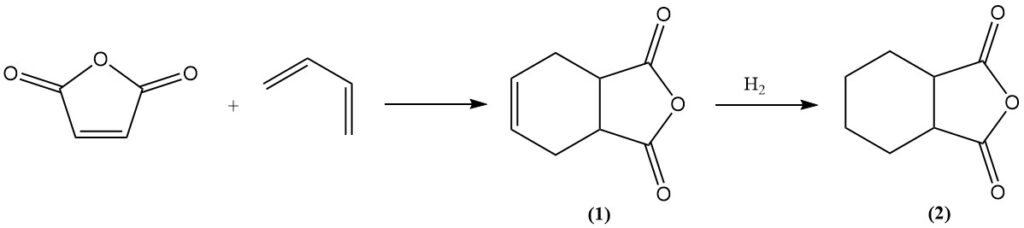
El anhídrido maleico sufre reacciones de Diels-Alder con dienos como el butadieno para formar anhídrido tetrahidroftálico (1). Una hidrogenación posterior produce anhídrido hexahidroftálico (2), que es un valioso agente de curado para resinas epoxi. Un proceso similar que utiliza isopreno produce anhídrido metilhexahidroftálico para la misma aplicación.
Se utilizan cantidades más pequeñas de anhídrido maleico en la producción de pesticidas como el captan y el malatión, así como de inhibidores del crecimiento como la hidrazida del ácido maleico.
Los ésteres de ácido maleico se pueden transformar en surfactantes mediante reacciones con sulfito de hidrógeno de sodio.
El anhídrido maleico se puede utilizar como acelerador del secado cuando se añade a los aceites secantes, mejorando la calidad de las lacas.
5. Toxicología del anhídrido maleico
El anhídrido maleico puede hidrolizarse en ácido maleico en agua, por lo que sus propiedades toxicológicas se ven influenciadas por la presencia de ácido maleico.
El anhídrido maleico muestra una toxicidad aguda moderada según los valores de LD50 (481 mg (rata, oral), 465 mg (ratón, oral), 2620 mg (conejo, percutáneo) y 390 mg (conejillo de indias, oral) por kilogramo de peso corporal).
El principal efecto tóxico agudo es su efecto irritante y corrosivo local sobre la piel, las mucosas y los ojos. La exposición puede causar irritación en concentraciones tan bajas como 1,5–2 ppm, y puede producirse una irritación grave por encima de 2,5 ppm.
La inhalación de anhídrido maleico en concentraciones superiores a 1,2 ppm durante períodos prolongados puede desencadenar síntomas asmáticos.
El anhídrido maleico es un sensibilizante potente, lo que significa que la exposición repetida puede provocar reacciones alérgicas tanto en humanos como en animales.
Los estudios realizados en animales no han demostrado evidencia de toxicidad cancerígena, teratogénica (defectos congénitos) o reproductiva por la exposición al anhídrido maleico. Sin embargo, no se observaron efectos sistémicos solo hasta un nivel de exposición de 2,4 ppm, por lo que no se descartan por completo los efectos a concentraciones más altas.
Se han establecido límites de exposición ocupacional en función de las propiedades irritantes y sensibilizantes:
- MAK (Comisión alemana para la investigación de riesgos para la salud de los materiales de trabajo): 0,2 ppm
- TLV-TWA (Valor límite umbral de la Conferencia estadounidense de higienistas industriales gubernamentales, promedio ponderado en el tiempo): 0,25 ppm
Referencias
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Anhydride
- Method for producing cyclobutane tetracarboxylic acid derivative. – https://patents.google.com/patent/WO2015108168A1/en
