Alcohol alílico: producción, reacción y usos
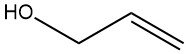
El alcohol alílico es un compuesto orgánico con la fórmula química C3H6O. Es un líquido transparente e incoloro con un olor acre parecido al del ajo y está clasificado como alcohol primario y alcohol insaturado debido a la presencia de un doble enlace en su estructura molecular.
El doble enlace se encuentra entre el segundo y tercer átomo de carbono de la molécula, y el grupo hidroxilo (-OH) está unido al primer átomo de carbono.
Tabla de contenido
1. Propiedades físicas del alcohol alílico
El alcohol alílico (nombre IUPAC: prop-2-en-1-ol) es un líquido móvil incoloro con un olor irritante. Tiene una fórmula molecular de C₃H₆O y una masa molar de 58,08 g/mol. El punto de fusión es -129 °C y el punto de ebullición es 96,9 °C (101,3 kPa). El alcohol alílico es miscible con agua y disolventes orgánicos.
| Propiedad | Valor |
|---|---|
| Densidad relativa |
|
| Índice de refracción |
|
| Temperatura crítica | Tcrít = 271,9 °C |
| Calor de vaporización a 101,3 kPa | 39,98 kJ/mol |
| Capacidad calorífica específica del vapor | Cp (g), (20 °C y 101,3 kPa) = 2,428 kJ/kg.K |
| Capacidad calorífica específica del líquido | Cp (l), (20,5 – 95,5 °C) = 2,784 kJ/kg.K |
| Calor de combustión a p constante | 1853,8 kJ/mol |
| Viscosidad |
|
| Tensión superficial |
|
| Momento dipolar | 1,63D |
| Constante dieléctrica | a 16,2 °C, λ = 60 cm : 20,3 |
| Límites de ignición en el aire | a 100 °C, 101,3 kPa = 2,5 – 18,0 % en volumen |
| Punto de inflamación (copa cerrada) | 22,2 °C |
El alcohol alílico es miscible con agua y disolventes orgánicos en todas las proporciones a 20 °C. Forma azeótropos binarios con agua, benceno, éter dialílico, cloruro de alilo, tricloroetileno y azeótropos ternarios con (agua, benceno) y (agua, éter dialílico).
2. Reacciones químicas del alcohol alílico
El alcohol alílico es un compuesto versátil que puede sufrir una variedad de reacciones, incluidas reacciones de oxidación, reducción, hidrogenación, condensación y adición.
A temperatura ambiente, el alcohol alílico es estable en forma de sustancia líquida. Sin embargo, calentar el alcohol alílico a temperaturas superiores a 100 °C da como resultado la creación de polímeros solubles en agua (alcoholes polialílicos), que reaccionan con ácidos alquenoicos para producir aceites secantes.
También puede injertarse en poliimidas o copolimerizarse con estireno en presencia de oxígeno.
Las espumas de poliuretano resistentes al fuego se producen mediante una reacción de condensación entre alcohol alílico y poliéteres de metilglucósido, seguida de bromación y posterior adición de isocianatos.
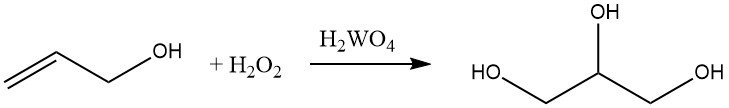
El alcohol alílico se puede hidroxilar con peróxido de hidrógeno en presencia de ácido de tungsteno para formar glicerol. Esta reacción es comercialmente importante para la producción de glicerol.
La hidroxilación con hidroperóxidos orgánicos con un catalizador de vanadio produce glicidol (oxiranilmetanol), que también puede obtenerse mediante la reacción de alcohol alílico con perácidos.
La deshidrogenación en fase gaseosa con aire en presencia de catalizadores como paladio, plata o cobre conduce a la formación de acroleína.
La oxidación en fase líquida del alcohol alílico utilizando un catalizador de paladio produce ácido acrílico y acroleína con una selectividad del 83%.
La hidrogenación catalítica del alcohol alílico da 1-propanol.
La cloración del alcohol alílico en una solución acuosa produce mono y diclorohidrinas de glicerol que pueden hidrolizarse aún más para producir glicerol.
La bromación en una solución acuosa tamponada con cloruro de calcio da como resultado la formación de 2,3-dibromo-1-propanol, un compuesto utilizado en materiales resistentes al fuego.
La reacción del alcohol alílico con cloruro de alilo produce éter dialílico (punto de ebullición: 94°C), mientras que con cloruro de metalilo se produce éter alilmetalílico.
El alcohol alílico se puede agregar al tetracloruro de carbono mediante iniciación radical para formar 2,4,4,4-tetracloro-1-butanol (intermedio utilizado como retardante de llama).
Puede hidroformilarse en presencia de cobalto carbonilo para formar 4-hidroxibutiraldehído. Con catalizadores de complejo de rodio el rendimiento de 4-hidroxibutiraldehído aumenta hasta el 80 %. A continuación, el aldehído se puede hidrogenar hasta obtener 1,4-butanodiol, que es un monómero valioso para la síntesis de poliuretanos.
Si la hidroformilación del alcohol alílico se produce en la fase de vapor usando complejos de trifenilfosfina de rodio soportados sobre vehículos porosos, se logra un alto rendimiento de tetrahidro-2-furanol (94%).
El alcohol alílico se puede carbonilar en una solución de ácido acético con un catalizador de cloruro de paladio para formar ácido 3-butenoico.
3. Producción de alcohol alílico
El alcohol alílico normalmente se produce a partir de propeno, que es un hidrocarburo gaseoso. Hay una variedad de formas de producir alcohol alílico a partir de propeno, pero los dos métodos más comunes son: el proceso de cloruro de alilo y el proceso de óxido de propileno.
3.1. Hidrólisis del cloruro de alilo
La hidrólisis del cloruro de alilo es un proceso comercial para producir alcohol alílico. El cloruro de alilo se hace reaccionar con una solución diluida de hidróxido de sodio a 150 °C y 1,3 – 1,4 MPa, dando entre 85 y 95 % de alcohol alílico.
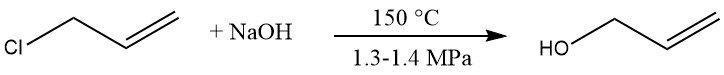
Los subproductos son éter dialílico (5 – 10 %), cloropropenos, propionaldehído y material de alto punto de ebullición.
El cloruro de alilo y la solución acuosa alcalina deben mezclarse bien para mantener un valor de pH constante. El cloruro de alilo debe convertirse casi cuantitativamente porque es corrosivo y no puede recuperarse económicamente. Por lo tanto, la reacción se lleva a cabo en un reactor de reciclaje, siendo el níquel el material de reactor más adecuado.
En la Figura 1 se muestra una planta comercial para la producción de alcohol alílico mediante hidrólisis continua de cloruro de alilo. El agua se elimina del alcohol alílico en bruto mediante destilación azeotrópica con éter dialílico como agente de arrastre. El azeótropo de alcohol alílico crudo y agua (72 % de alcohol alílico) se puede utilizar sin purificación adicional para algunas reacciones.
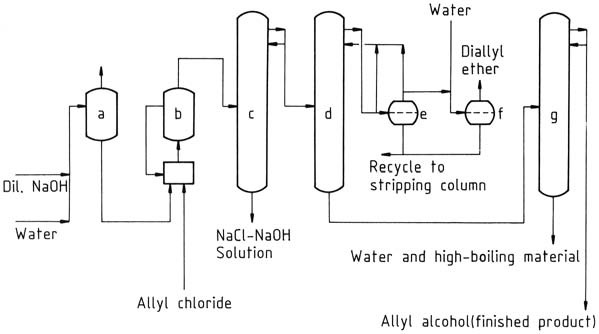
a) Precalentador; b) Reactor de hidrólisis con sistema de reciclaje; c) columna de decapado; d) Columna de deshidratación; e) Separador; f) Tanque de lavado de éter dialílico; g) Columna de purificación de alcohol alílico
Aquí hay algunos detalles adicionales sobre la hidrólisis del cloruro de alilo:
- La reacción es exotérmica, por lo que es importante controlar la temperatura para evitar la formación de subproductos.
- La reacción también es corrosiva, por lo que es importante utilizar materiales resistentes a la corrosión para el reactor y las tuberías.
- Los subproductos de la reacción pueden reciclarse o venderse como subproductos.
- La etapa de destilación azeotrópica se utiliza para eliminar el agua del alcohol alílico crudo. Este paso es necesario para obtener un producto de alcohol alílico de alta pureza.
3.2. Isomerización de óxido de propeno
La transposición catalítica del óxido de propeno se utiliza ahora más ampliamente en la producción comercial que la hidrólisis del cloruro de alilo. El catalizador preferido para esta reacción es el fosfato de litio.
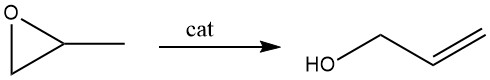
En el proceso en fase de vapor, el vapor de óxido de propeno se dirige sobre un catalizador de fosfato de litio, con temperaturas que oscilan entre 250 y 350 °C. Este catalizador está compuesto por hasta un 30% de material inerte en una estructura de lecho fijo. Las conversiones rondan el 70 – 75 %, acompañadas de una selectividad de alcohol alílico del 97 %.
El rendimiento espacio-temporal resultante es de 0,5 kg de alcohol alílico por litro de catalizador por hora. Olin Mathieson emplea un catalizador de fosfato de litio que incorpora hidróxido alcalino al 1%; sin embargo, este catalizador debe regenerarse después de 40 horas mediante lavado con acetona.
Un catalizador distinto, formulado por Chemische Werke Hüls, contiene un 73,6 % de fosfato de litio y un 17,5 % de sílice, por lo que no requiere regeneración. Sorprendentemente, incluso después de 1200 horas, mantiene una selectividad de alcohol alílico del 97,3%.
Si bien se ha sugerido el arseniato de litio como catalizador de isomerización, no ofrece ninguna ventaja sustancial sobre el fosfato de litio. Un método anterior, catalizado por óxido de cromo y desarrollado por Wyandotte Chemical Corp., demuestra conversiones y selectividades significativamente más bajas.
En el proceso en fase líquida, el proceso Progil utiliza un catalizador de fosfato de litio finamente molido suspendido en disolventes de alto punto de ebullición como terfenilo o alquilbencenos. Se introduce óxido de propeno en la suspensión a 280°C.
Esta variante alcanza un índice de conversión del 60 %, una selectividad de alcohol alílico del 92 % y un rendimiento espacio-temporal de 1 kg de alcohol alílico por litro y por hora. La vida útil de los catalizadores oscila entre 500 y 1000 horas.
Una técnica comparable, patentada por Jefferson Chemical Co., utiliza una mezcla de disolventes de bifenilo y éter de difenilo.
3.3. Hidrólisis del acetato de alilo
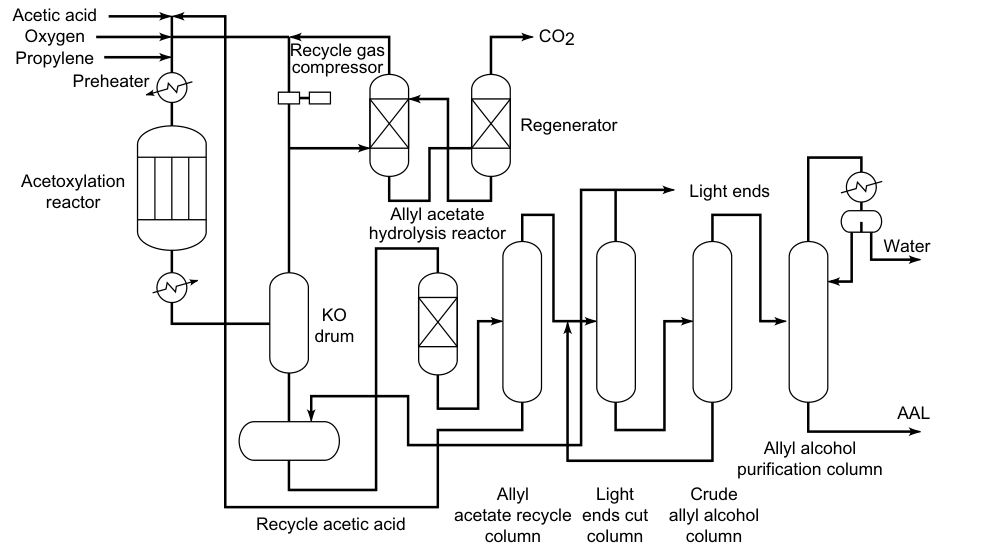
El propeno, el ácido acético y el oxígeno reaccionan en fase gaseosa sobre catalizadores de paladio para formar acetato de alilo:
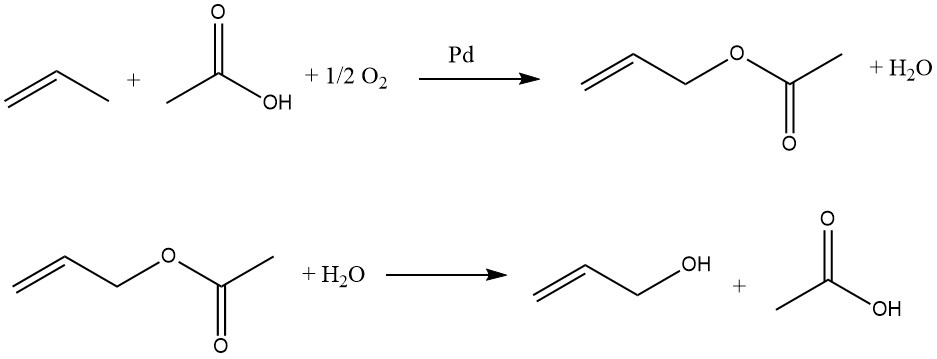
Esta reacción es exotérmica, por lo que se debe controlar la temperatura del reactor. A continuación, el acetato de alilo se hidroliza a alcohol alílico en un reactor separado. El ácido acético se recupera y reutiliza en la oxidación del propeno. Por lo tanto, sólo se requieren propeno y oxígeno como materias primas para la preparación de alcohol alílico.
Este proceso no requiere cloro, lo que lo hace más ecológico que otros métodos de producción de alcohol alílico. El acetato de alilo se puede hidrolizar calentándolo a aproximadamente 230 °C y 3 MPa.
En el proceso Bayer, la hidrólisis se lleva a cabo catalíticamente sobre un intercambiador de cationes ácido (poliestireno sulfonado) a 100 °C. El rendimiento global de alcohol alílico es del 90%.
3.4. Hidrogenación de acroleína
El alcohol alílico se sintetiza mediante hidrogenación catalítica de acroleína en fase de vapor. Usando catalizadores de cadmio-zinc, se puede lograr un rendimiento de hasta el 70%, y se pueden obtener resultados similares usando aleaciones de plata-cadmio soportadas sobre soportes inertes como alúmina o sílice.
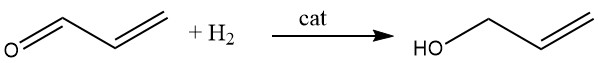
Alternativamente, la acroleína se puede reducir con etanol o alcohol isopropílico en presencia de una mezcla de óxido de magnesio y óxido de zinc. Esta reacción ocurre en fase de vapor a 400°C, lo que da como resultado rendimientos de alcohol alílico de hasta el 80%.
4. Usos del alcohol alílico
Los usos del alcohol alílico son los siguientes:
- Producción de glicerol: El alcohol alílico fue empleado inicialmente como materia prima en la fabricación de glicerol por empresas como Daicel Chemical Company.
- Monómero de bis(carbonato de alilo) de dietilenglicol: antes de 1985, el alcohol alílico se utilizaba como monómero en la producción de bis(carbonato de alilo) de dietilenglicol, que se utiliza en la creación de lentes ópticas de plástico.
- Producción de epiclorhidrina: Showa Denko K.K. Comenzó a utilizar alcohol alílico como precursor en la producción de epiclorhidrina, un compuesto utilizado en diversas aplicaciones. Otros fabricantes de epiclorohidrina también consideraron la transición al proceso de alcohol alílico.
- Producción de 1,4-butanodiol: ARCO Chemical Company estableció una importante planta de producción de alcohol alílico y empleó alcohol alílico como materia prima en la fabricación de 1,4-butanodiol. Esta es una aplicación notable, que marca el primer caso de producción industrial de 1,4-butanodiol utilizando alcohol alílico.
- Producción de ésteres alílicos: El alcohol alílico sirve como materia prima principal para producir ésteres alílicos, específicamente ftalatos de dialilo y metacrilato de alilo.
- Producción de éter alílico: El alcohol alílico también se utiliza en la producción de éter alílico, específicamente éter alil glicidílico.
- Copolímero de estireno-alcohol alílico: Monsanto Chemical Company fabrica un copolímero de estireno-alcohol alílico. Este copolímero encuentra aplicaciones en pinturas solubles en agua, resinas alquídicas y uretanos como polioles.
- El alcohol alílico sufre reacciones de copolimerización con otros monómeros para producir productos intermedios utilizados en la fabricación de materiales resistentes al fuego o como nematocida, fungicida o conservante.
5. Toxicología y Salud Ocupacional
El alcohol alílico ha sido ampliamente estudiado por sus efectos irritantes y tóxicos. Su olor se puede percibir aproximadamente a 0,8 ppm.
Las concentraciones entre 6 y 12 ppm provocan irritación nasal, mientras que 25 ppm inducen una irritación ocular grave con síntomas como lagrimeo, sensibilidad a la luz, visión borrosa y dolor ocular.
Concentraciones más altas pueden provocar necrosis corneal y ceguera temporal. Las personas sensibles pueden experimentar irritación ocular en concentraciones tan bajas como 2 a 5 ppm.
En estudios con animales, perros, conejos, cobayas y ratas toleraron la inhalación diaria de vapor de alcohol alílico en concentraciones de 2 a 7 ppm durante 7 horas al día durante 6 meses.
El valor límite umbral (TLV) y la concentración máxima permitida (MAK) para el alcohol alílico se establecen en 2 ppm. El límite de exposición a corto plazo es mayor, 4 ppm.
El alcohol alílico ha mostrado efectos hepatotóxicos, observándose necrosis de las células hepáticas en ratas después de la administración oral e intraperitoneal. Las aplicaciones orales únicas provocaron necrosis hepática en ratas, lo que provocó la muerte. La DL50 para conejos está entre 50 y 80 mg/kg, y para ratas es de 64 mg/kg.
El contacto de la piel con alcohol alílico supone un riesgo de intoxicación sistémica debido a su alta tasa de absorción. Incluso pequeñas cantidades, como una sola gota (aproximadamente 50 mg), pueden provocar efectos sistémicos además de irritación local.
Las ratas expuestas a 50 ppm de alcohol alílico en el agua potable durante 15 semanas mostraron tolerancia sin efectos adversos perceptibles.
Estos hallazgos resaltan la naturaleza tóxica e irritante del alcohol alílico, con diversos umbrales de concentración y efectos potenciales en diferentes rutas de exposición. Las pautas de seguridad ocupacional y los riesgos potenciales asociados con la exposición de la piel son consideraciones importantes al manipular este compuesto.
Referencias
- Allyl Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
Allyl Alcohol and Monoallyl Derivatives; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0112122514010701.a01.pub2
Preguntas más frecuentes
El alcohol alílico es un compuesto orgánico con la fórmula química C3H6O. Pertenece a la clase de los alcoholes y contiene tanto un grupo hidroxilo (-OH) como un grupo alilo (-CH2CH=CH2). Es un importante intermediario químico utilizado en diversas industrias.
El nombre común del alcohol alílico es «propenol».
El alcohol alílico se utiliza como precursor para la producción de glicerol, ésteres alílicos y otras sustancias químicas. También se utiliza en la síntesis de polímeros, materiales resistentes al fuego y productos farmacéuticos.
Sí, el alcohol alílico es tóxico y puede ser dañino si se ingiere, se inhala o se absorbe a través de la piel. Puede causar irritación en los ojos, la piel y el tracto respiratorio.
El alcohol alílico es principalmente un compuesto sintetizado industrialmente y no se encuentra comúnmente en fuentes naturales. Normalmente se produce mediante procesos químicos en entornos controlados.
El alcohol alílico se produce mediante la hidrólisis del cloruro de alilo o acetato de alilo y la transposición del óxido de propeno. Estos procesos implican reacciones químicas que convierten los compuestos precursores en alcohol alílico.
Sí, el alcohol alílico es miscible en agua hasta cierto punto debido a su grupo hidroxilo hidrófilo.
