Ácido Tricloroacético: Propiedades, Producción y Usos

El ácido tricloroacético (TCA), también conocido como ácido tricloroetanoico, es un sólido cristalino higroscópico incoloro con la fórmula química Cl3CCOOH. Es un ácido fuerte y una sustancia corrosiva que puede dañar la piel, los ojos y otros tejidos al entrar en contacto.
Tabla de contenido
1. Propiedades físicas del ácido tricloroacético
El ácido tricloroacético [76-03-9] existe como cristales romboédricos higroscópicos a temperatura y presión estándar con un olor acre. Tiene alta solubilidad en agua y diversos disolventes orgánicos. Las propiedades físicas clave incluyen:
- Masa molar: 163,4 g/mol
- Punto de fusión: 59,2 °C
- Punto de ebullición: 197,6 °C a 101,3 kPa; ~107 °C bajo presión reducida (2,8 kPa)
- Densidad a 60 °C: 1,63 g/cm³
- Índice de refracción a 65 °C: 1,459
- pKa: 0,70
- Momento dipolar: 3,23 D
2. Propiedades químicas del ácido tricloroacético
El ácido tricloroacético presenta una fuerte acidez (pKa = 0,7) debido a la sustitución completa de los hidrógenos metílicos por átomos de cloro, lo que lo hace más estable que el ácido cloroacético y el ácido dicloroacético y menos susceptibles a reacciones de sustitución de átomos de cloro.
En condiciones acuosas, las temperaturas elevadas inducen la descomposición del ácido tricloroacético en cloroformo y dióxido de carbono. Este proceso se acelera en presencia de bases orgánicas o inorgánicas, mientras que la anilina, el resorcinol y el carbón activado sirven como catalizadores en condiciones anhidras.
La descomposición puramente térmica ocurre solo por encima del punto de ebullición y produce hidrocarburos clorados, monóxido de carbono, dióxido de carbono y fosgeno.
El ácido tricloroacético forma sales con diversas bases orgánicas e inorgánicas. Estas sales se descomponen al calentarlas en ambientes acuosos, liberando cloroformo.
3. Producción de ácido tricloroacético
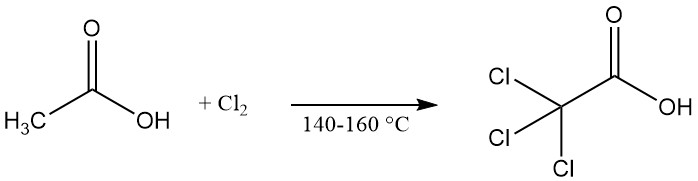
El ácido tricloroacético se produce comercialmente mediante la cloración de ácido acético, ácido cloroacético o sus aguas madre a temperaturas elevadas (140–160 ° C). Hipoclorito de calcio se puede utilizar como catalizador para acelerar la reacción.
El uso de sales de metales pesados como catalizadores sigue siendo controvertido. Si bien se han utilizado ejemplos como compuestos de hierro y cobre, persisten las preocupaciones con respecto a su eliminación mediante precipitación con ácido sulfúrico o fosfórico.
Los enfoques alternativos explorados incluyen el uso de ácido fosfórico al 2% o la combinación de catalizadores con luz ultravioleta. También se han desarrollado métodos sin catalizadores.
El producto bruto resultante, que normalmente contiene alrededor de un 95 % de ácido tricloroacético, se purifica mediante cristalización en estado fundido. Esto elimina eficazmente las impurezas presentes en las aguas madre. Se puede lograr una mayor mejora de la pureza mediante centrifugación o pasos de recristalización adicionales.
Cuando se utiliza ácido sulfúrico como catalizador a temperaturas de reacción más altas (hasta 180 °C), no es necesaria la purificación posterior a la producción.
4. Usos del ácido tricloroacético
Antes de la década de 1990, la aplicación principal del ácido tricloroacético era la producción de su sal sódica, utilizada como herbicida selectivo y en combinación con 2,4-D y Formulaciones de 2,4,5-T para el control total de malezas. Sin embargo, debido a preocupaciones ecotoxicológicas, esta aplicación ha disminuido significativamente.
Más allá de los herbicidas, el ácido tricloroacético encuentra diversos usos en diversos campos:
- En el tratamiento de superficies metálicas, el ácido tricloroacético se emplea como agente de grabado y decapado
- Se utiliza como agente hinchante y disolvente en la industria del plástico.
- En Bioquímica, para la precipitación de proteínas, albúmina, ADN y ARN
- Agente auxiliar en acabado textil
- Se agrega como aditivo para mejorar las propiedades de alta presión de los aceites lubricantes.
- Debido a su naturaleza corrosiva, el ácido tricloroacético se emplea en entornos controlados para eliminar verrugas, durezas de la piel y tratar afecciones cutáneas específicas.
- El ácido tricloroacético y sus ésteres sirven como valiosos materiales de partida para diversas síntesis orgánicas.
- El ácido exhibe reacciones de color distintivas, lo que permite la identificación de diversos compuestos orgánicos en química analítica.
5. Derivados del ácido tricloroacético
5.1. Cloruro de tricloroacetilo
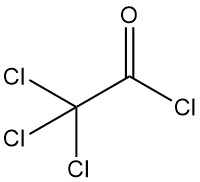
Cloruro de tricloroacetilo [76-02-8] tiene la fórmula química Cl3CCOCl y una masa molar de 197,9 g/mol, posee propiedades físicas similares al cloruro de dicloroacetilo:
- Punto de ebullición: 118 °C a 101,3 kPa
- Densidad a 20°C: 1.620 g/cm³
- Índice de refracción a 20°C: 1,4695
El cloruro de tricloroacetilo se hidroliza fácilmente a ácido tricloroacético y ácido clorhídrico a 75–85 °C en agua. Reacciona con hidróxido de amonio o soluciones concentradas de carbonato de sodio para formar las sales correspondientes.
El cloruro de tricloroacetilo se produce mediante varios métodos:
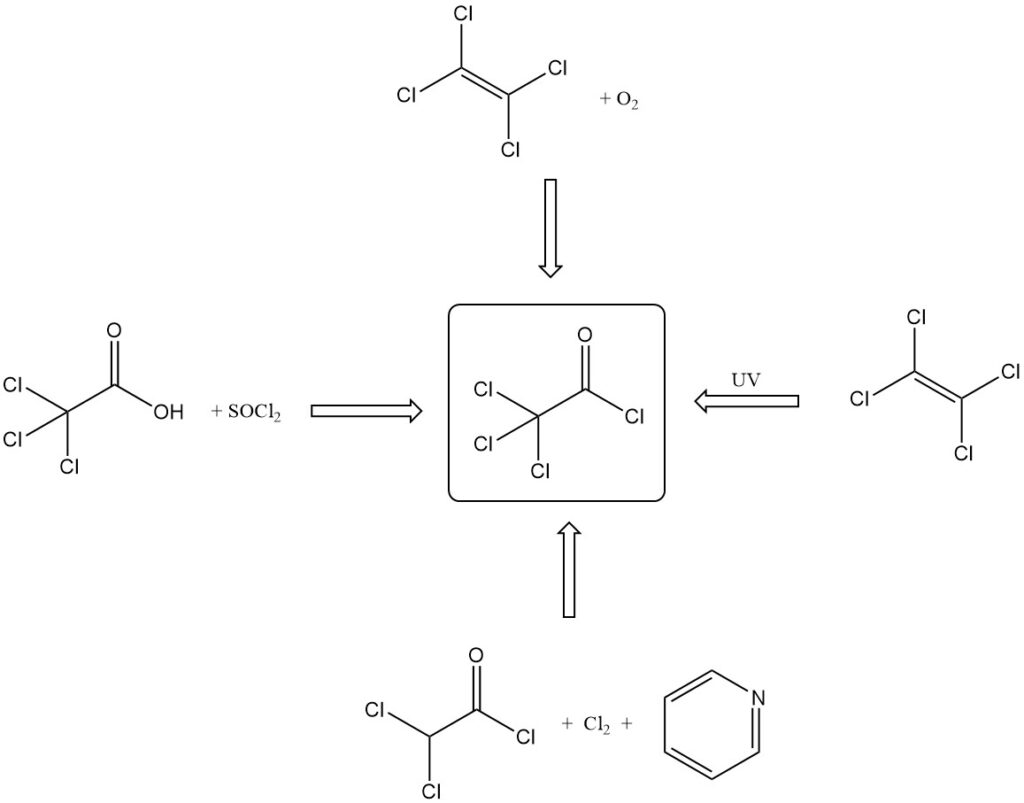
- Por reacción del ácido tricloroacético con cloruros de ácidos inorgánicos (SOCl2, PCl3) o P2O5 y HCl.
- Por oxidación de tetracloroetileno con ácido sulfúrico fumante, oxígeno o ácido nítrico y ácido sulfúrico fumantes.
- Por oxidación fotoquímica de tetracloroetileno con luz ultravioleta, irradiación radiactiva o sensibilización con cloro/yodo.
- Por la reacción del cloruro de dicloroacetilo con piridina y cloro.
El cloruro de tricloroacetilo se utiliza para producir ésteres, anhídridos y pesticidas del ácido tricloroacético (p. ej., clorpirifos) y como material de partida para la síntesis de ácido trifluoroacético.
5.2. Ésteres del ácido tricloroacético
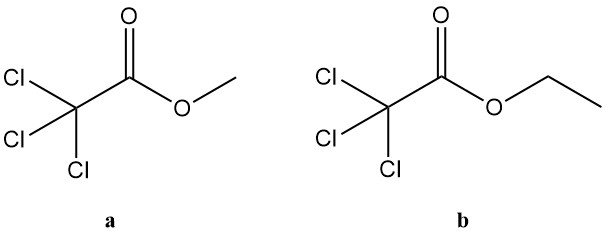
Los ésteres del ácido tricloroacético abarcan un amplio grupo de compuestos, pero sólo los derivados metílicos y etílicos tienen un interés industrial significativo. Estos dos ésteres encuentran aplicación en diversas áreas:
- Disolventes: si bien no son su uso principal, tanto el tricloroacetato de metilo como el de etilo pueden funcionar como disolventes especializados cuando sea necesario.
- Estos ésteres sirven como valiosos materiales de partida para la síntesis de otros compuestos, particularmente amidas y ésteres de polialcohol. Estos derivados se han explorado por su uso potencial como plastificantes, ofreciendo funcionalidades o propiedades específicas que no están fácilmente disponibles en los plastificantes convencionales.
- El tricloroacetato de etilo encuentra una aplicación más amplia como cocatalizador en polimerizaciones tipo Ziegler.
Como referencia, a continuación se muestran algunas propiedades físicas clave de los dos ésteres de relevancia industrial:
a. Tricloroacetato de metilo:
- Número CAS: 598-99-2
- Fórmula: Cl3CCOOCH3
- Masa molar: 177,43 g/mol
- Punto de ebullición: 153 °C (a 101,3 kPa)
- Densidad: 1,4864 g/cm³ (a 20 °C)
- Índice de refracción: 1,4572 (a 20 °C)
b. Tricloroacetato de etilo:
- Número CAS: 515-84-4
- Fórmula: Cl3CCOOCH2CH3
- Masa molar: 191,45 g/mol
- Punto de ebullición: 167,5 °C (a 101,3 kPa)
- Densidad: 1,3823 g/cm³ (a 20 °C)
- Índice de refracción: 1,4505 (a 20 °C)
5.3. Tricloroacetato de sodio
El tricloroacetato de sodio (Cl3CCOONa), la única sal del ácido tricloroacético de importancia industrial, demuestra varias propiedades clave:
Propiedades físicas:
- Un sólido incoloro se descompone por debajo de su punto de fusión.
- Altamente soluble en agua y metanol, moderadamente soluble en otros disolventes polares .
- La solubilidad en agua aumenta con la temperatura (50 % a 5 °C, 60 % a 20 °C, 70 % a 40 °C).
Propiedades químicas:
- Estable cuando está seco, pero sufre hidrólisis en una solución acuosa, generando bicarbonato de sodio y ácido dicloroacético.
- La descomposición térmica a temperaturas elevadas (125–170 °C) produce cloruro de sodio, cloruro de tricloroacetilo, monóxido de carbono y dióxido de carbono.
- Reacciona con olefinas si se utilizan catalizadores de transferencia de fase.
Producción:
El tricloroacetato de sodio se produce industrialmente neutralizando el ácido tricloroacético con hidróxido de sodio o carbonato.
Aplicaciones:
- El tricloroacetato de sodio, combinado con agentes reductores y sales metálicas, promueve la polimerización del vinilo.
- Ayuda a la absorción y dispersión del tinte en fibras de poliéster y celulosa.
- En el papel diazo desarrollado por calor, se utiliza para liberar la base a temperaturas elevadas (100–200 °C)
- Anteriormente se utilizaba como herbicida para controlar malezas monocotiledóneas, con una vida media en el suelo de 1 a 2 meses; sin embargo, las preocupaciones sobre la ecotoxicidad llevaron a sus prohibiciones generalizadas en EE. UU., Canadá, la UE y América del Sur.
6. Toxicología del ácido tricloroacético y del tricloroacetato
El ácido tricloroacético presenta varios riesgos para la salud debido a su naturaleza corrosiva y su capacidad de precipitación de proteínas. Si bien no se absorbe fácilmente a través de la piel, puede causar irritación significativa en los ojos y la piel al entrar en contacto.
Datos clave de toxicidad:
- LD50 oral: 3320–5060 mg/kg (ratas)
- Dosis letal más baja (perras): 1590 mg/kg
- Inhalación (4 horas, dosis alta): No se observaron efectos significativos en animales
- Exposición humana aguda: Quemaduras en la piel y los ojos, irritación, efectos gastrointestinales
- Datos crónicos: limitados, pueden afectar el tracto respiratorio superior
- TLV-TWA propuesto: 1 ppm (7 mg/m³)
Las preocupaciones sobre la seguridad del ácido tricloroacético incluyen:
- Daños en la piel y los ojos: Sus propiedades corrosivas pueden provocar quemaduras e irritación.
- Unión a proteínas: desplaza a los fármacos de los sitios de unión a proteínas, alterando potencialmente su eficacia.
- Datos crónicos limitados: los posibles efectos a largo plazo requieren más investigación.
Tricloroacetato tiene una ingesta diaria tolerada provisionalmente (IDPT) de 0,075 mg/kg de masa corporal. Este valor se basa en un estudio de alimentación subcrónica de perros, donde se observaron varios efectos adversos en dosis de ≥ 2000 mg/kg en los alimentos.
Se observaron efectos adversos, como pérdida de masa corporal, malestar, daño tisular (encías, revestimiento de la boca), cambios en los glóbulos blancos, resultados anormales en la orina, y lesiones cardíacas, atrofia muscular y alteración de la producción de esperma.
El nivel del efecto no tóxico fue de 500 mg/kg en la dieta. Los datos in vitro no sugieren potencial mutagénico.
Referencia
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
