Ácido sórbico: propiedades, reacciones, producción y usos
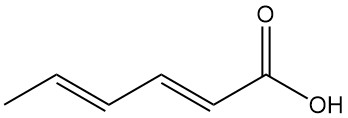
¿Qué es el ácido sórbico?
El isómero trans, trans del ácido 2,4-hexadienoico, comúnmente conocido como ácido sórbico, es un ácido graso insaturado de cadena corta con la fórmula química C6H8O2. Es un ácido orgánico natural que aparece como un sólido incoloro con un ligero olor.
El ácido sórbico deriva su nombre de «Sorbus aucuparia Linnaeus», la nomenclatura científica del fresno de montaña. En 1859, Hofmann aisló un aceite con un olor distintivo de las bayas de serbal verdes por destilación.
El componente principal de este aceite era el ácido parasórbico, identificado como la d-lactona del ácido sórbico. Los ácidos fuertes, o álcalis, catalizan la conversión del ácido parasórbico en ácido sórbico isomérico. Las bayas de serbal verdes contienen aproximadamente un 0,1 % de ácido parasórbico.
El ácido sórbico se encuentra en los depósitos grasos de ciertos pulgones como 2-sorboil-1,3-dimiristina. Doebner estableció la estructura del ácido sórbico en 1890 y se sintetizó por primera vez en 1900.
Müller (Alemania) y Gooding (Estados Unidos) descubrieron de forma independiente las propiedades antimicrobianas del ácido sórbico en 1939-1940. La producción industrial de ácido sórbico y sorbato de potasio comenzó en la década de 1950, inicialmente en los Estados Unidos, seguida por Alemania y Japón.
El ácido sórbico se utiliza como conservante alimentario primario debido a su seguridad y sus favorables características sensoriales.
Tabla de contenido
1. Propiedades físicas del ácido sórbico
El ácido sórbico forma cristales en forma de agujas o placas con un olor suave y característico y un sabor ligeramente ácido. Su solubilidad en agua es limitada, con valores de 0,16 g, 0,58 g y 3,9 g por 100 ml a 20 °C, 50 °C y 100 °C, respectivamente.
La solubilidad del ácido sórbico en alcoholes anhidros de bajo peso molecular y ácido acético anhidro es de aproximadamente 11-12 g por 100 ml. Las grasas líquidas pueden disolver de 0,5 a 1 g de ácido sórbico por 100 ml.
El ácido sórbico es volátil en vapor sin descomponerse. Esta propiedad se utiliza para su aislamiento analítico de los productos alimenticios.
Las propiedades físicas importantes del ácido sórbico se enumeran en la siguiente tabla.
| Propiedad | Valor |
|---|---|
| Número CAS | [110-44-1] |
| Fórmula | C6H8O2 |
| Masa molecular | 112,13 g/mol |
| Punto de fusión | 132–135 °C |
| Punto de ebullición | 228 °C (descomposición) |
| Temperatura de sublimación | por encima de 60 °C |
| Índice de refracción | 1,4248 |
| Densidad | 1,204 g/cm3 |
| Constante de disociación | 1,73×10-5 a 25 °C |
| pKa | 4,76 |
| Presión de vapor a 20 °C | <0,001 kPa |
| Presión de vapor a 100 °C | 0,25 kPa |
| Presión de vapor a 120 °C | 1,3 kPa |
2. Reacciones químicas del ácido sórbico
La reactividad del ácido sórbico se caracteriza por la presencia de un grupo carboxilo y un sistema de doble enlace conjugado.
Las reacciones del ácido carboxílico incluyen reacciones típicas como la formación de sales, ésteres y otros derivados. El hidruro de litio y aluminio reduce selectivamente el grupo carboxilo a alcohol sorbílico (2,4-hexadien-1-ol).
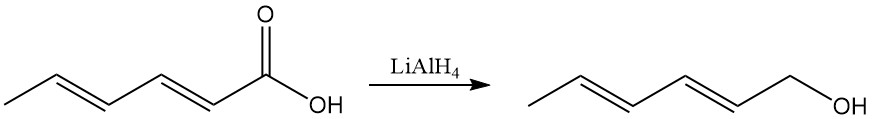
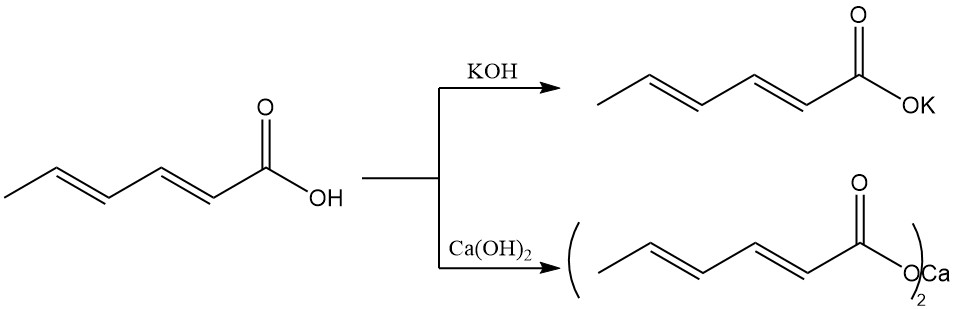
A diferencia del ácido sórbico, las sales alcalinas tienen una mayor solubilidad en agua, lo que las hace preferidas para los sistemas de conservación acuosos. El sorbato de potasio se produce a partir de ácido sórbico e hidróxido de potasio y tiene buena solubilidad en agua.
El sorbato de calcio se forma a partir de ácido sórbico e hidróxido de calcio y se caracteriza por una baja solubilidad en agua.
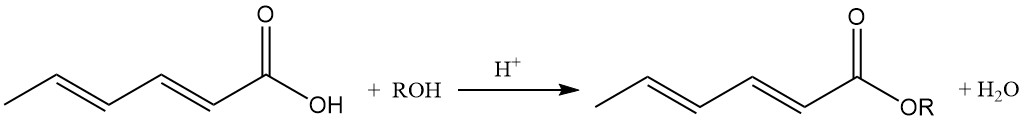
Los ésteres de sorbato de alquilo inferior poseen propiedades antimicrobianas y son activos en ambientes neutros y débilmente alcalinos, a diferencia del ácido sórbico.
Las reacciones que involucran el sistema de doble enlace a menudo producen mezclas de productos complejas debido a las diferentes reactividades del doble enlace y las posibles isomerizaciones, reordenamientos, migraciones y polimerizaciones.
Las reacciones de adición y la hidrogenación parcial se dirigen preferentemente al doble enlace 4,5.
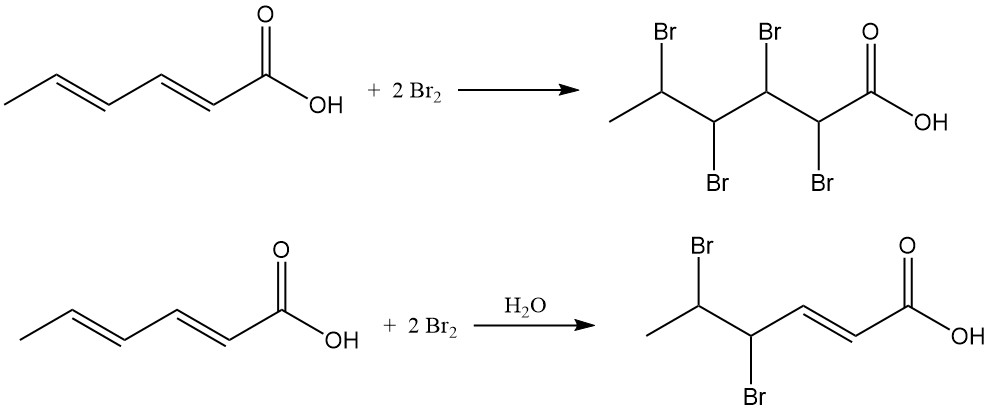
La adición de cloro da como resultado mezclas de ácido clorohexenoico con un contenido promedio de cloro de 38-48 % en peso. La reacción del bromo con ácido sórbico en solventes orgánicos produce ácido 2,3,4,5-tetrabromohexanoico, mientras que la bromación acuosa produce principalmente ácido 4,5-dibromo-2-hexenoico.
A pesar de su doble insaturación, el ácido sórbico cristalino puro muestra una alta resistencia a la oxidación por aire, permaneciendo estable durante años en condiciones de temperatura ambiente. Sin embargo, las impurezas como los disolventes, los metales pesados o los ácidos hexadienoicos isoméricos reducen significativamente su estabilidad.
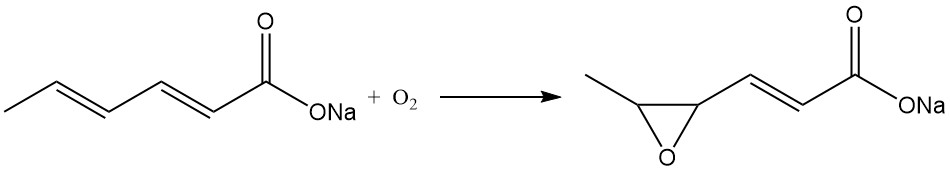
Consideraciones similares se aplican al sorbato de potasio, mientras que el sorbato de sodio es inestable en forma sólida y no se produce comercialmente. El sorbato de sodio se convierte rápidamente en la sal sódica del ácido 4,5-epoxi-2-hexenoico en presencia de aire.
La oxidación de sorbatos acuosos o ácido sórbico en disolventes orgánicos genera numerosos compuestos carbonílicos, aunque esta reacción depende de la presencia de una gran cantidad de oxígeno y aumenta considerablemente con la exposición a la luz solar.
Las soluciones sin oxígeno mantienen la estabilidad incluso bajo exposición a la luz. El ácido sórbico en alimentos con un contenido de humedad intermedio sufre una degradación gradual a lo largo de meses en presencia de aire.
La oxidación de soluciones acuosas ácidas de ácido sórbico con dicromato de potasio produce malonaldehído. La reacción del malonaldehído con ácido 2-tiobarbitúrico produce un aducto rojo fluorescente 1:2 (malonaldehído:ácido 2-tiobarbitúrico), que se utiliza como indicador de color en el análisis del ácido sórbico.
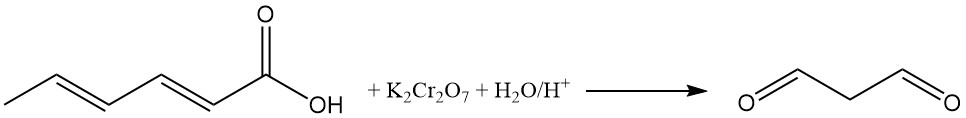
Cuando se incorpora a los alimentos, la estabilidad del ácido sórbico generalmente coincide con la de los componentes esenciales de los alimentos, como vitaminas, sabores y aromas. Por lo tanto, el potencial teórico de autooxidación del ácido sórbico plantea desafíos prácticos mínimos para su conservación.
3. Producción de ácido sórbico
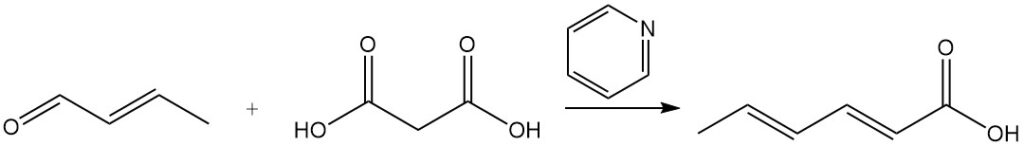
El ácido sórbico se sintetizó inicialmente mediante el proceso Doebner, que implicaba una reacción de condensación entre crotonaldehído y ácido malónico en piridina. Si bien muchas otras síntesis utilizan principios similares, la mayoría son comercialmente poco prácticas debido a los bajos rendimientos, los costosos materiales de partida o los altos costos de producción.
Esto también se aplica a un proceso de Union Carbide de los años 1950-1960 que oxidaba el 2,4-hexadienal a ácido sórbico con catalizadores. El proceso se abandonó debido a la formación de hasta un 20% de ácidos hexadienoicos isoméricos, que son menos estables que el ácido sórbico y requieren una purificación compleja. Los microorganismos también pueden oxidar el 2,4-hexadienal a ácido sórbico.
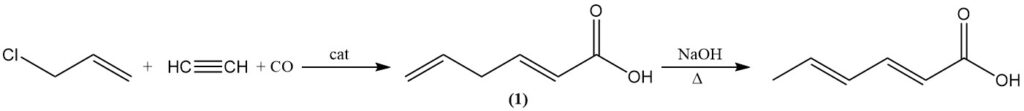
Alternativamente, el ácido sórbico se puede producir isomerizando el ácido 2,5-hexadienoico (1) hirviéndolo con álcali acuoso. El ácido 2,5-hexadienoico se forma por la reacción del cloruro de alilo con acetileno, monóxido de carbono y agua utilizando un catalizador de tetracarbonilníquel.
La escisión ácida de la 5-vinil-γ-butirolactona, que se obtiene a partir de 1,3-butadieno y ácido acético con catalizadores redox, no tiene importancia industrial. La adición de dióxido de carbono al 1,3-pentadieno en presencia de complejos de níquel es otra síntesis posible.
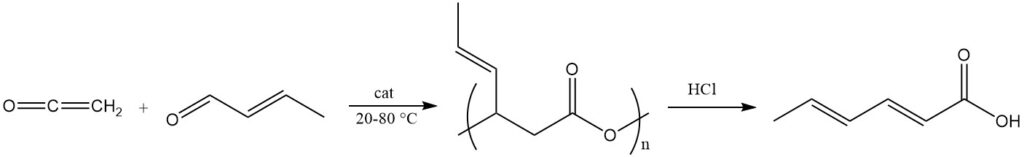
Un proceso común utiliza cetena y crotonaldehído en presencia de sales de metales de transición divalentes como catalizadores a una temperatura de 20 a 80 °C para producir un éster polimérico de ácido 3-hidroxi-4-hexenoico con una masa molecular aproximada de 2000.
Este poliéster se escinde para producir ácido sórbico mediante el uso de un tratamiento básico o ácido (por ejemplo, ácido clorhídrico) o catalizadores de complejos metálicos. Este poliéster también se utiliza como precursor para la síntesis de ésteres de sorbato mediante reacciones con alcoholes en presencia de catalizadores de esterificación ácidos.
El ácido sórbico crudo se purifica mediante recristalización a partir de una solución acuosa, mezclas de agua y alcohol o acetona, o disolventes orgánicos inmiscibles con agua como el acetato de metilo. También se han descrito tratamientos con disolventes orgánicos y destilación al vapor.
4. Usos del ácido sórbico
El ácido sórbico y sus sales (principalmente sorbatos de potasio y calcio) se utilizan predominantemente como conservantes debido a su bajo perfil de toxicidad. Es activo contra mohos y levaduras. Las principales áreas de aplicación incluyen:
- Alimentos: queso (varios tipos), productos horneados, productos de fruta (ciruelas pasas, pulpas, mermeladas, confituras, jugos, jaleas y caramelos), vino, vegetales fermentados, margarina, mantequilla y salchichas
- Piensos para animales
- Tabaco
- Cosméticos
- Productos farmacéuticos
- Materiales de embalaje para alimentos, piensos para animales, cosméticos y productos farmacéuticos
- Otros productos que entran en contacto con la piel humana o animal
Cabe destacar que, si bien en la literatura de patentes se han explorado usos potenciales para el ácido sórbico en reacciones químicas y polimerizaciones, estas aplicaciones siguen siendo comercialmente insignificantes debido a su costo relativamente alto.
El ácido sórbico también se puede utilizar como aditivo en la producción de caucho en frío y como intermediario en el proceso de fabricación de ciertos plastificantes y lubricantes.
5. Toxicología del ácido sórbico
El ácido sórbico presenta una toxicidad aguda baja, con una DL50 de aproximadamente 10 g/kg de peso corporal en ratas. Los estudios indican valores similares que van desde 7,4 a 8,7 g/kg. Si bien el ácido sórbico puede irritar las membranas mucosas debido a su naturaleza ácida, la irritación cutánea es poco común.
Se han llevado a cabo extensas investigaciones toxicológicas sobre el ácido sórbico debido a su introducción temprana como conservante de alimentos y a los requisitos de pruebas obligatorias. Los estudios agudos, subagudos, subcrónicos y crónicos demuestran constantemente un alto perfil de seguridad.
El ácido sórbico tiene un potencial alergénico bajo debido a su pequeño tamaño molecular, lo que evita la formación de anticuerpos y la unión covalente a proteínas, que suelen estar asociadas con hipersensibilidad inmediata. Los casos de reacciones pseudoalérgicas al ácido sórbico como aditivo alimentario son raros.
Estudios subcrónicos en ratas muestran un aumento del crecimiento y del peso del hígado con dosis altas de ácido sórbico (10% en el alimento), lo que se interpretó como hipertrofia debida a una mayor carga metabólica en lugar de toxicidad.
Estudios de alimentación a largo plazo (dos años) en ratas y ratones no demuestran efectos cancerígenos con concentraciones bajas de ácido sórbico (1,5-10% en el alimento). Dosis más altas (10%) conducen a una menor ganancia de peso y un agrandamiento de la tiroides, el hígado y los riñones.
El ácido sórbico no es teratogénico ni mutagénico ni genotóxico, y no es cancerígeno.
Metabólicamente, el ácido sórbico sufre una β-oxidación similar a otros ácidos grasos.
Tanto el ácido sórbico como el sorbato de potasio muestran un bajo potencial alergénico y fototóxico. Se ha informado de un solo caso de reacción alérgica de tipo 4 a pesar de su uso generalizado durante más de 40 años. El Panel de Expertos de Revisión de Ingredientes Cosméticos (CIR) clasifica ambas sustancias como «seguras» para los cosméticos.
El sorbato de sodio, que no se utiliza habitualmente en alimentos debido a su susceptibilidad a la oxidación, muestra una baja toxicidad genética in vitro, a diferencia del ácido sórbico y el sorbato de potasio.
Referencias
- Sorbic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_507.pub2
- https://pubmed.ncbi.nlm.nih.gov/2079232/
