Ácido propiónico: propiedades, reacciones, producción y usos
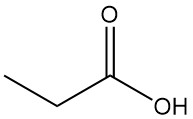
¿Qué es el ácido propiónico?
El ácido propiónico es un ácido carboxílico de cadena corta que se encuentra en la naturaleza y que tiene la fórmula CH3CH2COOH. Es un líquido incoloro con un olor penetrante, que a menudo se describe como similar al sudor o al queso.
El ácido propiónico fue descrito por primera vez por J. Gottlieb en 1844 y clasificado como ácido graso por J.J. Dumas en 1848. Su nombre se origina de las palabras griegas «protos» (primero) y «pion» (grasa), lo que refleja su posición como el primer ácido graso que se puede aislar de una solución acuosa mediante la destilación.
El ácido propiónico existe en la naturaleza, principalmente como ésteres dentro de los aceites esenciales. También puede formarse como ácido libre a través de varios procesos enzimáticos y de fermentación. Es un producto de la fermentación anaeróbica de carbohidratos en el estómago de los rumiantes. Los derivados del ácido propiónico se utilizan como intermediarios en varios ciclos fisiológicos.
El ácido propiónico se utiliza en la producción de ésteres de celulosa, dispersiones plásticas y herbicidas, y tiene un uso limitado en productos farmacéuticos, aromas y fragancias.
También se utiliza como conservante de alimentos debido a sus propiedades fungicidas y bactericidas, y se utiliza cada vez más para prevenir el deterioro por moho y bacterias en cereales forrajeros, alimentos para animales, productos de panadería y queso.
Tabla de contenido
1. Propiedades físicas del ácido propiónico
El ácido propiónico es un líquido incoloro con un olor penetrante. El ácido propiónico sólido cristaliza en el sistema monoclínico y se expande en un 12,2 % del volumen cuando se funde. Al igual que sus homólogos inferiores, el ácido acético y el ácido fórmico, una parte significativa de las moléculas de ácido propiónico se dimerizan tanto en fase líquida como gaseosa.
El ácido propiónico es miscible con agua y la mayoría de los disolventes orgánicos en todas las proporciones. Forma mezclas azeotrópicas con varios líquidos, incluida el agua (82,3 % en peso de agua, punto de ebullición 99,98 °C a 101,3 kPa).
Las tablas 1, 2 y 3 proporcionan datos dependientes de la temperatura para el ácido propiónico, incluida la presión de vapor, la densidad y la viscosidad dinámica, respectivamente.
| Temperatura (°C) | Presión (kPa) |
|---|---|
| 0,7 | 0,1 |
| 13,5 | 0,25 |
| 24,0 | 0,5 |
| 35,0 | 1,0 |
| 50,8 | 2,5 |
| 64,5 | 5,0 |
| 79,3 | 10,0 |
| 100,9 | 25 |
| 120,1 | 50 |
| 140,9 | 100 |
| 159,5 | 200 |
| 185,7 | 500 |
| 203,0 | 1000 |
| 219,7 | 2000 |
| Temperatura (°C) | Densidad (g/cm³) |
|---|---|
| -20 | 1,038 |
| -10 | 1,027 |
| 0 | 1,016 |
| 10 | 1,005 |
| 20 | 0,9935 |
| 30 | 0,9827 |
| 40 | 0,9719 |
| 50 | 0,9611 |
| 60 | 0,9503 |
| 70 | 0,9395 | 80 | 0,9286 |
| 90 | 0,9176 |
| 100 | 0,9066 |
| 110 | 0,8954 |
| 120 | 0,8841 | 130 | 0,8726 |
| 140 | 0,8609 |
| 150 | 0,849 |
| 160 | 0,8367 |
| 170 | 0,8241 |
| Temperatura (°C) | Viscosidad (mPa·s) |
|---|---|
| 0 | 154,1 |
| 20 | 109,4 |
| 50 | 73,8 |
| 100 | 45,0 |
| 150 | 31,0 |
Otras propiedades físicas del ácido propiónico se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| CAS | [79-09-4] |
| Fórmula | CH3CH2COOH |
| Peso molecular | 74,08 g/mol |
| Punto de fusión | -20,8 °C |
| Punto de ebullición | 141,3 °C |
| Índice de refracción | 1,3865 |
| Tensión superficial hacia el aire a | |
| 20 °C | 26,7 × 10-3 N/m |
| 90 °C | 19,7 × 10-3 N/m |
| Conductividad térmica a | |
| 0 °C | 153 W m-1 K-1 |
| 20 °C | 150 W m-1 K-1 |
| 50 °C | 144 W m-1 K-1 |
| 100 °C | 136 W m-1 K-1 |
| Conductividad eléctrica a 2 °C | 10-4 μS/cm |
| Constante dieléctrica dinámica a | |
| 10 °C | 3,30 |
| 40 °C | 3,44 |
| Momento dipolar eléctrico, μ | 1,75 D ± 5% |
| Constante de disociación en H2O a | |
| 0 °C | 1,274 × 10-5 mol/L |
| 20 °C | 1,338 × 10-5 mol/L |
| 40 °C | 1,284 × 10-5 mol/L |
| 60 °C | 1,160 × 10-5 mol/L |
| Potencial de ionización | 10,24 ± 0,03 eV |
| Calor de fusión | 101,65 kJ/kg |
| Calor de vaporización | 418,7 kJ/kg |
| Calor de formación | -164,5 kJ/mol |
| Calor de combustión | -1528,3 kJ/mol |
| Calor específico (líquido), a | |
| 0 °C | 2,077 kJ kg-1 K-1 |
| 50 °C | 2,299 kJ kg-1 K-1 |
| 100 °C | 2,516 kJ kg-1 K-1 |
| Calor específico (vapor), a | |
| 100 °C | 2,823 kJ kg-1 K-1 |
| 200 °C | 3,245 kJ kg-1 K-1 |
| 300 °C | 3,647 kJ kg-1 K-1 |
| Compresibilidad isentrópica a 20 °C | 0,750 GPa |
| Temperatura crítica | 338,9 °C |
| Presión crítica | 5,37 MPa |
| Volumen crítico | 0,322 kg/L |
| Reinicio rápido Punto | 50 °C |
| Temperatura de ignición | 485 °C |
| Límites de explosión en el aire a 20 °C | 2,1–12,0 vol% |
2. Reacciones del ácido propiónico
El ácido propiónico es el tercer miembro de la serie de los ácidos monocarboxílicos alifáticos, que tiene la reactividad característica de estos ácidos. Forma fácilmente sales, amidas, haluros de ácido y anhídridos.
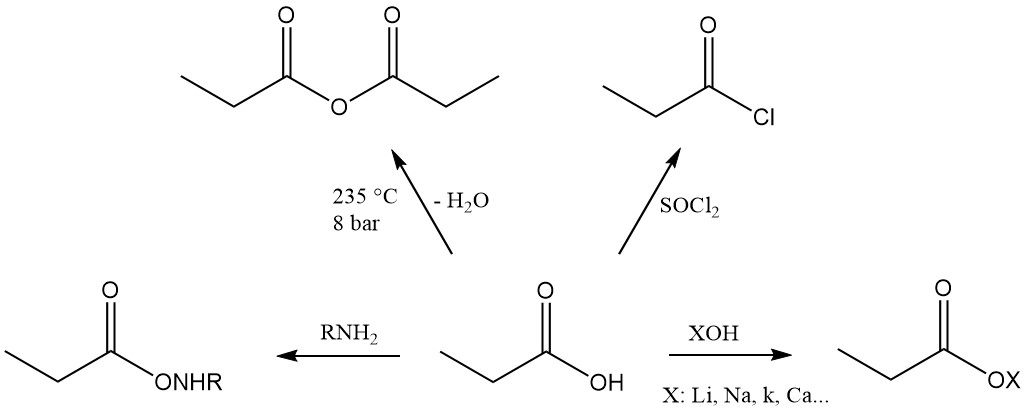
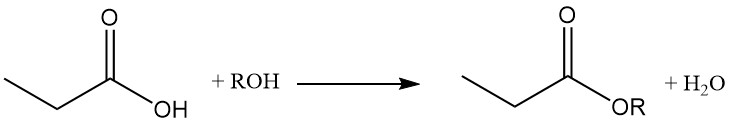
Los ésteres de ácido propiónico se forman por reacción con alcoholes y olefinas, mientras que la reacción con acetilenos produce los ésteres vinílicos correspondientes.
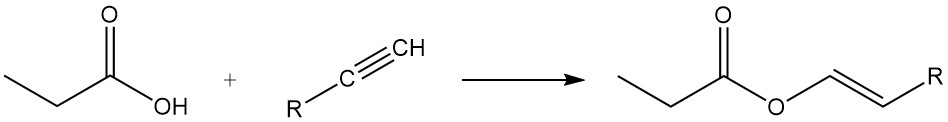
La reactividad del ácido propiónico es diferente a la del ácido acético debido al efecto inductivo del grupo metileno. Esto hace que el ácido propiónico sea más susceptible al ataque de las soluciones alcalinas de permanganato en comparación con el ácido acético. El proceso de degradación no es selectivo, lo que da como resultado una mezcla de dióxido de carbono, ácido oxálico y ácido láctico.
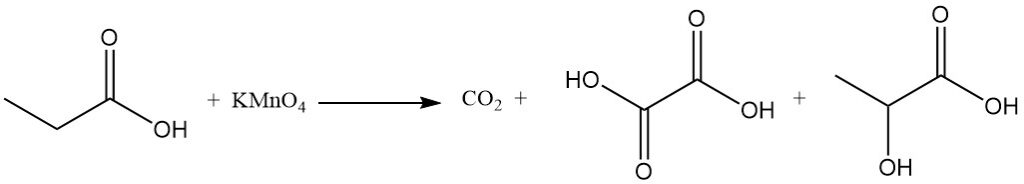
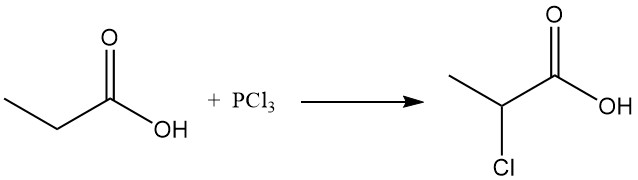
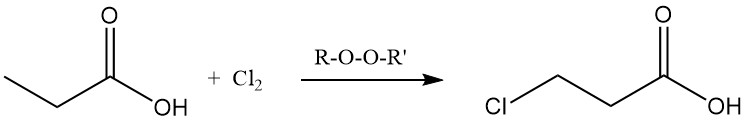
Las reacciones de sustitución iónica también muestran una preferencia por el grupo metileno. La cloración con reactivos de transferencia de halógeno, como PCl3, conduce a la formación de ácido α-cloropropiónico, mientras que la cloración radical inducida por peróxidos o radiación UV produce ácido β-cloropropiónico. Ambos productos se utilizan como intermediarios en la producción de herbicidas y productos farmacéuticos.
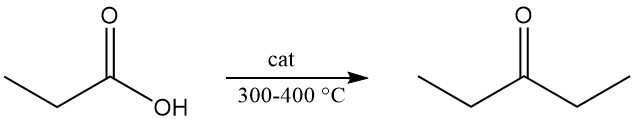
La descomposición térmica del vapor de propionato de calcio o ácido propiónico que pasa sobre óxidos metálicos a 300–400 °C produce dietilcetona, un disolvente industrial ampliamente utilizado.
3. Producción industrial de ácido propiónico
El ácido propiónico se produce industrialmente mediante la carbonilación de etileno o la oxidación de propanal.
También se puede producir como subproducto de la síntesis de sal de hidroxilamina a partir de 1-nitropropano, de la destilación de madera, por oxidación de 1-propanol con ácido nítrico, por fusión alcalina de mezclas de n-propanol e isopropanol, y por carbonilación de etanol y ácido acético. Sin embargo, todos estos métodos están obsoletos.
Otras fuentes potenciales, pero económicamente no viables, de ácido propiónico incluyen:
- Formación de subproductos: el ácido propiónico se puede formar como subproducto durante procesos como la carbonilación del metanol y la oxidación del n-buteno, pero el rendimiento es relativamente bajo.
- Reacción directa del etileno: la reacción directa del etileno, el monóxido de carbono y el agua sobre catalizadores específicos tiene potencial, pero aún no es competitiva.
- Procesos C1: se han descrito reacciones de dos pasos que utilizan gas de síntesis y catalizadores de rodio para la producción de ácido propiónico, pero la disponibilidad actual de recursos los hace menos atractivos.
Para aplicaciones que requieren ácido propiónico «natural», particularmente en sabores y fragancias, se han desarrollado procesos microbiológicos y enzimáticos basados en la fermentación de almidón o azúcares. Sin embargo, el alto costo de producción limita su uso a aplicaciones especializadas.
3.1. Producción de ácido propiónico por carbonilación de etileno (proceso BASF)
El proceso BASF para la producción de ácido propiónico utiliza la síntesis de Reppe. Esta reacción implica la reacción de etileno con monóxido de carbono y agua a alta presión, utilizando Ni(CO)4 como catalizador.
C2H4 + CO + H2O → CH3CH2COOH
Este proceso ofrece varias ventajas, como bajos costos de materia prima, alta conversión y rendimiento de ácido propiónico y un procedimiento de procesamiento simple.
En la Figura 1 se muestra una descripción simple del proceso industrial.
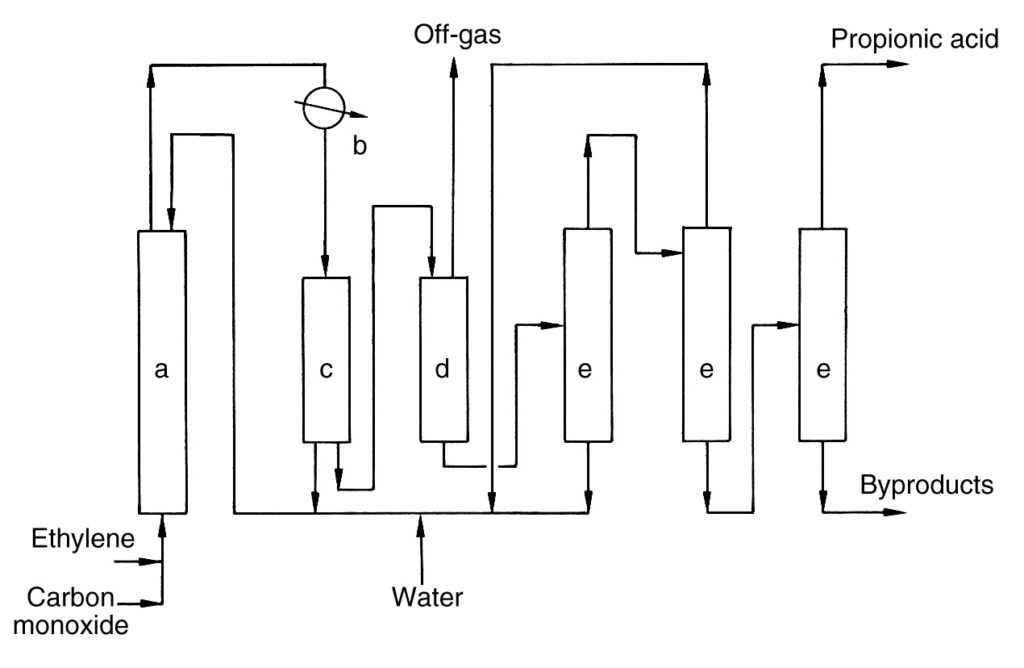
a) Reactor de alta presión; b) Intercambiador de calor; c) Separador; d) Vaso de expansión; e) Columna de destilación
El etileno y el monóxido de carbono se comprimen y se introducen continuamente junto con una corriente de reciclado en el reactor de alta presión (a). La reacción se lleva a cabo a 100–300 bar y 250–320 °C. Se forma ácido propiónico crudo y se retira de la cabeza del reactor.
El producto crudo se enfría en un intercambiador de calor (b), lo que genera vapor. Una parte del producto enfriado se recicla al reactor (c) para controlar la temperatura, mientras que la corriente principal se despresuriza (d).
La corriente despresurizada se separa en una corriente de gas de escape y una corriente de ácido crudo. El catalizador de níquel se recupera del gas de escape y se recicla de nuevo al reactor. El gas de escape se incinera con recuperación de calor.
El ácido crudo se deshidrata y se purifica aún más mediante múltiples columnas de destilación (e). Las sales de níquel formadas durante el proceso se reciclan. La destilación final produce ácido propiónico puro y el residuo del producto se elimina del proceso.
Se informa que el ácido bórico mejora la velocidad de reacción y evita la precipitación de la sal del catalizador.
3.2. Producción de ácido propiónico por oxidación de propanal
El ácido propiónico se produce comercialmente por oxidación de propanal. Este proceso implica dos pasos: producción de propanal y carbonilación catalizada.
El propanal se forma como un intermedio durante la producción de n-propanol a través de la hidroformilación de etileno. A diferencia de los aldehídos superiores, no se forman mezclas de isómeros n/iso. Se produce industrialmente por carbonilación catalizada por cobalto a alta presión o por carbonilación catalizada por rodio/iridio a baja presión.
El propanal obtenido fácilmente se oxida luego selectivamente a ácido propiónico en condiciones suaves (40–50 °C).
Este método de dos pasos garantiza el uso de plantas existentes tanto para la producción de propanal como para la oxidación posterior. Empresas como Dow (anteriormente Union Carbide) y Eastman en los Estados Unidos emplean este método para la producción de ácido propiónico.
3.3. Producción de ácido propiónico por oxidación directa de hidrocarburos
Históricamente, una parte significativa del ácido propiónico se producía mediante la oxidación directa de hidrocarburos, principalmente nafta. Este proceso, utilizado principalmente para la producción de ácido acético, también generaba ácido fórmico, ácido propiónico, una mezcla de isómeros de ácido butírico y butanona como subproductos.
Si bien este método ofrecía ventajas en términos de costo de materia prima, el proceso presentaba desafíos significativos:
- Mezcla compleja de productos: el proceso de oxidación generó una mezcla compleja de varios ácidos orgánicos, lo que requirió un proceso de separación sofisticado y costoso.
- Control limitado del producto: las condiciones de reacción ofrecían un control mínimo sobre las proporciones específicas de los productos formados, lo que dificultaba la adaptación a las demandas fluctuantes del mercado.
- Alto consumo de energía: el proceso de separación asociado con esta tecnología genera un alto consumo de energía.
Estos inconvenientes finalmente llevaron al abandono total de esta tecnología. En 2009, todas las plantas operativas que utilizaban este proceso habían sido cerradas, siendo la última la planta de Celanese en Pampa, Texas.
Se proporciona una descripción del proceso de BP Chemicals (Figura 2), un ejemplo histórico de oxidación directa de hidrocarburos, a modo de referencia.
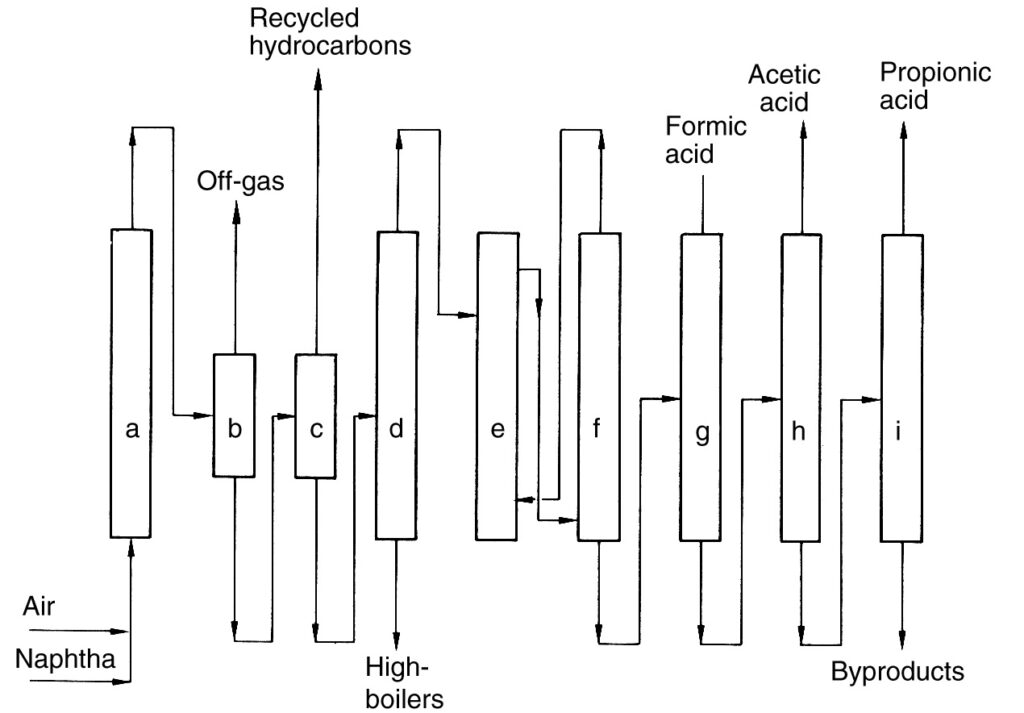
a) Reactor; b) Separador gas-líquido; c) Separador líquido-líquido; d) Columna de destilación; e) Extracción; f) Separación del agente de extracción; g) Destilación de ácido fórmico; h) Destilación de ácido acético; i) Destilación de ácido propiónico
En este proceso, la nafta se precalentó y luego se oxidó con aire a presión elevada (40–45 bar) dentro de una serie de reactores (a). La reacción generó calor, que se utilizó para la producción de vapor.
El efluente del reactor enfriado se separó del gas de salida de la reacción en un separador (b). El líquido recuperado se recicló de nuevo a los reactores, mientras que el gas de salida se incineró. El producto líquido restante se separó luego en una fase orgánica (hidrocarburos sin reaccionar) y una fase acuosa que contenía la mezcla de productos (c). Los hidrocarburos sin reaccionar se reciclaron.
La fase acuosa se sometió a la separación de componentes de bajo y alto punto de ebullición, seguida de una deshidratación por extracción (e) para obtener el ácido crudo. Finalmente, se utilizaron los pasos de destilación fraccionada (g)–(i) para aislar los ácidos carboxílicos C1 a C4.
3.4. Producción de ácido propiónico por fermentación
Si bien los procesos petroquímicos dominan la producción industrial de ácido propiónico, la fermentación con especies de Propionibacterium ofrece una alternativa de base biológica. Estas bacterias grampositivas, inmóviles y con forma de bastón se reconocen generalmente como seguras (GRAS), lo que hace que el ácido propiónico resultante sea adecuado para aplicaciones como alimentos, piensos, productos farmacéuticos y cosméticos.
Las propionibacterias utilizan la vía del ácido dicarboxílico para convertir la glucosa (u otras fuentes de carbono) en ácido propiónico. Esta vía implica al piruvato como intermediario clave. El piruvato puede carboxilarse a oxaloacetato, lo que conduce a la biosíntesis de ácido propiónico, o descarboxilarse a acetil-CoA, lo que conduce a la biosíntesis de ácido acético.
La coproducción de ácidos propiónico y acético mantiene el equilibrio redox.
En teoría, 1,5 moles de glucosa pueden producir 2 moles de propionato, 1 mol de acetato y 1 mol de CO2 a través de la vía de Embden-Meyerhof-Parnas (EMP). Esto se traduce en un rendimiento máximo de ácido propiónico de 0,548 g/g de glucosa y una relación ácido propiónico/ácido acético de 2.
La vía de las pentosas fosfato (HMP) puede generar mayores rendimientos de ácido propiónico (hasta 0,68 g/g) con una menor producción de ácido acético. El ácido succínico es un subproducto común en este proceso.
El rendimiento real de ácido propiónico depende en gran medida del sustrato elegido y de las condiciones de fermentación.
La fermentación del ácido propiónico normalmente se produce en condiciones anaeróbicas (purgadas con gas nitrógeno) a 30–32 °C y pH 6,0–7,0. El medio de fermentación requiere tamponamiento (p. ej., CaCO3) o adición de base (p. ej., hidróxido de amonio) para neutralizar los ácidos producidos, ya que el crecimiento de las propionibacterias cesa por debajo del pH 4,5.
El medio normalmente incluye una fuente de carbono (p. ej., glucosa), una fuente de nitrógeno (p. ej., amoníaco), minerales y vitaminas. Las propionibacterias pueden utilizar diversas fuentes de carbono, como azúcares, lactato, glicerol y sorbitol.
Los procesos industriales suelen emplear materias primas de bajo coste, como el permeado de suero, la melaza o el glicerol de desecho de biodiésel, complementados con fuentes de nitrógeno, como el extracto de levadura.
El ácido propiónico actúa por sí mismo como inhibidor de la fermentación, reduciendo el crecimiento y las tasas de producción en concentraciones superiores a 10 g/L. Los procesos de fermentación convencionales suelen tardar 3 días en alcanzar unos 20 g/L de ácido propiónico con un rendimiento de 0,4 g/g de glucosa o menos.
Se han realizado numerosas investigaciones para mejorar el rendimiento, la concentración y la tasa de producción mediante el desarrollo de cepas y la optimización de procesos.
4. Usos del ácido propiónico
4.1. Usos del ácido propiónico como conservante de alimentos y piensos
El ácido propiónico y sus sales (propionatos) se utilizan ampliamente como conservantes debido a su capacidad para inhibir bacterias, hongos, insectos, virus y ácaros.
El mecanismo de acción exacto aún se encuentra bajo investigación, pero se cree que la forma no disociada del ácido propiónico (dominante en pH ácido) es responsable del efecto conservante. Esta forma penetra en las células como un nutriente y altera las enzimas esenciales del metabolismo de los carbohidratos.
Los propionatos requieren hidrólisis para liberar la forma ácida activa, lo que los hace más lentos y menos efectivos que el propio ácido propiónico.
El ácido propiónico muestra un amplio espectro de actividad contra varios microorganismos, con una concentración mínima inhibitoria (CMI) de 0,05-0,50 % en peso contra hongos, 0,25-0,50 % en peso contra bacterias y 0,10-1,0 % en peso contra levaduras.
Es eficaz contra los mohos que producen descomposición en alimentos y piensos y más eficaz contra las bacterias gramnegativas (p. ej., E. coli, Salmonella). También inactiva virus como el virus Vaccinia en concentraciones superiores al 1,0 % en peso y mata ácaros y escarabajos del maíz en cereales.
El ácido propiónico tiene un olor fuerte, lo que limita su uso en la conservación de alimentos. Los propionatos (sales de calcio, sodio y amonio) son los preferidos en los alimentos debido a su sabor y olor casi neutros.
Ambas formas se utilizan en la conservación de alimentos, y los animales suelen preferir el sabor ácido de los alimentos conservados con ácido propiónico.
El ácido propiónico y sus sales se reconocen generalmente como seguros (GRAS) para diversas aplicaciones alimentarias en los EE. UU. y Europa. La FAO/OMS no tiene limitaciones específicas sobre su ingesta diaria.
4.2. Otros usos
El ácido propiónico se utiliza en otras industrias, como la del caucho, los polímeros, los disolventes, los sabores, las fragancias, los productos farmacéuticos y los herbicidas.
Los propionatos de zinc, cadmio, plomo y mercurio se pueden utilizar como reguladores de la vulcanización, influyendo en el proceso de fortalecimiento del caucho durante la producción.
El ácido propiónico se utiliza como intermediario, a menudo en su forma anhídrida, para la producción de ésteres valiosos, como el acetato propionato de celulosa y el propionato de vinilo.
Los propionatos de metilo, etilo, propilo y butilo se utilizan como disolventes para resinas y pinturas, y varios ésteres de propionato poseen aromas frutales característicos, lo que los convierte en ingredientes valiosos en formulaciones de sabores y fragancias.
Pequeñas cantidades de ácido propiónico se convierten en cloruro de propionilo, una molécula reactiva que se utiliza para introducir el «grupo propionilo» durante la síntesis de ciertos productos farmacéuticos.
Hasta finales de la década de 1980, una parte significativa del ácido propiónico se utilizaba para producir herbicidas clorados. Sin embargo, el desarrollo de herbicidas más potentes y versátiles ha llevado a una disminución en esta aplicación.
5. Toxicología del ácido propiónico
El ácido propiónico muestra una baja toxicidad aguda y se metaboliza rápidamente en el cuerpo. Sin embargo, tiene efectos irritantes/corrosivos en la piel y los ojos. La exposición crónica a altas concentraciones puede causar cambios locales en el epitelio del estómago anterior de algunas especies animales.
El ácido propiónico, o su forma activada, propionil-CoA, es un intermediario natural en el metabolismo humano. Se absorbe y metaboliza fácilmente en el hígado.
El ácido propiónico tiene una baja toxicidad oral y por inhalación. Los propionatos de sodio y calcio son incluso menos tóxicos. El contacto con la piel puede causar irritación o corrosión.
La exposición prolongada a altas concentraciones (>0,4%) en ratas puede causar cambios en el revestimiento del estómago anterior. Sin embargo, los perros beagle, que carecen de estómago anterior, no mostraron estos efectos.
Los estudios no han demostrado ninguna evidencia de que el ácido propiónico o los propionatos causen mutaciones genéticas. Los estudios realizados en animales preñados no revelaron ninguna anomalía del desarrollo causada por la exposición al ácido propiónico.
Los estudios limitados realizados en humanos sugieren que el ácido propiónico se tolera bien por vía oral en dosis bajas. Las soluciones de propionato de sodio se han utilizado de forma segura para el tratamiento ocular.
Referencia
- Propionic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a22_223.pub4
