Ácido fórmico: propiedades, reacciones, producción y usos
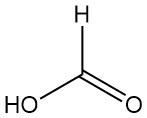
¿Qué es el ácido fórmico?
El ácido metanoico, más conocido como ácido fórmico, es el ácido carboxílico más simple con la fórmula HCOOH. Es un líquido incoloro, corrosivo y de olor penetrante, completamente miscible con agua y muchos solventes polares, pero solo parcialmente miscible con hidrocarburos.
El ácido fórmico deriva su nombre de las hormigas (del latín Formica), de las cuales se obtuvo por primera vez por destilación en seco. El primer estudio científico sobre sus propiedades, “Sobre algunas observaciones y experimentos poco comunes hechos con un jugo ácido que se encuentra en las hormigas”, se publicó ya en 1670.
Tabla de contenido
1. Propiedades físicas del ácido fórmico
El ácido fórmico es un líquido incoloro, transparente y corrosivo con un olor penetrante. Es el ácido carboxílico de alquilo no sustituido más fuerte.
La dependencia de la temperatura de la densidad del ácido fórmico se muestra en la Tabla 1.
| Temperatura, °C | Densidad, g/cm33 |
|---|---|
| 0 | 1,244 |
| 10 | 1,232 |
| 15 | 1,226 |
| 20 | 1,220 |
| 25 | 1,214 |
| 30 | 1.207 |
| 40 | 1.195 |
| 50 | 1.182 |
| 60 | 1.169 |
| 70 | 1.156 |
| 80 | 1.143 |
| 90 | 1.130 |
| 100 | 1,117 |
El ácido fórmico no aumenta de volumen cuando se solidifica y tiene tendencia a sufrir sobreenfriamiento.
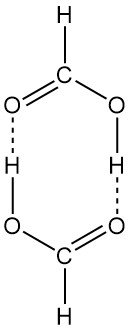
La Tabla 2 muestra la curva de presión de vapor del ácido fórmico puro. El vapor de ácido fórmico se desvía considerablemente del comportamiento de un gas ideal porque las moléculas se dimerizan parcialmente en la fase de vapor. A temperatura ambiente y presión normal, el 95% del vapor de ácido fórmico consiste en ácido fórmico dimerizado.
| Líquido | Sólido | ||
|---|---|---|---|
| Temperatura, °C | Presión (kPa) | Temperatura, °C | Presión (kPa) |
| -5,23 | 1,083 | -5,07 | 0,664 |
| 0,00 | 1,488 | 0,00 | 1,096 |
| 8,25 | 2,392 | 8,25 | 2,392 |
| 12,57 | 3,029 | - | - |
| 20,00 | 4,473 | - | - |
| 29,96 | 7,248 | - | - |
| 39,89 | 11,357 | - | - |
| 49,93 | 17,347 | - | - |
| 59,98 | 25,693 | - | - |
| 70,04 | 37,413 | - | - |
| 79,93 | 52,747 | - | - |
| 100,68 | 101,667 | - | - |
| 110,62 | 135,680 | - | - |
La entalpía de la dimerización en fase gaseosa es de -63,8 kJ/mol.
La estructura dimérica de tipo anillo existe tanto en fase de vapor como en solución. El ácido fórmico líquido está formado por largas cadenas de moléculas unidas entre sí por enlaces de hidrógeno. El ácido fórmico sólido también se puede aislar en dos formas polimórficas (α y β).
El ácido fórmico y el agua forman una mezcla azeotrópica de punto de ebullición máximo cuyo punto de ebullición es de 107,6 °C a 101,3 kPa; está formada por un 77,6 % en peso de ácido fórmico y un 22,4 % en peso de agua.
La variación de la viscosidad dinámica con la temperatura se muestra en la Tabla 3. La viscosidad dinámica de las mezclas de ácido fórmico y agua disminuye aproximadamente de forma lineal a medida que aumenta el contenido de agua del ácido fórmico. La conductividad térmica del ácido fórmico es notablemente superior a la de los líquidos comparables debido a su pronunciada polaridad.
| Temperatura, °C | Viscosidad, mPa.s |
|---|---|
| 10 | 2,262 |
| 20 | 1,804 |
| 30 | 1,465 |
| 40 | 1,224 |
| 50 | 1,025 |
Las propiedades físicas del ácido fórmico se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [64-18-6] |
| Fórmula | HCOOH |
| Peso molecular | 46,03 g/mol |
| Punto de fusión | 8,3 °C |
| Punto de ebullición | 100,8 °C |
| pKa | 3,74 |
| Calor de fusión | 276 J/g |
| Calor de vaporización (en el punto de ebullición) | 483 J/g |
| Constante dieléctrica |
Líquido (a 20 °C): 57,9 Sólido (a -10,1 °C): 11,7 |
| Índice de refracción | 1,37140 |
| Tensión superficial σ |
(a 20 °C): 37,67×10-3 N/m (a 40 °C): 35,48×10-3 N/m (a 60 °C): 33,28×10-3 N/m (a 80 °C): 31,09×10-3 N/m |
| Calor de formación |
Líquido (a 25 °C): -425,0 kJ/mol Vapor (a 25 °C, monómero): -378,57 kJ/mol (a 25 °C, dímero): -820,94 kJ/mol |
| Calor de combustión | Líquido (a 25 °C): -254,8 kJ/mol |
| Entropía |
Líquido (a 25 °C): 129,0 J K-1 mol-1 Vapor (a 25 °C, monómero): 248,88 J K-1 mol-1 (a 25 °C, dímero): 332,67 J K-1 mol-1 |
| Calor de neutralización | 56,9 kJ/mol |
2. Reacciones del ácido fórmico
Aunque el ácido fórmico es relativamente estable a temperatura ambiente, en realidad es un compuesto térmicamente inestable que tiene dos vías alternativas principales de descomposición: reacciones de deshidratación y deshidrogenación.
HCOOH → CO + H2O
HCOOH → CO2 + H2
La reacción de deshidratación, que predomina en la fase líquida, se ve favorecida en presencia de catalizadores de óxido o ácidos fuertes, mientras que la reacción de deshidrogenación se ve favorecida por catalizadores metálicos.
El ácido fórmico se vuelve particularmente inestable en concentraciones cercanas al 100%, y esto debe tenerse en cuenta al almacenar ácido fórmico altamente concentrado. En general, la descomposición del ácido fórmico es una función tanto de la concentración de ácido como de la temperatura.
El ácido fórmico exhibe muchas de las propiedades químicas típicas de los ácidos carboxílicos alifáticos, por ejemplo, esterificación y amidación, pero, como es común para el primer miembro de una serie homóloga, existen diferencias distintivas en las propiedades del ácido fórmico y sus homólogos superiores.
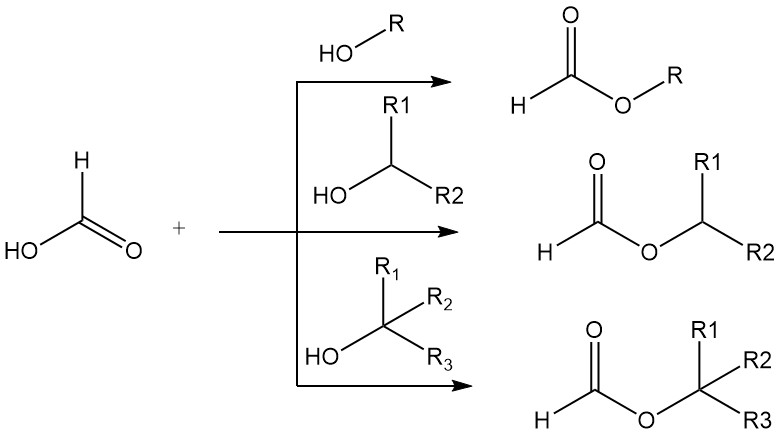
El ácido fórmico forma ésteres con alcoholes primarios, secundarios y terciarios. La alta acidez del ácido fórmico hace innecesario el uso de catalizadores de ácidos minerales en esterificaciones simples. Los alcoholes primarios y secundarios se esterifican en ácido fórmico puro entre 15 000 y 20 000 veces más rápido que en ácido acético puro.
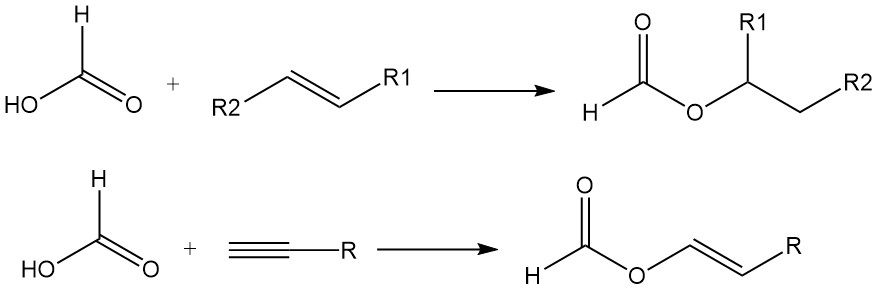
El ácido fórmico también se suma a los enlaces dobles de las olefinas para formar ésteres. Los acetilenos reaccionan con el ácido fórmico en la fase de vapor para producir formiatos de vinilo.
El ácido fórmico reacciona con la mayoría de las aminas para formar compuestos de formilamino. Por ejemplo, en la producción de formamidas, se utiliza ácido fórmico para lograr la formilación por deshidratación. Con ciertas diaminas, se produce la formación de imidazol. Ambos tipos de reacción tienen utilidad sintética.
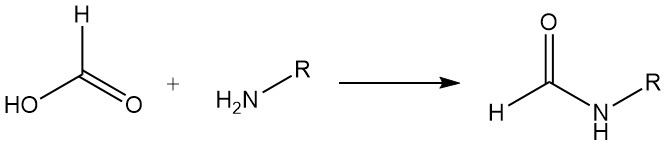
El ácido fórmico y las bases orgánicas terciarias forman compuestos de adición (proporciones de ácido fórmico a base de 3:1 y 2:1). Los compuestos de adición de ácido fórmico y trimetilamina o trietilamina se pueden utilizar como agentes reductores líquidos en muchas reducciones selectivas. La reducción del dióxido de azufre a azufre es aproximadamente cuantitativa.
El ácido fórmico disuelve el hierro y el zinc y corroe la mayoría de los tipos de acero. La reacción con el hierro produce formiato de Fe(II) y gas hidrógeno. Entre los metales y aleaciones comunes, el aluminio, el cobre y el níquel muestran cierta resistencia.
2 HCOOH + Fe → Fe(OOCH)2 + H2
El ácido fórmico es más corrosivo en soluciones relativamente diluidas en agua. En el caso del acero dulce, la tasa de corrosión más alta se observa alrededor de una concentración de solución del 20 %, en la que la conductividad de la solución también es la más alta. Algunos inhibidores de corrosión pueden proporcionar una muy buena protección.
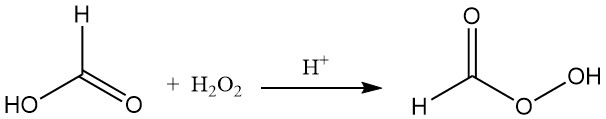
El ácido fórmico reacciona con peróxido de hidrógeno en presencia de un catalizador ácido para formar ácido perfórmico inestable (HCOOOH).
El átomo de hidrógeno formilo presenta cierto carácter aldehídico y el ácido fórmico reduce algunas sales y óxidos a metales. También puede utilizarse como agente reductor (donante de hidruros) en muchas reacciones orgánicas, reemplazando al H2.
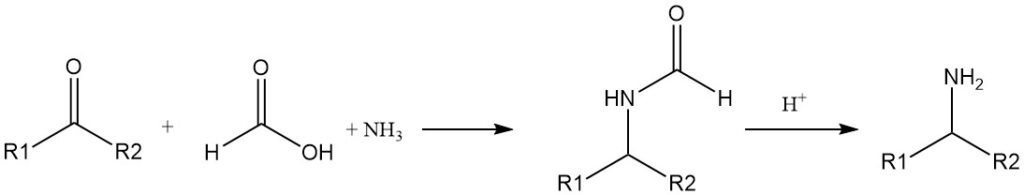
La reducción de iminas (bases de Schiff) mediante ácido fórmico se conoce desde hace mucho tiempo. Las aminas primarias pueden prepararse a partir de cetonas, amoníaco y ácido fórmico (reacción de Leuckart).
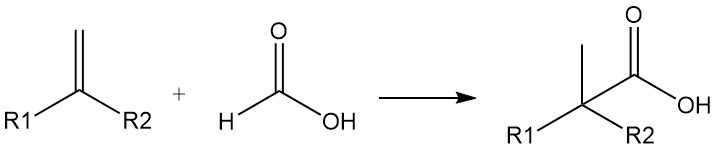
El ácido fórmico también se puede utilizar como fuente de monóxido de carbono. Se pueden preparar ácidos carboxílicos muy ramificados a partir de olefinas y ácido fórmico en presencia de ácido sulfúrico o fluorhídrico (síntesis de ácido carboxílico de Koch). La reacción se lleva a cabo mediante la adición de CO.
3. Producción de ácido fórmico
En la actualidad, el ácido fórmico se produce principalmente por dos vías: la hidrólisis del formiato de metilo y la preparación de ácido fórmico libre a partir de sales de formiato.
Actualmente, el proceso basado en el formiato de metilo es el predominante. Aproximadamente el 90% de la capacidad instalada se basa en este proceso. Las desventajas económicas de los métodos practicados anteriormente llevaron al desarrollo de un proceso específicamente dedicado a la producción de ácido fórmico sin subproductos indeseables.
En la década de 1970, varias empresas desarrollaron comercialmente la hidrólisis del formiato de metilo para obtener metanol y ácido fórmico, convirtiéndola en un método económicamente viable.
Este proceso implica la carbonilación del metanol y la posterior hidrólisis del formiato de metilo producido. El metanol resultante de este proceso se devuelve a la primera etapa.
En 1981, BASF (Alemania) y Kemira (Finlandia) pusieron en funcionamiento plantas de ácido fórmico basadas en este proceso. Otros productores a gran escala que utilizan esta vía son las empresas chinas Feicheng Acid Chemicals y Luxi Chemical Group.
El otro método de producción actual implica la formación de ácido libre a partir de sus sales. Para ello se utilizan principalmente formiato de sodio y formiato de calcio. La acidólisis se lleva a cabo normalmente con ácido sulfúrico o ácido fosfórico. Como subproductos se producen sales de sulfato o fosfato.
3.1. Producción de ácido fórmico por hidrólisis de formiato de metilo
El método teóricamente más simple posible para producir ácido fórmico es la reacción del monóxido de carbono con agua. Por debajo de 150 °C, la reacción es muy lenta y, aunque el equilibrio se alcanza rápidamente a temperaturas más altas, es necesario aumentar la presión para obtener concentraciones aceptables de ácido fórmico.
CO + H2O → HCOOH
Los obstáculos termodinámicos pueden superarse si se forma formiato de metilo como intermediario.
La carbonilación en fase líquida del metanol a formiato de metilo en presencia de un catalizador básico como el metóxido de sodio o potasio (NaOCH3 o KOCH3) y la posterior hidrólisis a ácido fórmico se han practicado industrialmente desde principios de los años 1980.
El metóxido de potasio es más soluble en formiato de metilo que el metóxido de sodio y, en consecuencia, tiene una mayor velocidad de reacción. El metanol liberado en la segunda etapa se devuelve a la primera etapa.
CH3OH + CO → HCOOCH3
HCOOCH3 + H2O → HCOOH + CH3OH
El proceso de formiato de metilo se utiliza, por ejemplo, en Eastman Chemical Company, BASF, Kemira, Luxi Chemical Group y Feicheng Acid Chemicals.
Las condiciones de reacción para el paso de carbonilación de la primera etapa son muy similares en cada una de ellas, pero difieren en su enfoque de la etapa de hidrólisis.
3.1.1. Carbonilación
Según los datos publicados, las condiciones de reacción típicas parecen ser 80 °C, 4,5 MPa de presión y 2,5 % en peso de catalizador de metóxido de sodio. En estas condiciones, la conversión de metanol es de alrededor del 30 % y la conversión de monóxido de carbono es de alrededor del 95 %.
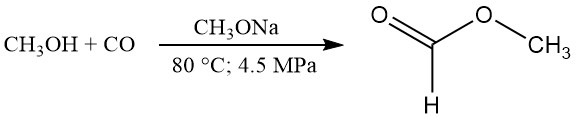
La conversión casi cuantitativa del metanol en formiato de metilo se puede lograr reciclando el metanol no convertido. La tasa de carbonilación se puede aumentar aumentando la temperatura, la presión parcial de CO, la concentración del catalizador o la interfase entre las fases gaseosa y líquida.
Como reacción secundaria, el catalizador produce sales de formiato (Na y K). Las sales de formiato son menos solubles en formiato de metilo que en metanol. Por lo tanto, se debe controlar el riesgo de incrustación y bloqueo debido a la precipitación del catalizador.
El monóxido de carbono no debe contener una cantidad significativa de dióxido de carbono; de lo contrario, se precipita el carbonato catalíticamente inactivo.
El metóxido de metal alcalino no descompuesto en el formiato de metilo se debe neutralizar para evitar la reacción inversa, es decir, la descomposición del formiato de metilo en metanol y CO cuando se calienta.
3.1.2. Hidrólisis
El equilibrio de hidrólisis del formiato de metilo es relativamente desfavorable, pero depende de la concentración de agua de una manera que favorece el uso de un exceso estequiométrico elevado de agua, con los consiguientes problemas para encontrar un método energéticamente eficiente para eliminar el exceso de agua.
El ácido fórmico actúa como catalizador de la hidrólisis (autocatálisis). Una forma de superar la posición desfavorable del equilibrio de hidrólisis es hidrolizar el formiato de metilo en presencia de un aditivo, por ejemplo, una amina terciaria.
La base forma un aducto similar a una sal con el ácido fórmico; por lo tanto, la concentración de ácido fórmico libre disminuye y el equilibrio de hidrólisis se desplaza en la dirección de los productos. En un paso posterior, el ácido fórmico se puede destilar de la base sin descomposición.
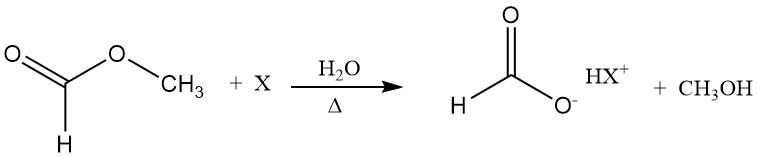
3.2. Producción de ácido fórmico a partir de formiatos
La reacción de sales de formiato con ácidos minerales (normalmente ácido sulfúrico) es el proceso comercial más antiguo para la producción de ácido fórmico y todavía tiene importancia industrial. Perstorp es el mayor productor de ácido fórmico mediante la acidólisis de sales de formiato.
El formiato de sodio, el formiato de potasio y el formiato de calcio están disponibles industrialmente a partir de la producción de alcoholes polihídricos.
La acidólisis de sales de formiato es técnicamente sencilla, pero la inevitable producción de sales de coproductos como el sulfato de sodio y de calcio es una clara desventaja de esta ruta.
2 HCOONa + H2SO4 → 2 HCOOH + Na2SO4
(HCOO)2Ca + H2SO4 → 2 HCOOH + CaSO4
Algunas patentes chinas describen la preparación de ácido fórmico a partir de CO e hidróxidos de metales alcalinos o alcalinotérreos, seguida de acidificación con ácido fosfórico. El monóxido de carbono puede provenir de la producción de fósforo. Las sales de fosfato resultantes se utilizan como fertilizantes.
3.2.1. Los formiatos como subproductos de polioles
Las sales de formiato se producen como subproductos en la producción de pentaeritritol, trimetilolpropano y 2,2-dimetil-1,3-propanodiol (neopentilglicol).
Por ejemplo, el pentaeritritol se produce por la reacción de formaldehído con acetaldehído en un medio alcalino acuoso. El aldehído intermedio reacciona posteriormente con el formaldehído mediante la reacción de Cannizzaro para producir pentaeritritol y ácido fórmico.
El ácido fórmico formado reacciona inmediatamente con el álcali presente, dando la sal de formiato correspondiente como coproducto final.
3 HCHO + CH3CHO → (HOCH2)3CCHO
(HOCH2)3CCHO + HCHO + H2O → C(CH2OH)4 + HCOOH
HCOOH + NaOH → HCOONa + H2O
2 HCOOH + Ca(OH)2 → (HCOO)2Ca + 2 H2O
Además, el exceso de álcali en el proceso se neutraliza con ácido fórmico. El producto de pentaeritritol se aísla mediante concentración gradual y cristalización fraccionada.
3.2.2. Formiatos a partir de monóxido de carbono
Las sales de formiato se pueden obtener mediante un proceso directo basado en la reacción del CO con una base como NaOH y KOH.
NaOH (aq) + CO → HCOONa (aq)
KOH (aq) + CO → HCOOK (aq)
3.3. Producción de ácido fórmico a partir de dióxido de carbono
La hidrogenación de dióxido de carbono en alcohol produce ácido fórmico en un entorno casi libre de agua, lo que supone una ventaja en la recuperación del producto. Los complejos de Ru solubles son los catalizadores preferidos y se utiliza un agente complejante para que la reacción sea termodinámicamente favorable.
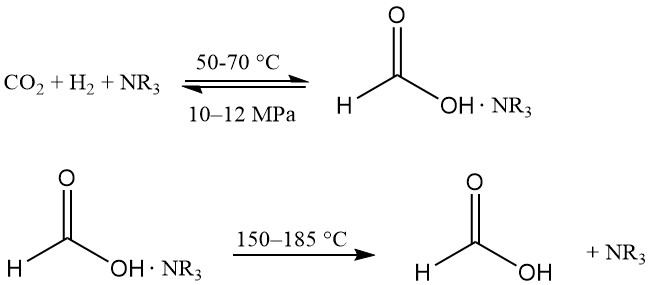
Esta tecnología fue introducida por primera vez por BP Chemicals en la década de 1980 y ha sido desarrollada por BASF.
La reacción tiene lugar en una mezcla de amina terciaria (normalmente n-trihexilamina) y alcohol (p. ej., metanol) a 50–70 °C y 10–12 MPa. Se añade un poco de agua para facilitar la separación de fases. El complejo de ácido fórmico-amina se disocia térmicamente a 150–185 °C.
El proceso debe mantener activo el costoso catalizador de complejo de metal de transición, pero evitar incluso trazas de este en forma activa en la destilación del ácido fórmico, ya que puede catalizar la descomposición del ácido. Los posibles residuos del catalizador se pueden inactivar de forma reversible con CO.
Se están desarrollando varios procesos electroquímicos para la producción de ácido fórmico o sal de formato a partir de dióxido de carbono. El proceso de electrólisis de CO2 consiste básicamente en hacer funcionar una pila de combustible en sentido inverso. En un electrolizador, el CO2 se reduce en el cátodo, mientras que la reacción de evolución del oxígeno tiene lugar en el ánodo.
En los últimos años, las grandes mejoras en los sistemas de catalizadores y electrodos han dado como resultado rendimientos mucho mayores, eficiencias farádicas y eficiencias de combustible.
3.4. Producción de ácido fórmico a partir de biomasa
Prácticamente cualquier biomasa vegetal se puede oxidar a ácido fórmico, CO2 y agua con alta selectividad al ácido fórmico mediante el uso de polioxometalatos como catalizadores que suministran oxígeno.
La hidrólisis ácida mineral de celulosa y hemicelulosa alrededor de 200 °C produce una mezcla de ácido levulínico, ácido fórmico y furfural. La reacción total de azúcares C6 a ácido levulínico y ácido fórmico se muestra en el Esquema 1.
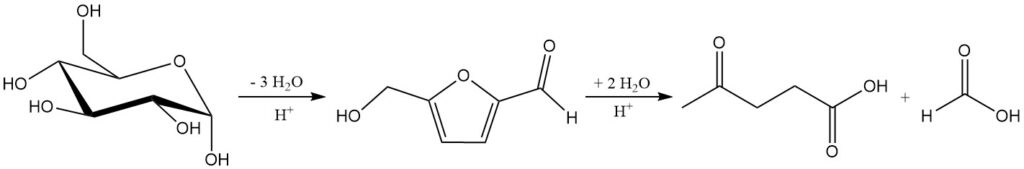
3.5. Recuperación de ácido fórmico
3.5.1. Destilación azeotrópica
Las mezclas de ácido fórmico y agua no se pueden concentrar a una concentración mayor que la composición azeotrópica mediante una simple destilación. La concentración de ácido fórmico en la mezcla azeotrópica aumenta si la destilación se lleva a cabo bajo presión, pero el punto de ebullición más alto a alta presión también aumenta la velocidad de descomposición del ácido fórmico.
Una combinación de destilación bajo presión seguida de destilación al vacío puede producir prácticamente todas las concentraciones deseadas.
3.5.2. Extracción
Se han desarrollado varias tecnologías en las que se utiliza la extracción reactiva para transferir el ácido fórmico a una fase orgánica separada o el ácido fórmico se une a un agente complejante débil en la fase acuosa. En ambos casos, se puede evitar el azeótropo.
Cuando hay separación de fases, es posible reducir la cantidad total de agua que se necesita evaporar. Por lo general, se utilizan amidas secundarias o aminas terciarias.
En la destilación extractiva, el ácido fórmico se extrae en una columna de destilación mediante un agente de extracción básico introducido en contracorriente y que se introduce en el fondo de la columna. Si esta mezcla se calienta en una columna situada aguas abajo, el ácido fórmico se libera del aducto salino y se destila.
4. Usos del ácido fórmico
Debido a su acidez, naturaleza aldehídica y propiedades reductoras, el ácido fórmico se utiliza en una variedad de campos. A diferencia de los ácidos minerales, el ácido fórmico se evapora sin dejar ningún residuo. En Europa, la mayor parte del ácido fórmico se utiliza en la industria de piensos y como coadyuvante para ensilado.
4.1. Usos del ácido fórmico en la conservación de la biomasa
4.1.1. Ensilado
El término ensilado se refiere tradicionalmente al ensilado de cultivos forrajeros (principalmente pastos) para alimentar a los bovinos en las granjas. El consumo depende del clima; el ensilado a base de ácido fórmico es especialmente adecuado para condiciones húmedas. El norte de Europa es la principal zona de consumo.
El ensilado se basa en la fermentación en condiciones anaeróbicas, en la que el ácido láctico producido por las bacterias del ácido láctico preserva el ensilado. El ácido láctico reduce el pH y, por lo tanto, evita el crecimiento microbiano no deseado.
La adición de ácido fórmico da como resultado una rápida caída inicial del pH, lo que promueve el crecimiento de bacterias del ácido láctico y suprime el crecimiento de bacterias que producen compuestos indeseables como el ácido butírico. Cuando la caída del pH se potencia con ácido fórmico, se restringe la fermentación espontánea.
Las ventajas incluyen más azúcares residuales y proteínas. Se sabe que la restricción de la fermentación tiene un efecto positivo en la ingesta voluntaria en la alimentación de las vacas lecheras y, por lo tanto, mejora la producción de leche.
Los cultivos forrajeros, como la hierba, el maíz, el trébol y la alfalfa, se cortan, se trocean y luego se fermentan en silos o fardos cubiertos con una película hermética. El ácido fórmico es ideal para ensilar materiales difíciles de ensilar, especialmente plantas forrajeras húmedas o con bajo contenido de azúcar, que también pueden tener una gran capacidad de amortiguación.
El ácido fórmico también se utiliza para restringir la fermentación al ensilar granos prensados con alto contenido de humedad.
Los subproductos de la industria de alimentos y bebidas, como el puré usado de las cervecerías, se pueden conservar con soluciones de ácido fórmico para proporcionar alimentos para animales de larga duración.
El ácido fórmico se utiliza en diferentes formulaciones, a veces en mezclas con otros ácidos orgánicos de cadena corta como el ácido propiónico, y a menudo se amortigua con una sal de formato para una manipulación segura y una menor corrosión.
4.1.2. Biomasa animal
La biomasa animal también se puede conservar con ácido fórmico. El uso más importante es en el procesamiento de subproductos de la industria pesquera para producir ensilado de pescado. Las leyes ambientales suelen exigir un tratamiento adecuado de los despojos de pescado, y la producción de ensilado de pescado puede ser una solución económicamente viable.
El ensilado de pescado es un producto líquido rico en proteínas que se fabrica reduciendo el pH de las partes molidas del pescado con un conservante ácido. En estas condiciones, las enzimas de los órganos internos del pescado producen el producto final, de larga vida útil, en unos pocos días.
El ácido fórmico también permite la separación eficiente del aceite de pescado durante el proceso de ensilado. El ácido también actúa como un auxiliar de procesamiento al reducir la formación de gas microbiano («ebullición»). El ensilado de pescado se puede utilizar como alimento para peces y cerdos o como materia prima para harinas y aceites de pescado.
El ácido fórmico es el ácido preferido en esta aplicación, generalmente combinado con un antioxidante adecuado. La aplicación es un método estándar en los principales países productores de salmón, por ejemplo, Noruega, y se espera que gane más importancia a medida que se intensifique la acuicultura, especialmente en el este y el sudeste de Asia.
Los desechos de mataderos se pueden conservar de manera similar a los despojos de pescado con ácidos, generalmente mezclas de ácido fórmico y ácido láctico. Los productos son adecuados para animales de peletería y, con limitaciones, para alimentos para mascotas.
4.2. Usos del ácido fórmico en la industria del cuero
Uno de los mayores usuarios de ácido fórmico a nivel mundial es la industria del curtido. A medida que la industria del curtido se ha ido trasladando a países con menores costos, las cifras de crecimiento en Asia han sido muy altas, compensando la disminución en Europa y América del Norte.
China es el mayor productor de cuero, representando aproximadamente el 30% de la producción mundial.
El pretratamiento de las pieles las deja en un estado ligeramente alcalino, pero el curtido requiere condiciones ácidas. Por lo tanto, las pieles se tratan con ácido (normalmente ácido sulfúrico y fórmico) antes del curtido en un proceso llamado decapado.
Sin este acondicionamiento, los agentes curtientes se fijarían rápidamente en la superficie de la piel, mientras que su capa interna permanecería cruda.
El ácido sulfúrico reduce el pH del licor, mientras que el ácido fórmico es capaz de penetrar a través de las fibras de colágeno de forma rápida y homogénea. Asegura que el agente curtiente (normalmente sulfato de cromo básico) penetre en todo el espesor de la piel.
En el teñido de cuero, el ácido fórmico se utiliza como agente nivelador para ayudar a mover el tinte de un área del cuero a otra, lo que da como resultado una distribución del tinte más uniforme y suave.
4.3. Usos del ácido fórmico en textiles
En la industria textil, el ácido fórmico se utiliza como agente regulador del pH en el teñido de lana, nailon y otras fibras naturales y sintéticas con tintes ácidos y cromados. Además, el ácido fórmico se utiliza para neutralizar soluciones alcalinas y facilitar el enjuague durante el lavado.
Se espera que la mejora de los niveles de vida y el aumento de la producción de fibra, especialmente para los mercados de exportación, aumenten la demanda de ácido fórmico en el teñido y acabado de textiles en Asia.
4.4. Usos del ácido fórmico como aditivo alimentario
Los ácidos y sales orgánicos tienen una larga historia en la industria de los piensos, que los utiliza habitualmente como conservantes y para la acidificación de las dietas de los lechones. Desde 2006, cuando la UE prohibió los antibióticos promotores del crecimiento (AGP), el uso de ácidos orgánicos en los piensos ha aumentado.
El ácido fórmico tiene un fuerte efecto acidificante, pero también efectos antimicrobianos, que se utilizan para proteger los piensos y el agua potable contra la contaminación bacteriana. El ácido fórmico es muy eficaz contra Salmonella, Escherichia coli y Campylobacter a un pH de 4,0.
Actúa positivamente sobre la flora intestinal de los animales y puede mejorar tanto la digestibilidad aparente de la energía y las proteínas como la absorción y retención de algunos minerales. Parece mejorar el rendimiento del crecimiento de los lechones destetados y los cerdos de engorde en dosis más bajas que otros ácidos y sales orgánicos.
En la industria avícola, el ácido fórmico se ha utilizado durante mucho tiempo para prevenir el crecimiento de patógenos en los piensos y las materias primas. Las mezclas de ácido fórmico con ácido propiónico, ácido láctico o ácidos grasos de cadena media tienen efectos antimicrobianos más amplios que el ácido fórmico solo.
4.5. Usos del ácido fórmico en productos farmacéuticos y aditivos alimentarios
Se ha estimado que los productos farmacéuticos y los productos químicos alimentarios son el sector individual más grande de uso de ácido fórmico en Asia (principalmente en China).
El ácido fórmico se utiliza como intermediario sintético para varios productos farmacéuticos y productos químicos alimentarios, incluida la insulina sintética (purificación de insulina recombinante), la cafeína, el aspartamo y la vitamina B1. También se usa ampliamente para ajustar el pH durante la fabricación de varios productos químicos.
Otras aplicaciones en los alimentos incluyen la descontaminación de Salmonella y el uso como conservante (E236, permitido en los EE. UU. pero no en la UE, Australia y Nueva Zelanda) y como agente aromatizante.
El uso de ácido fórmico en la conservación de alimentos incluye la fumigación de frutas como manzanas y cerezas para reducir la descomposición poscosecha. El ácido fórmico es especialmente eficaz para destruir esporas de hongos en superficies y recipientes en los que se almacenan frutas.
En algunas aplicaciones de conservación de alimentos, el ácido fórmico se mezcla con ácido láctico y/o propiónico. La mezcla es mínimamente corrosiva, pero debido a su bajo pH, ayuda a destruir microorganismos dañinos y evita su propagación, prolongando así la vida útil del producto.
4.6. Otros usos
4.6.1. Coagulación del caucho
El ácido fórmico es la opción preferida para coagular el látex, que es una suspensión de partículas microscópicas de caucho natural (poliisopreno) en un medio acuoso. Las superficies de las partículas de látex están cargadas, lo que crea repulsión entre ellas, impidiendo la coagulación.
En el proceso de coagulación, el ácido fórmico neutraliza estas cargas, eliminando la repulsión. El proceso da como resultado un producto de caucho natural consistente y de alta calidad. El uso de ácidos más fuertes hace que el pH baje demasiado rápido y de manera no homogénea. Como resultado, el látex se coagula de manera desigual, lo que puede afectar sus propiedades mecánicas.
Los ácidos más débiles, como el ácido acético, son menos eficientes que el ácido fórmico y dan como resultado un consumo de ácido mucho mayor.
4.6.2. Desulfurización de gases
El ácido fórmico se utiliza como catalizador de desulfurización en la desulfuración de gases de combustión para centrales eléctricas de carbón. El azufre, cuyo contenido en el carbón puede ser tan alto como el 5%, se libera como dióxido de azufre en el proceso de combustión.
La captura de dióxido de azufre al pasar el gas de combustión a través de una suspensión acuosa de piedra caliza da como resultado yeso (sulfato de calcio). La adición de ácido fórmico al ciclo de desulfurización aumenta la eficiencia de la separación del azufre.
4.6.3. Acidificadores de pozos
El ácido fórmico se utiliza en la estimulación de pozos de alta temperatura en yacimientos de petróleo y gas cuando los sistemas convencionales de ácido clorhídrico (HCl) no se pueden inhibir adecuadamente.
La acidificación de pozos se logra bombeando ácido en el pozo para disolver la piedra caliza, la dolomita y el cemento de calcita entre los granos de sedimento de las rocas del yacimiento.
El ácido fórmico tiene la ventaja de una buena inhibición contra la corrosión de las tuberías a temperaturas de hasta 200 °C (posiblemente causada por una capa protectora de productos de descomposición).
La mezcla de HCl y ácido fórmico puede ofrecer más ventajas. El ácido fórmico no se disocia en presencia de HCl, por lo que no hay reacción con el carbonato hasta que el HCl está prácticamente agotado. Las mezclas de HCl/fórmico pueden lograr así una mayor penetración.
4.6.4. El ácido fórmico como fuente de hidrógeno y monóxido de carbono
En condiciones de hidrólisis, el ion formiato puede formar un ion bicarbonato e hidrógeno.
HCO2– + H2O → HCO3– + H2
Se ha descubierto que tanto el paladio como el carbón son catalizadores activos.
La reacción de deshidrogenación es promovida por catalizadores metálicos.
HCOOH → CO2 + H2
Ha habido un creciente interés en la generación de hidrógeno a base de ácido fórmico o formiato de potasio en celdas de combustible. Los largos tiempos de funcionamiento y la recarga instantánea sin depender de la toma eléctrica son las ventajas cuando se aplica en dispositivos portátiles.
La descomposición del ácido fórmico en presencia de ácidos fuertes como el ácido sulfúrico es una fuente limpia de CO para la química basada en el monóxido de carbono.
El ácido fórmico o sus sales se pueden utilizar como fuente de hidrógeno en reacciones químicas sin la formación de H2 como intermediario (mecanismo de reacción de Leuckart). La reacción, conocida como hidrogenación por transferencia, es selectiva y está catalizada por muchos metales, incluso polvo de zinc.
Cuando se utilizan complejos de catalizadores quirales, el ácido fórmico puede servir como fuente de hidrógeno en la hidrogenación asimétrica, un paso de reacción común en la síntesis de muchos productos químicos finos y farmacéuticos.
4.6.5. Agentes de limpieza
El ácido fórmico tiene cierto uso como ingrediente activo en productos de limpieza comerciales, como desincrustantes, eliminadores de óxido, limpiadores y desengrasantes multiusos y productos de lavandería institucionales. En la desincrustación, la sal de calcio se forma cuando el carbonato de calcio se disuelve con un ácido.
Cuanto más soluble sea esta sal, menor será el riesgo de depósitos de sal que reduzcan la eficacia del ácido. En los limpiadores de baño, se afirma que combina las propiedades de un agente desincrustante eficaz con las de un biocida biodegradable.
4.6.6. Uso como disolvente
El ácido fórmico se puede utilizar para disolver poliamidas (p. ej., nailon 66 y nailon 46) o seda para preparar fibras y membranas. También es un componente útil en soluciones de limpieza de semiconductores.
5. Toxicología del ácido fórmico
El ácido fórmico presenta una variedad de efectos tóxicos según la vía de exposición (inhalación, ingestión o contacto dérmico) y la concentración.
Toxicidad aguda:
- Piel y membranas mucosas: el ácido fórmico es corrosivo y puede causar necrosis (muerte del tejido) al entrar en contacto con la piel e irritación/corrosión de las membranas mucosas en el punto de entrada (ojos, boca, fosas nasales).
- Ingestión: el metabolismo del metanol puede generar niveles tóxicos de ácido fórmico, lo que lleva a una acidosis metabólica. La ingestión oral de soluciones de ácido fórmico puede causar irritación grave y corrosión del tracto gastrointestinal.
- Inhalación: la inhalación de vapores de ácido fórmico irrita el sistema respiratorio, y la gravedad aumenta con la concentración. Las concentraciones altas pueden ser fatales.
- Absorción dérmica: el ácido fórmico se puede absorber fácilmente a través de la piel, lo que produce efectos sistémicos.
Se informa que la LD50 después de la administración oral es de 730 mg/kg en ratas.
En ratas, la LC50 es de 7,85 mg/L después de 4 horas de inhalación del vapor. Los síntomas predominantes de la ingesta por inhalación son irritación de los ojos, irritación y corrosión de las membranas mucosas nasales y opacidad corneal.
En conejos, la administración intravenosa de ácido fórmico tamponado en el rango de 0,46 a 1,25 g por kilogramo de peso corporal produce depresión del SNC; dosis más altas causan convulsiones. Dosis subcutáneas de 0,8 g/kg en perros y más de 0,4 g/kg en gatos provocan tambaleo, mientras que una dosis de 0,4 g/kg provoca somnolencia en gatos.
En perros, dosis letales administradas por vía intravenosa provocan convulsiones tónicas y clónicas.
La exposición crónica al ácido fórmico en concentraciones bajas en estudios con animales no mostró efectos significativos en el peso corporal o el peso de los órganos. Sin embargo, puede disminuir los niveles de glutatión en el hígado y los riñones.
El ácido fórmico no ha demostrado potencial genotóxico en varios ensayos in vitro e in vivo. Sin embargo, algunos estudios sugieren un efecto de confusión del pH bajo en concentraciones altas, lo que requiere una mayor investigación.
Referencia
- Ácido fórmico, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/14356007.a12_013.pub3
