Ácido fluorosulfúrico: propiedades, producción y usos
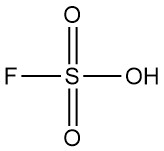
¿Qué es el ácido fluorosulfúrico?
El ácido fluorosulfúrico es un compuesto inorgánico con la fórmula química HSO3F. Es un líquido incoloro a amarillo pálido con un olor picante que se evapora fácilmente en el aire húmedo. Se reconoce como uno de los ácidos más fuertes disponibles comercialmente.
El enlace flúor-azufre es más fuerte que el del ácido clorosulfúrico, por lo que, como resultado, el ácido fluorosulfúrico se hidroliza más lentamente que el ácido clorosulfúrico. En condiciones óptimas, es posible la síntesis de sales de ácido fluorosulfúrico en una solución acuosa.
El ácido fluorosulfúrico se mencionó inicialmente en 1892, junto con un método sintético que utiliza fluoruro de hidrógeno y trióxido de azufre, que sigue siendo el proceso de producción preferido.
Históricamente, el ácido fluorosulfúrico se ha utilizado en reacciones de fluoración y como catalizador en procesos de alquilación y ciclización. Los procesos industriales como la producción de trifluoruro de boro y la polimerización del tetrahidrofurano utilizan ácido fluorosulfúrico. Además, se ha empleado en el pulido químico del vidrio de cristal de plomo desde la década de 1960.
El ácido fluorosulfúrico comercial está compuesto aproximadamente por un 99,0 % de HSO3F, con impurezas menores que incluyen ácido sulfúrico, trióxido de azufre, dióxido de azufre y hierro.
Hasta la fecha, las sales y los derivados del ácido fluorosulfúrico tienen una importancia industrial limitada.
Tabla de contenido
1. Propiedades físicas del ácido fluorosulfúrico
El ácido fluorosulfúrico es un líquido incoloro soluble en disolventes orgánicos polares (p. ej., nitrobenceno, ácido acético y acetato de etilo), pero poco soluble en disolventes no polares.
Las propiedades físicas del ácido fluorosulfúrico se resumen en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | [7789-21-1] |
| Fórmula química | HSO3F |
| Peso molecular | 100,07 g/mol |
| Punto de fusión | - 88,98 °C |
| Punto de ebullición punto |
a 101,3 kPa: 162,7 °C a 16,0 kPa: 110 °C a 2,5 kPa: 77 °C |
| Densidad |
a 18 °C: 1,740 g/cm3 a 25 °C: 1,725 g/cm3 |
| Presión de vapor a 25 °C | 330 Pa |
| Viscosidad a 25 °C | 1,56 mPa.s |
| Calor de formación (líquido) | 792,45 kJ/mol |
2. Producción de ácido fluorosulfúrico
El ácido fluorosulfúrico se produce industrialmente mezclando fluoruro de hidrógeno y trióxido de azufre en ácido fluorosulfúrico como disolvente para la reacción. El ácido fluorosulfúrico se enfría para mantener la temperatura en el reactor constante a < 100 °C, como se muestra en la Figura 1.
HF + SO3 → HSO3F
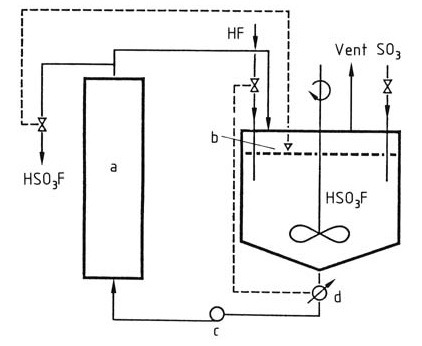
Figura 1: Producción de ácido fluorosulfúrico
a) Enfriador; b) Control de nivel; c) Bomba; d) Conductómetro
Alternativamente, el ácido fluorosulfúrico se puede sintetizar haciendo reaccionar fluoruro de hidrógeno de potasio o fluoruro de calcio con óleum (ácido sulfúrico fumante) a temperaturas elevadas (alrededor de 250 °C).
Después de la reacción, cualquier fluoruro de hidrógeno restante se elimina mediante purga con un gas inerte. El ácido fluorosulfúrico resultante se puede purificar luego mediante destilación en un aparato de vidrio.
Debido a la naturaleza corrosiva del ácido fluorosulfúrico, su producción y manipulación requieren equipo especializado y protocolos de seguridad rigurosos.
3. Usos del ácido fluorosulfúrico
3.1. Usos del ácido fluorosulfúrico en química inorgánica
El ácido fluorosulfúrico se utiliza como un agente fluorante que exhibe una reactividad más suave en comparación con el ácido fluorhídrico. Entre los ejemplos de reacciones de fluoración se incluyen la conversión de dióxido de silicio en tetrafluoruro de silicio, ácido bórico en trifluoruro de boro, trióxido de arsénico en trifluoruro de arsénico y perclorato de potasio en fluoruro de perclorilo. Este último compuesto se emplea como agente fluorante en la síntesis orgánica.
3.2. Usos del ácido fluorosulfúrico en el pulido de vidrio
El ácido fluorosulfúrico se utiliza para restaurar los baños de pulido de vidrio con plomo, que comprenden un 60-70 % de ácido sulfúrico, un 2-6 % de ácido fluorhídrico y agua. El proceso de pulido consume estos ácidos disolviendo parcialmente la superficie del vidrio, como se muestra en las siguientes ecuaciones:
PbO + H2SO4 → PbSO4 + H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Cuando se añade ácido fluorosulfúrico al baño de pulido, se hidroliza para reproducir estos ácidos en el medio ácido consumiendo parte del agua formada.
HSO3F + H2O → H2SO4 + HF
Este método reduce el consumo de ácido fluorhídrico en aproximadamente un 28% y también reduce el ácido residual en comparación con las técnicas de regeneración tradicionales que utilizan ácidos sulfúrico y fluorhídrico.
3.3. Usos del ácido fluorosulfúrico en química orgánica
El ácido fluorosulfúrico cataliza las reacciones de alquilación, polimerización e isomerización en la síntesis orgánica. El intermediario reactivo fluorosulfato de alquilo es responsable de la actividad catalítica. Ejemplos de esta reacción incluyen:
- Alquilación de olefinas e isoparafinas
- Formación de combustibles de alto octanaje a partir de hidrocarburos de bajo octanaje
- Producción de aromáticos alquilados y alquilación de fenol a terc-butilfenol.
Además, se utiliza en reacciones de polimerización, como la polimerización de tetrahidrofurano, de etileno a hidrocarburos insaturados de cadena larga y de trioxano a polioximetileno. La isomerización de hidrocarburos C7, penteno y metilpenteno también es catalizada por ácido fluorosulfúrico.
La producción selectiva de beta-naftol a partir de naftaleno por hidroxilación catalítica con peróxido de hidrógeno se logra utilizando una combinación de ácido fluorosulfúrico y pentafluoruro de antimonio como sistema catalizador.
3.4. Usos del ácido fluorosulfúrico en la purificación del flúor
El ácido fluorosulfúrico ofrece una alternativa al fluoruro de sodio para eliminar el fluoruro de hidrógeno del flúor elemental. A diferencia del fluoruro de sodio, que forma fluoruro de hidrógeno de sodio poco soluble, el producto formado con ácido fluorosulfúrico se puede eliminar por destilación.
4. Riesgos de seguridad y manipulación del ácido fluorosulfúrico
El ácido fluorosulfúrico plantea riesgos significativos para la salud humana debido a su naturaleza corrosiva y reactividad. El contacto con los ojos, la piel o las membranas mucosas puede provocar quemaduras graves y daño tisular. La exposición a los vapores puede irritar el tracto respiratorio. La hidrólisis del ácido fluorosulfúrico en presencia de humedad genera fluoruro de hidrógeno y ácido sulfúrico, lo que exacerba los efectos corrosivos.
El fluoruro de hidrógeno tiene propiedades toxicológicas únicas; penetra la piel y causa daño tisular profundo. Su capacidad para quelar iones de calcio y magnesio altera el metabolismo celular.
Es imperativo cumplir estrictamente los protocolos de seguridad al manipular ácido fluorosulfúrico. Es obligatorio el uso de equipo de protección personal, que incluya protección respiratoria, guantes resistentes a productos químicos, protección ocular y trajes de cuerpo entero en casos graves.
Los procedimientos de emergencia para incidentes de exposición requieren descontaminación inmediata con agua y una solución de gluconato de calcio, seguida de atención médica. La ingestión requiere la administración de leche de magnesia o solución de gluconato de calcio.
El ácido fluorosulfúrico puede encender materiales orgánicos en condiciones específicas. Los derrames deben manipularse con sumo cuidado, utilizando grandes cantidades de agua para diluir y evitando la formación de nieblas corrosivas.
Se recomienda la adición de ácido sulfúrico concentrado frío, seguido de la dilución y neutralización con cal, para derrames pequeños.
Referencia
- Ácido fluorosulfúrico; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a11_431.pub2
