Phthalsäure: Eigenschaften, Herstellung und Verwendung
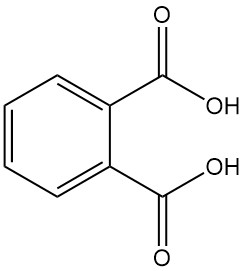
Phthalsäure, auch o-Phthalsäure oder 1,2-Benzoldicarbonsäure genannt, ist eine aromatische Dicarbonsäure mit der chemischen Formel C8H6O4. Es handelt sich um einen weißen, kristallinen Feststoff, der industriell keine Bedeutung hat. Es entsteht als Nebenprodukt bei der Herstellung von Phthalsäureanhydrid.
Phthalsäure kommt natürlicherweise in einigen Pflanzen vor, beispielsweise in Papaver somniferum, Cocos nucifera und anderen Organismen und Tieren. Es wurde erstmals 1836 vom französischen Chemiker A. Laurent als Produkt der Oxidation von Naphthalin entdeckt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Phthalsäure
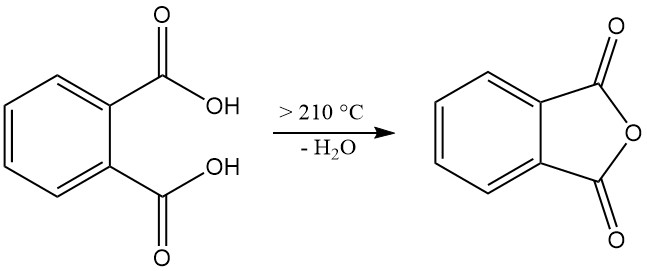
Phthalsäure [88-99-3] ist eine schwache diprotische Säure mit Dissoziationskonstanten pKa1 = 2,89 und pKa2 = 5,51. Es bildet in einem verschlossenen Röhrchen farblose, monokline Kristalle mit einem Schmelzpunkt von 191 °C, die bei Temperaturen über 210 °C unter Wasserabspaltung in Phthalsäureanhydrid umgewandelt werden.
Phthalsäure ist in kochendem Wasser (100 °C) zu 18 g/100 ml löslich und in kaltem Wasser (14 °C) viel weniger löslich (0,54 g/100 ml). Es ist in Ethanol (10 g/100 ml) und Methanol (19,5 g/100 ml) löslich und in Chloroform und Ether unlöslich.
Einige der wichtigen physikalischen Eigenschaften von Phthalsäure sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Formel | C8H6O4 |
| Molekulargewicht | 166,14 g/mol |
| Schmelzpunkt | 191 °C (im verschlossenen Röhrchen) Zersetzung bei 210 °C |
| Dichte bei 15 °C | 1,593 g/cm3 |
| Dampfdichte | 5.7 |
| Fusionswärme | 315,3 J/g |
| Spezifische Wärme des Feststoffs (0–99 °C) | 1,214 J g-1 K-1 |
| Verbrennungswärme | 19657,03 J/g |
| Bildungswärme | 43714,34 J/g |
| Lösungswärme bei 25 °C | 123,55 J/g |
| Flammpunkt | 168 °C |
2. Reaktionen von Phthalsäure
Phthalsäure geht typische chemische Reaktionen von Carbonsäuren und aromatischen Verbindungen ein.
Phthalsäure ist eine schwache zweiprotonige Säure, die mit Basen wie NaOH oder KOH und Metalloxiden unter Bildung von Salzen, sogenannten Phthalaten, reagiert. Diese Salze können in Wasser löslich (mit Alkalimetallen (z. B. Natrium, Kalium) gebildete Salze) oder unlöslich, wie Calcium- und Magnesiumphthalate, sein.
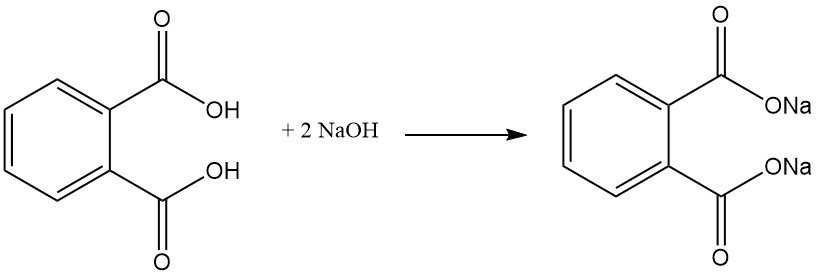
Phthalsäure reagiert mit Alkoholen in Gegenwart eines Säurekatalysators (Schwefelsäure) zu Phthalatdiestern. Diese Ester sind nützliche Industriechemikalien mit verschiedenen Anwendungen.
Beim Erhitzen auf 210 °C oder mehr dehydriert Phthalsäure zu Phthalsäureanhydrid.
Phthalsäure kann aromatische Substitutionsreaktionen eingehen; allerdings wird es durch die Anwesenheit der beiden Carbonsäuregruppen desaktiviert. Unter spezifischen und rauen Bedingungen könnte eine weitere Funktionalisierung des aromatischen Rings möglich sein.
3. Herstellung von Phthalsäure
Phthalsäure entsteht als Nebenprodukt bei der Herstellung von Phthalsäureanhydrid durch Hydrolyse. Phthalsäure spielt in der Industrie keine Rolle. Stattdessen wird Phthalsäureanhydrid industriell hergestellt und dann bei Bedarf in Phthalsäure umgewandelt.
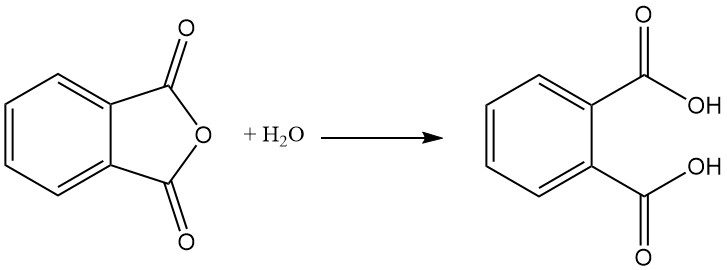
Phthalsäureanhydrid wird durch katalytische Oxidation von Naphthalin oder ortho-Xylol (o-Xylol) bei hohen Temperaturen hergestellt und verwendet häufig einen Festbett-Rohrreaktoraufbau.
Ein Patent aus dem Jahr 1979 beschrieb die Herstellung von Phthalsäure durch kontinuierliche Flüssigoxidation von o-Xylol mit Luft in einem Rührreaktor. Die Reaktion wird bei einer Temperatur zwischen 160 °C und 200 °C und einem Druck zwischen 21 und 29 kg/cm2 durchgeführt.
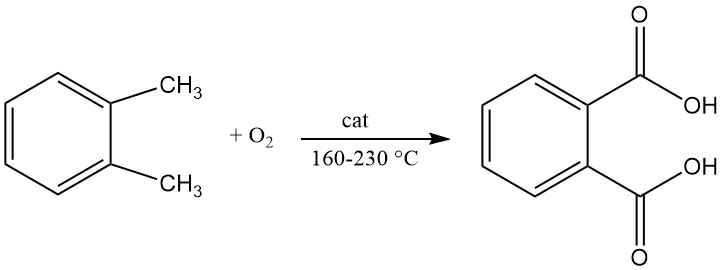
Der in diesem Verfahren verwendete Katalysator enthielt eine Mischung aus Kobalt, Mangan und Brom und der Wassergehalt im Reaktionsmedium liegt zwischen 0,2 % und 7 %.
Die Luft wird als Oxidationsmittel verwendet und das resultierende Flüssigkeitsgemisch enthält 8 bis 40 % Phthalsäure und 6 bis 30 % o-Xylol. Dieses flüssige Gemisch wird zusammen mit zusätzlicher Luft kontinuierlich einem zweiten Rührreaktor zugeführt.
Die Temperatur in diesem zweiten Reaktor wird zwischen 210 °C und 230 °C gehalten. Es ist wichtig zu beachten, dass hier frischer Katalysator hinzugefügt wird, der mindestens 1 Milligramm Kobalt pro Mol verarbeitetem Xylol (im Vergleich zur ersten Stufe) enthält.
Diese zweistufige Reaktion ergibt ein flüssiges Abwasser, das reich an Phthalsäure ist (85 % bis 92 %). Es enthält jedoch auch Wasser, Verunreinigungen wie Benzoesäure und höher siedende Verbindungen.
4. Verwendung von Phthalsäure
Phthalsäure wird als Analyse- und Laborreagenz sowie zur Herstellung von Arzneimitteln, Farbstoffen, Phthalimid, Anthranilsäure, Phthalsäureestern und synthetischen Parfüms verwendet.
Phthalsäure kann als Vorstufe für Phthalsäureanhydrid verwendet werden, das wertvoller ist und in verschiedenen Branchen wie Farben, Kunststoffen, Textilien und Pharmazeutika verwendet wird.
5. Toxikologie und Gefahren von Phthalsäure
Phthalsäure ist ein Zwischenprodukt, das unter kontrollierten Bedingungen in der Industrie hergestellt und weiterverwendet wird. Eine berufsbedingte Exposition kann auftreten, dürfte jedoch gering sein. Die Exposition der Bevölkerung gegenüber Phthalsäure ist gering und vernachlässigbar.
Trotz der begrenzten Anzahl verfügbarer toxikologischer Studien deuten die vorliegenden Daten auf eine geringe Toxizität von Phthalsäure hin. Akute Toxizitätsstudien an Mäusen (intraperitoneale Injektion) weisen auf eine mittlere tödliche Dosis (LD50) von 550 mg/kg hin.
Nach der Exposition wird der Großteil der Phthalsäure entweder direkt (wie bei Hunden) oder teilweise konjugiert (wie bei Ratten und Kaninchen) mit dem Urin ausgeschieden. Ein kleiner Teil kann einer Decarboxylierung unterliegen und als Benzoesäure eliminiert werden.
Verweise
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- https://patents.google.com/patent/US4215053A/en
- https://pubchem.ncbi.nlm.nih.gov/compound/Phthalic-acid
