Nitrierung aromatischer Verbindungen
1. Entschlüsselung der Geschichte aromatischer Nitrierungsreaktionen
Im frühen 19. Jahrhundert wurden bedeutende Fortschritte bei der Synthese aromatischer Nitroverbindungen erzielt. Mitscherlich gelang es 1834, solche Verbindungen zu gewinnen, indem er aus Kohlenteer gewonnene Kohlenwasserstoffe rauchender Salpetersäure aussetzte.
Laurent setzte diese Arbeit 1835 fort und konzentrierte sich dabei auf die Nitrierung von Naphthalin, dem damals am leichtesten verfügbaren reinen aromatischen Kohlenwasserstoff. Im Jahr 1838 präsentierte Dale auf der Jahrestagung der British Association for the Advancement of Science Ergebnisse zu gemischten Nitroverbindungen, die aus Rohbenzol gewonnen wurden.
Allerdings berichteten Hofmann und Muspratt erst 1845 über ihre systematische Forschung zur Nitrierung von Benzol, die unter Verwendung einer Mischung aus Salpeter- und Schwefelsäure zu Mono- und Dinitrobenzolen führte.
Inhaltsverzeichnis
Die anfängliche Produktion von Nitrobenzol erfolgte in kleinem Maßstab und wurde sorgfältig destilliert, um eine gelbe Flüssigkeit mit einem bittermandelartigen Aroma zu ergeben. Dieses Produkt, bekannt als „Essenz von Mirbane“, wurde an Seifen– und Parfümhersteller verkauft.
Bechamps Eisenreduktionsverfahren, das die Verfügbarkeit von Anilin erhöhte, wurde 1854 veröffentlicht. Anschließend markierte Perkins Entdeckung des lila Anilins im Jahr 1856 den Beginn der europäischen Anilinfarbstoffindustrie, die als Grundlage für die weltweite Industrie synthetischer Farbstoffe mit geschätzten Umsätzen diente von 6 x 109 US-Dollar im Jahr 1988.
Die von Perkin initiierte und von zahlreichen anderen fortgesetzte Entwicklung und Ausweitung der Nitrierungs- und Reduktionsverfahren führte zu einer erheblichen Senkung des Handelspreises für Anilin von 50 Fr/kg im Jahr 1858 auf 10 Fr/kg im Jahr 1863.
Bis 1871 erreichte die europäische Anilinproduktion 3500 t/a. Im Jahr 1985 stieg die europäische Anilinproduktion auf 500.000 t/a, wobei die Verwendung in Farbstoffen nur 4 % der gesamten Anilinproduktion ausmachte.
Der Großteil des Wachstums war auf Kautschukchemikalien und Isocyanate zurückzuführen, die über 50 % der Nitrobenzolproduktion für die Herstellung von Methylendiphenyldiisocyanat verbrauchten.
Die Anzahl natürlich vorkommender nitroaromatischer Verbindungen ist begrenzt. Chloramphenicol wurde 1949 erstmals erkannt und aus Kulturen von Streptomyces venezuelae, einem Bodenschimmel, extrahiert.
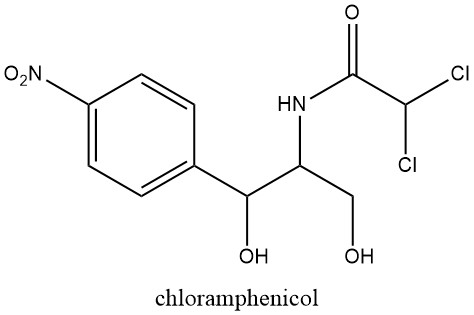
Diese Entdeckung veranlasste weitere Untersuchungen zur pharmakologischen Aktivität der Nitrogruppe, nachdem bereits 1943 die antibakteriellen Eigenschaften von Nitrofuranderivaten entdeckt worden waren.
Auch viele synthetische Pharmazeutika und Agrochemikalien enthalten nitroaromatische Gruppen, wobei die genaue Rolle der Nitrogruppe in diesen Verbindungen oft unklar bleibt.
Die primäre Methode zur Einführung von Nitrogruppen in aromatische Systeme ist die Nitrierung.
Zwar stehen einige indirekte Methoden zur Verfügung, wie die Oxidation von Nitroso- oder Aminoverbindungen, der Austausch von Diazoniumgruppen (Sandmeyer-Reaktion), die Umlagerung von Nitraminen und nukleophile Verdrängungsreaktionen, sie haben jedoch nur begrenzte industrielle Bedeutung.
Einheitsprozesse wie Sulfonierung, Halogenierung oder Aminierung werden üblicherweise auf primäre Nitro-Ausgangsmaterialien angewendet, die hauptsächlich aus Nitrobenzol, Nitrotoluolen und Nitrochlorbenzolen abgeleitet sind, um verschiedene wichtige Nitroverbindungen herzustellen.
Die nukleophile Verdrängung aktivierter Nitrogruppen hat ein gewisses Synthesepotenzial, und ihre Nukleofugizität kann mit der von Fluorsubstituenten vergleichbar sein. Bestimmte leicht verfügbare Nitroverbindungen wie 1,3-Dinitrobenzol reagieren mit spezifischen Reagenzien und bilden nützliche Derivate.
Nitroverbindungen oder ihre Derivate dienen als Zwischenprodukte für Farbstoffe, Agrochemikalien, Pharmazeutika, Feinchemikalien, synthetische Materialien und Sprengstoffe, wobei es nur wenige große Absatzmärkte für die Produktion in großem Maßstab gibt.
2. Nitrierungsreaktion
Der Nitrierungsprozess kann als irreversible Einführung einer oder mehrerer Nitrogruppen (NO2) in einen aromatischen Kern beschrieben werden, wodurch ein Wasserstoffatom ersetzt wird.
Nitrierung ist eine elektrophile Substitutionsreaktion, dargestellt durch die Gleichung:
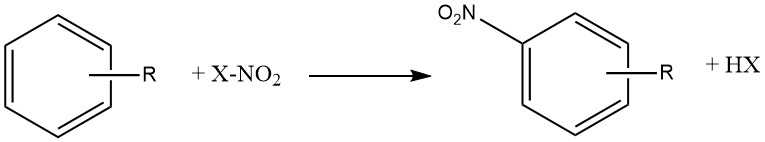
Die Einführung der Nitrogruppe deaktiviert den Ring für eine weitere elektrophile Substitution, sodass Dinitrierung unter den für die Mononitrierung verwendeten Bedingungen selten vorkommt.
Für die Dinitrierung sind in der Regel strengere Bedingungen erforderlich, die einen Überschuss, eine stärkere Säure und eine höhere Temperatur erfordern. Diese Bedingungen werden häufig auf isolierte Mononitroverbindungen angewendet, anstatt schrittweise Reaktionen in situ durchzuführen.
Die Nitrierungsreaktion ist stark exotherm, was durch die Mononitrierung von Benzol (ΔH = -117 kJ/mol) und Naphthalin (ΔH = -209 kJ/mol) belegt wird. Folglich handelt es sich um einen der potenziell gefährlichsten industriell betriebenen Einheitsprozesse.
Die bei der Nitrierung entstehende Wärme kann dazu führen, dass Salpetersäure organische Materialien exotherm und explosionsartig in gasförmige Produkte abbaut.
Nitroarylverbindungen, insbesondere solche mit mehreren Nitrogruppen, stellen aufgrund ihres hohen Sauerstoffgehalts eine potenzielle Gefahr dar.
Einige Polynitroverbindungen wie Trinitrotoluol und Pikrinsäure sind detonierbar und werden seit langem als Sprengstoffe eingesetzt. Darüber hinaus können nitroaromatische Verbindungen beim Erhitzen mit Alkali heftige Zersetzungsreaktionen eingehen.
Der Nitrierungsprozess kann entweder diskontinuierlich (diskontinuierlich) oder kontinuierlich durchgeführt werden. Batch-Reaktionen eignen sich für geringere Mengenanforderungen und werden in Nitratoren durchgeführt, die für die Handhabung verschiedener Produkte ausgelegt sind.
Aus Sicherheitsgründen sind diese Reaktoren typischerweise auf ein Fassungsvermögen von etwa 6000 l begrenzt und mit effizienten Rührwerken und Kühlsystemen ausgestattet.
Andererseits bietet eine kontinuierliche Reaktion, die für Zwischenprodukte mit großer Tonnage wie Nitrobenzol und Nitrotoluolen geeignet ist, Vorteile hinsichtlich Sicherheit und Kosteneffizienz.
Die Produktion von Nitroaromaten basiert in erster Linie auf Verfahren mit hoher Ausbeute, wobei über 80 % der Gesamtkosten auf die Rohstoffe entfallen. Daher sind die betrieblichen Einsparungen begrenzt.
Allerdings wurden Verbesserungen in Bereichen wie dem Schwefelsäurerecycling, einer wesentlichen Voraussetzung für effiziente Nitrierungsverfahren, sowie der Isomerenkontrolle und -trennung erzielt, die zu einer verbesserten Prozesseffizienz beitragen.
3. Nitrierungsmittel
Aus praktischen und wirtschaftlichen Gründen wird die Nitrierung im industriellen Maßstab üblicherweise mit einer Mischsäure durchgeführt, bei der es sich um eine Kombination aus Salpeter- und Schwefelsäure handelt. Gelegentlich werden auch andere Kombinationen wie wässrige Salpetersäure, Salpetersäure in Essigsäure oder Salpetersäure in Essigsäureanhydrid verwendet.
In bestimmten wichtigen unterstützenden Studien können alternative Säurekomponenten wie Perchlorsäure, Flusssäure oder Bortrifluorid verwendet werden, ihre Anwendung ist jedoch begrenzt. Diese alternativen Reaktionen können in inerten organischen Lösungsmitteln wie Chlorkohlenwasserstoffen oder Sulfolan stattfinden, um homogene Reaktionsmischungen zu erzeugen.
Die Stärke des Nitrierungsmittels (X-NO2) nimmt mit abnehmender Elektronegativität von X ab. Die aktivste Spezies in diesen Systemen ist das Nitroniumion (NO2+). Im gemeinsamen System setzt sich die Gesamtgleichung aus verschiedenen Gleichgewichten in HNO3-H2SO4-H2O-Gemischen zusammen, die bei der Beurteilung der Substratreaktivität und des Ausmaßes der erforderlichen Nitrierung berücksichtigt werden sollten.
Für die aromatische Mononitrierung im großen Maßstab besteht ein typisches Nitrierungsmittel aus 20 % Salpetersäure, 60 % Schwefelsäure und 20 % Wasser und wird oft als „20/60/20-Mischsäure“ bezeichnet. Alternativ kann es in manchen Situationen auch als 15 Mol-% Salpetersäure, 30 Mol-% Schwefelsäure und 55 Mol-% Wasser beschrieben werden.
Das flüssige aromatische Substrat und das nitrierte Produkt bilden typischerweise eine von der wässrigen Mischsäure getrennte Phase. Daher ist eine effiziente Bewegung von entscheidender Bedeutung, um den Kontakt mit der organischen Phase zu maximieren und den Widerstand gegen den Stofftransfer zu minimieren.
Feste Substrate lösen sich am besten in der Schwefelsäurephase. Es ist wichtig, verschiedene Variablen wie Salpetersäurekonzentration, Temperatur und andere Parameter für jede spezifische Nitrierung zu optimieren, um die gewünschte Isomerbildung zu erreichen und Nebenreaktionen zu minimieren.
Radikalische Reaktionen, die typischerweise in der Dampfphase mit Salpetersäure oder Stickstoffdioxid als Nitrierungsmittel eingesetzt werden, werden bei der aromatischen Nitrierung üblicherweise nicht eingesetzt. Sie eignen sich besser für die aliphatische Nitrierung.
4. Nitrierungsreaktionsmechanismen
Seit der Bestätigung des Nitroniumions (NO2+) als aktive Spezies durch die Ingold-Hughes-Schule im Jahr 1950 mithilfe der Raman-Spektrenanalyse wurden umfangreiche Experimente zur aromatischen Nitrierung durchgeführt.
Während Temperatur und Mischungsgrad bei allen Nitriermitteln eine entscheidende Rolle spielen, führen andere Variablen häufig zu inkonsistenten Ergebnissen. Bei der kommerziellen Nitrierung mit HNO3-H2SO4 weisen die relativen Geschwindigkeitskonstanten einen weiten Bereich auf, was zu Reaktionszeiten führt, die von mehreren Sekunden für aktive Substrate bis zu mehreren Stunden für inaktive Substrate variieren.
Es wurde argumentiert, dass unter den nicht idealen Bedingungen der Massenproduktion der Stofftransport möglicherweise mehr Kontrolle über die Nitrierung als die Kinetik hat, was die Annahme in vielen Laborstudien in Frage stellt, dass der Stofftransportwiderstand vernachlässigbar sei.
Darüber hinaus wurde eine frühere Annahme, dass die Nitrierungsgeschwindigkeit mit der Gleichgewichtsbildung des Nitroniumions übereinstimmt, in Frage gestellt, da man erkannte, dass bei unterschiedlichen Säurestärken unterschiedliche Mechanismen gelten können.
Abbildung 1 veranschaulicht den Mechanismus, der alle verfügbaren Fakten zur Nitrierung einfacher Substrate wie Benzol und Toluol (ausgenommen Phenole oder Polyalkylbenzole) erklären kann. Dieser Mechanismus umfasst vier Geschwindigkeitskonstanten und drei signifikante reversible Reaktionen, was die Kinetik äußerst komplex macht, selbst wenn die Reaktion vollständig kinetisch kontrolliert ist.
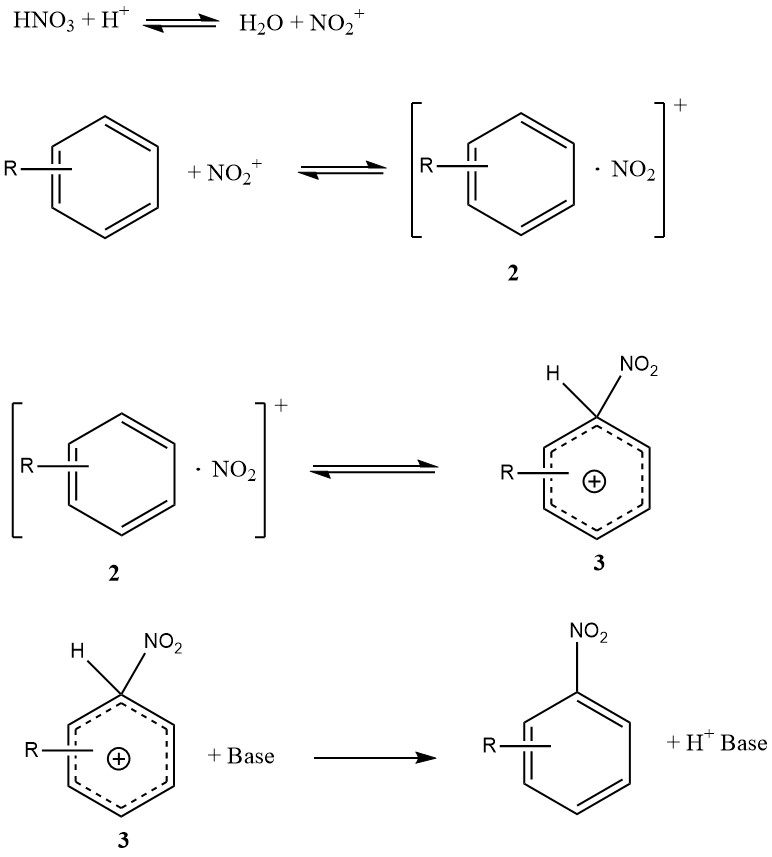
Der Begegnungskomplex oder Begegnungspaar (2) ist ein neuartiges Merkmal dieses Mechanismus. Es handelt sich um einen Molekülkomplex weniger spezifischer Natur im Vergleich zum früheren Konzept eines intermediären p-Komplexes. Wichtig ist, dass der Begegnungskomplex (2) eine kinetische Rolle spielt und möglicherweise tatsächlich geschwindigkeitsbestimmend ist.
Die Umwandlung des S-Komplexes (3), manchmal auch als Wheland-Zwischenprodukt bezeichnet, in das Produkt ist nicht geschwindigkeitsbestimmend, da die Nitrierungsreaktion keinen primären kinetischen Isotopeneffekt aufweist.
Unter bestimmten Bedingungen könnte die Bildung des Nitroniumions geschwindigkeitsbestimmend sein, bei reaktiven Substraten in wässriger Schwefelsäure ist jedoch überwiegend die Bildung des Begegnungskomplexes (2) der geschwindigkeitsbestimmende Schritt.
Im Gegensatz dazu folgt die Nitrierung von Toluol, Benzol und anderen weniger reaktiven aromatischen Verbindungen einem Gesamtgeschwindigkeitsgesetz, bei dem die Bildung des s-Komplexes (3) hauptsächlich der geschwindigkeitsbestimmende Schritt ist.
Wenn im Fall von Phenol der Ring für einen elektrophilen Angriff stark aktiviert ist, gewinnt das Nitrosoniumion (NO+) an Bedeutung und führt zur Bildung einer intermediären Nitrosoverbindung. Dieses Zwischenprodukt wird durch Salpetersäure weiter oxidiert, um das Nitroderivat zu ergeben, während salpetrige Säure regeneriert wird.
Eine weitere Ausnahme vom allgemeinen Mechanismus ist der ipso-elektrophile Angriff an einer Substituentenposition. Bei Di- und Polyalkylbenzolen kann sich anstelle des herkömmlichen Wheland-Zwischenprodukts (3) das ipso-Nitroareniumion (4) bilden.
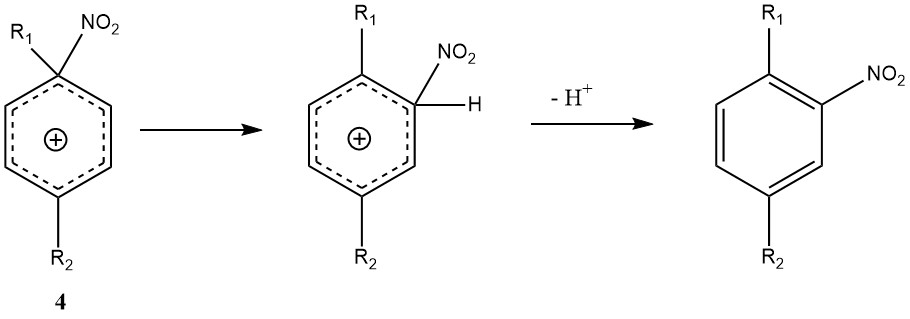
Die Umlagerung von 4 zum Wheland-Zwischenprodukt kann stattfinden, geht jedoch mit Nebenreaktionen wie der Nitrodealkylierung einher, sodass die Nitrierung von Polyalkylbenzolen möglicherweise variablere Mischungsprodukte ergibt als andere Nitrierungen.
Ein verbessertes Verständnis der Bildung von ipso-Wheland-Zwischenprodukten hat zu ihrer Verwendung in anderen Reaktionen, insbesondere mit Nukleophilen, geführt.
Referenz
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
FAQ
Die Nitrierungsreaktion ist ein chemischer Prozess, bei dem eine oder mehrere Nitrogruppen (NO2) durch Austausch eines Wasserstoffatoms in einen aromatischen Kern eingeführt werden. Dabei handelt es sich um eine elektrophile Substitutionsreaktion, die üblicherweise zur Modifizierung aromatischer Verbindungen durch Anbringen von Nitrogruppen verwendet wird, wodurch sich deren Eigenschaften und Reaktivität erheblich verändern können.
Bei der aromatischen Nitrierung ist das für den Angriff auf den aromatischen Kern verantwortliche Elektrophil das Nitroniumion (NO2+). Das Nitroniumion entsteht durch die Reaktion zwischen Salpetersäure und Schwefelsäure und fungiert als Elektrophil, das während der elektrophilen Substitutionsreaktion ein Elektronenpaar vom aromatischen Ring aufnimmt.
Schwefelsäure wirkt bei der aromatischen Nitrierung als Katalysator bei der Bildung des Nitroniumions (NO2+) aus der Reaktion zwischen Salpetersäure und Schwefelsäure. Darüber hinaus hilft Schwefelsäure dabei, die Salpetersäure zu entwässern, wodurch sie zu einem stärkeren Nitrierungsmittel wird. Darüber hinaus trägt Schwefelsäure zur Auflösung und Solubilisierung des aromatischen Substrats bei, was eine effiziente Reaktion ermöglicht und den Kontakt mit dem Nitrierungsmittel maximiert.
Die Hauptprodukte der Nitrierung sind monosubstituierte nitroaromatische Verbindungen, die entstehen, wenn eine Nitrogruppe in den aromatischen Kern eingeführt wird. Fünf mögliche Produkte aus der Nitrierung können sein:
- Nitrobenzol (C6H5NO2)
- Nitrotoluole (z. B. ortho-Nitrotoluol, meta-Nitrotoluol und para-Nitrotoluol)
- Nitronaphthaline (z. B. Alpha-Nitronaphthalin und Beta-Nitronaphthalin)
- Nitrophenole (z. B. ortho-Nitrophenol, meta-Nitrophenol und para-Nitrophenol)
- Nitroaniline (z. B. ortho-Nitroanilin, meta-Nitroanilin und para-Nitroanilin)
