Isopropanol: Eigenschaften, chemische Reaktionen, industrielle Produktion, Anwendungen und Toxikologie
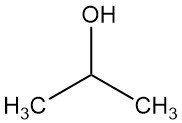
Was ist Isopropanol?
Isopropylalkohol, auch bekannt als Isopropanol oder 2-Propanol, ist der einfachste sekundäre Alkohol mit der chemischen Formel C3H7OH. Es ist eine farblose, flüchtige und brennbare Flüssigkeit mit leicht bitterem Geschmack und schwachem Geruch, ähnlich einer Mischung aus Ethanol und Aceton.
Isopropanol kommt in der Natur in Rohfuselölen sowie als Fermentations- und Abbauprodukt verschiedener Gemüsesorten vor. Es gilt als der erste petrochemisch gewonnene Alkohol und steht unter den niederen Alkoholen (C1–C5) nach Methanol und Ethanol an dritter Stelle der weltweiten Produktionsmengen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Isopropanol
Isopropanol (2-Propanol) ist ein sekundärer Alkohol, der vollständig mit Wasser mischbar und in einer Vielzahl gängiger organischer Lösungsmittel, darunter Ether, Ester, Ketone, Säuren und andere Alkohole, gut löslich ist.
Die Wasserlöslichkeit von Isopropanol nimmt in Gegenwart gelöster Salze ab. Die Zugabe von Salzen wie Natriumchlorid oder Natriumsulfat führt zur Phasentrennung und zur Bildung einer nicht mischbaren organischen Schicht. Diese Eigenschaft wird bei der Extraktion polarer Verbindungen aus wässrigen Lösungen genutzt.
Die physikalischen Eigenschaften von Isopropylalkohol werden durch seine polare Hydroxylgruppe (–OH) und seine sekundäre Alkoholstruktur beeinflusst. Er hat niedrigere Siede- und Flammpunkte als n-Propanol, während Dampfdruck und Gefrierpunkt höher sind.
Tabelle 1 zeigt die physikalischen Eigenschaften von wasserfreiem Isopropylalkohol sowie seiner 91 Vol.-%igen azeotropen Mischung mit Wasser.
| Eigenschaft | Wasserfrei | 91 Vol.-% |
|---|---|---|
| Molekulargewicht | 60,10 | |
| Siedepunkt, bei 101,3 kPa, °C | 82,3 | 80,4 |
| Gefrierpunkt, °C | −88,5 | −50,0 |
| Spezifisches Gewicht, 20/20 | 0,7864 | 0,8183 |
| Dichte bei 20 °C, g/cm3 | 0,7854 | 0,8173 |
| Oberflächenspannung bei 20 °C, mN/m(= dyn/cm) | 21,32 | 21,40 |
| Spezifische Wärmekapazität einer Flüssigkeit bei 20 °C, J/(kg·K) | 2510,4 | |
| Brechungsindex | 1,3772 | 1,3769 |
| Verbrennungswärme bei 25 °C, kJ/mol | 2005,8 | |
| Verdampfungswärme bei 101,3 kPa, kJ/mol | 39,8 | |
| Dampfdruck bei 20 °C, kPa | 4,4 | 4,5 |
| Kritische Temperatur, °C | 235,2 | |
| Kritischer Druck bei 20 °C, kPa | 4764 | |
| Viskosität, mPa·s (= cP) bei 0 °C | 4,6 | |
| Viskosität, mPa·s (= cP) bei 20 °C | 2,4 | 2,1 |
| Viskosität, mPa·s (= cP) bei 40 °C | 1,4 | |
| Entzündbarkeitsgrenze in Luft, Vol.-% | Untere: 2,5 Obere: 12 |
|
| Flammpunkt, °C (offener Tiegel) | 17,2 | 21,7 |
| Flammpunkt, °C (geschlossener Tiegel) | 11,7 | 18,3 |
| Zündungstemperatur, °C | 399 |
Handelsübliches Isopropanol in den USA besteht überwiegend aus wasserfreiem Isopropylalkohol und einem 91 Vol.-%igen wässrigen Azeotrop, dem sogenannten Siedepunktgemisch. Reinigungsalkohole enthalten typischerweise 70 % oder mehr Isopropylalkohol in Wasser.
Isopropylalkohol bildet auch Azeotrope mit verschiedenen Verbindungen, darunter Kohlenwasserstoffe, Ester, Halogenkohlenwasserstoffe, Amine, Ketone und aromatische Kohlenwasserstoffe. Mit Aceton, Ethanol, Ethylbenzol, Hexylamin oder Methylisobutylketon bildet er keine binären Azeotrope, kann aber mit einigen dieser Verbindungen ternäre Azeotrope bilden.
Beispiele für binäre Azeotrope von Isopropylalkohol finden sich in Tabelle 2.
| Komponente | Siedepunkt, °C | Siedepunkt des Azeotrops, °C | Zusammensetzung von Isopropylalkohol, Gew.-% |
|---|---|---|---|
| Wasser | 100 | 80,3 | 87,4 |
| Toluol | 110,6 | 80,6 | 69 |
| Methylpropionat | 79,6 | 77 | 28 |
| Methylethylketon | 79,6 | 77,9 | 32 |
| Ethylacetat | 77,05 | 75,9 | 25 |
| 2-Chlorbutan | 68,25 | 64 | 18 |
| Hexan | 68,9 | 62,7 | 23 |
| Cyclohexan | 80,8 | 68,6 | 33 |
| Butylamin | 77,8 | 84,7 | 60 |
| Diisopropylether | 69 | 66,2 | 16,3 |
2. Chemische Reaktionen von Isopropanol
Die chemischen Eigenschaften von Isopropanol werden durch das Vorhandensein einer sekundären Hydroxygruppe bestimmt. Seine Reaktivität ist charakteristisch für sekundäre Alkohole und ist im Allgemeinen an der Hydroxygruppe höher als bei primären Alkoholen wie n-Propyl- oder Ethylalkohol. Die meisten Reaktionen beinhalten die Spaltung entweder der C-OH- oder der O-H-Bindung.
Isopropylalkohol unterliegt einer Vielzahl von Umwandlungen, darunter Dehydrierung, Oxidation, Veresterung, Veretherung, Aminierung und Halogenierung. Industriell wichtige Beispiele sind die Herstellung von Aluminiumisopropoxid und Isopropylhalogeniden.
Aluminiumisopropoxid wird quantitativ durch Rückflusskochen von Isopropylalkohol mit Aluminiummetall in Gegenwart katalytischer Mengen Quecksilberchlorid hergestellt:
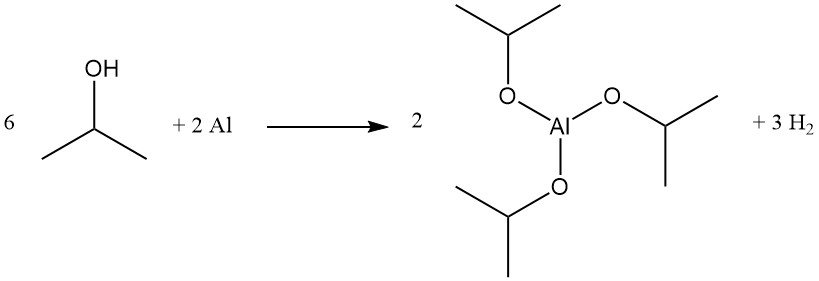
Diese Verbindung ist ein wirksames Meerwein-Ponndorf-Verley-Reduktionsmittel für bestimmte Esteraustausch- und Carbonylreduktionsreaktionen und wird als Vorstufe für Aluminiumglycinat, ein Puffermittel, verwendet.
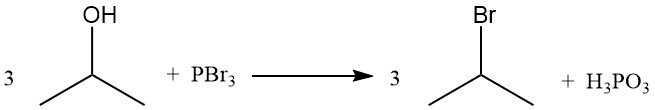
Isopropylhalogenide, wie Isopropylbromid, werden durch die Verdrängung der Hydroxygruppe durch Reaktion mit Halogenwasserstoffen gewonnen. Durch Rückfluss von Isopropylalkohol mit Bromwasserstoffsäure entstehen Isopropylbromid und Wasser:
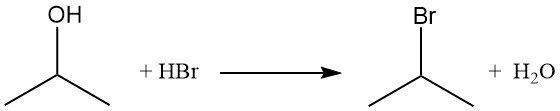
Die Reaktivitätsreihenfolge mit Halogenwasserstoffen ist HI > HBr > HCl. Die Reaktion mit Salzsäure zu Isopropylchlorid wird durch die Anwesenheit von Zinkchlorid katalysiert.
Isopropylalkohol kann deprotoniert werden, um Isopropoxidsalze zu bilden, die als starke, nicht-nukleophile Basen in der organischen Synthese weit verbreitet sind.
In katalytischen Transferhydrierungsreaktionen wird es als terminales Reduktionsmittel zur Reduktion von Aldehyden, Ketonen und anderen funktionellen Gruppen eingesetzt. Dabei wird 2-Propanol zu Aceton oxidiert.
Dieser Prozess ist reversibel, und längerer Kontakt zwischen Produkt und Katalysator kann die Enantiomerenreinheit bei asymmetrischen Reduktionen verringern. Das Gleichgewicht kann durch Verwendung eines Überschusses an Isopropanol, durch destillative Entfernung von Aceton oder durch Abtrennung des reduzierten Produkts vom Reaktionsmedium in Richtung Produktbildung verschoben werden.
2.1. Dehydrierung von Isopropylalkohol
Die Dehydrierung von Isopropylalkohol ist eine wichtige industrielle Reaktion zur Herstellung von Aceton. Vor der großtechnischen Koproduktion von Aceton in Phenolherstellungsprozessen war sie die wichtigste kommerzielle Methode zur Acetonsynthese.
Der Prozess ist endotherm und benötigt 66,5 kJ/mol Wärme bei 327 °C. Er wird in der Dampfphase bei Temperaturen von 300–500 °C und moderaten Drücken um 207 kPa durchgeführt und erreicht eine Selektivität von ca. 90 % für Aceton und einen Umsatz von 98 % für 2-Propanol.
Zu den üblicherweise verwendeten Katalysatoren gehören Kupfer, Chrom, Zink und Nickel, die entweder einzeln, als Oxide oder in gemischten Formen auf inerten Materialien eingesetzt werden. Eine typische Reaktion ist:

Die Selektivität für Aceton ist hoch, jedoch entstehen durch Dehydratation, Kondensation oder Oxidation geringe Mengen an Nebenprodukten. Dazu gehören Propylen, Diisopropylether, Mesityloxid, Acetaldehyd und Propionaldehyd.
Die Reaktion kann auch in der Flüssigphase ablaufen.
Die Dehydrierung von Isopropylalkohol kann auch oxidativ mit Silber- oder Kupferkatalysatoren bei Temperaturen von 400–600 °C erfolgen. Patentierte Verfahren beschreiben die oxidative Dehydrierung in der Dampfphase zur Herstellung gemischter Ketone, darunter Aceton, Methylisobutylketon und höhere Ketone.
In einem Beispiel erzeugt die Dampfphasendehydrierung eines azeotropen Gemisches aus 2-Propanol und Wasser an einem Kupferkatalysator bei 220 °C ein Gemisch aus Aceton (52,4 %), nicht umgesetztem 2-Propanol (11,4 %), Methylisobutylketon (21,6 %), Diisobutylketon (6,5 %) und 4-Methyl-2-pentanol (2,2 %).
2.2. Oxidation von Isopropylalkohol
Isopropylalkohol wird bei 400–600 °C katalytisch mit Luft oder Sauerstoff oxidiert, wobei Aceton und Wasser entstehen:
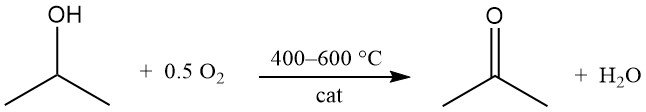
Die Katalysatoren ähneln denen in Dehydrierungsprozessen. Im Gegensatz zur Dehydrierung ist die Oxidationsreaktion stark exotherm und setzt bei 295 °C 180 kJ/mol frei. Eine sorgfältige Kontrolle der Prozessbedingungen ist erforderlich, um die Bildung von Nebenprodukten, insbesondere aus Dehydratationsvorgängen, zu begrenzen.
Oxidation und Dehydrierung können mit geeigneten Katalysatoren und Betriebsbedingungen gleichzeitig durchgeführt werden, allerdings ist die industrielle Nutzung der Oxidation zur Acetonproduktion im Vergleich zur Dehydrierung begrenzt.
Die partielle Oxidation von Isopropylalkohol kann in der Flüssigphase ohne Katalysator zur Herstellung von Wasserstoffperoxid und Aceton durchgeführt werden:
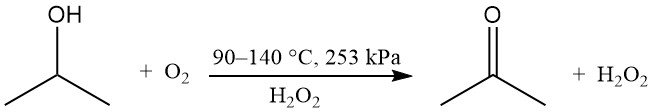
Sauerstoff oder Luft werden mit einem Peroxidinitiator wie Wasserstoffperoxid verwendet. Die Reaktionsgeschwindigkeit wird durch die Konzentration des Nebenprodukts Essigsäure beeinflusst. Das theoretische Gewichtsverhältnis von Aceton zu Wasserstoffperoxid beträgt 1,7. Dieses Verfahren wird angewendet, wenn Wasserstoffperoxid das gewünschte Produkt ist, während Aceton und nicht umgesetztes Isopropanol recycelt werden.
Im Shell-Verfahren wird das so hergestellte Wasserstoffperoxid zur Oxidation von Allylalkohol zu Acrolein verwendet, während es im Burmah-Oil-Verfahren zu Peressigsäure umgewandelt wird.
2-Propanol reagiert auch mit α,β-ungesättigten Aldehyden oder Ketonen an Metalloxidkatalysatoren bei erhöhten Temperaturen. In einem Shell-Verfahren zur Allylalkoholherstellung wird ein Dampfphasengemisch aus Isopropanol und Acrolein bei 400 °C über unkalziniertes Magnesiumoxid und Zinkoxid geleitet, um etwa 77 % Allylalkohol (bezogen auf Acrolein) zu erhalten.
2.3. Veresterung von Isopropylalkohol
Isopropylalkohol verestert mit Carbonsäuren in Gegenwart saurer Katalysatoren wie p-Toluolsulfonsäure. Die Reaktion wird typischerweise bei 100–160 °C und Normaldruck durchgeführt, wobei ein Alkoholüberschuss eingesetzt wird, um das Gleichgewicht in Richtung Esterbildung zu verschieben.
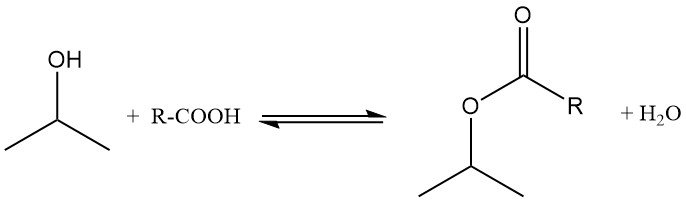
Das während der Reaktion entstehende Wasser wird als Azeotrop entfernt, um das Gleichgewicht zu verschieben. Überschüssiges Isopropanol wird destilliert und recycelt, und die Esterausbeute erreicht nahezu quantitative Werte. Beispielsweise wird Isopropylacetat aus Isopropanol und Essigsäure in Gegenwart von Schwefelsäure hergestellt, wobei Toluol als Azeotropbildner verwendet wird.
Kinetische Studien wurden zur Veresterung von Isopropanol mit verschiedenen organischen Säuren unter Verwendung sulfonierter Kationenaustauscherharze durchgeführt. Die Reaktion mit Myristinsäure ergibt Isopropylmyristat, ein Weichmacher und Gleitmittel, das in Kosmetika und topischen Arzneimitteln verwendet wird. Eine gelierte Form dieses Esters wird als Estergel vermarktet.
Isopropylalkohol reagiert mit Schwefelkohlenstoff zu Xanthatestern. Natriumisopropylxanthat wird in Mineralflotationsprozessen und als Herbizid im Bohnen- und Erbsanbau eingesetzt.
Bei der Reaktion von 2-Propanol mit Phosphorhalogeniden entstehen Phosphitester. Triisopropylphosphit wird aus Phosphortrichlorid und Isopropylalkohol bei niedrigen Temperaturen in Gegenwart eines Säurefängers wie Pyridin gewonnen:
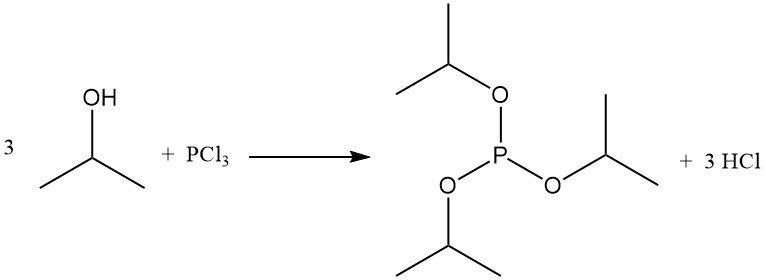
Titantetrachlorid reagiert mit Isopropanol zu Tetra(isopropyl)titanat, einem kommerziellen Polymerisationskatalysator.
Isopropylnitrat wird durch die Reaktion von Isopropanol mit Salpetersäure hergestellt. Die Reaktanten werden getrennt in eine Destillationsanlage geleitet und das Produkt kontinuierlich durch Destillation entfernt.
Isopropylnitrat wird als Startkraftstoff und in Sprengstoffen verwendet. Der Nitritester Isopropylnitrit wird bei Raumtemperatur aus Isopropanol und entweder Nitrosylchlorid oder salpetriger Säure gebildet und dient als Treibstoff für Düsentriebwerke.
2.4. Veretherung von Isopropylalkohol
Isopropylalkohol kann in der Flüssigphase über stark sauren Katalysatoren wie Schwefelsäure oder in der Dampfphase über saurem Aluminiumoxid dehydratisiert werden, wobei entweder Diisopropylether (DIPE) oder Propylen entsteht.
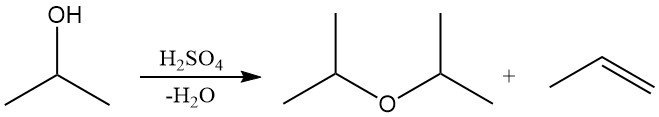
Die Selektivität für DIPE oder Propylen hängt von der Wahl des Katalysators und den Reaktionsbedingungen ab. Industriell fällt DIPE hauptsächlich als Nebenprodukt bei der Isopropylalkoholproduktion an. Überschüssiges DIPE wird häufig über saure Katalysatoren recycelt, um Isopropylalkohol durch Hydratisierung zu regenerieren. DIPE wird in begrenzten Mengen als Lösungsmittel und in industriellen Extraktionsprozessen eingesetzt.
Der US Clean Air Act von 1990, der die Verwendung von Oxygenaten in Benzin vorschrieb, schuf eine potenzielle Nachfrage nach DIPE als Kraftstoff-Oxygenat. DIPE kann durch Reaktion von Isopropylalkohol mit Propylen über sauren Ionenaustauschkatalysatoren bei niedrigen Temperaturen synthetisiert werden.
Glykolether können auch aus Isopropylalkohol durch Reaktion mit Olefinoxiden wie Ethylenoxid oder Propylenoxid hergestellt werden. Beispielsweise ergibt die Reaktion mit Ethylenoxid 2-Isopropoxyethanol (kommerziell bekannt als Isopropylcellosolve), typischerweise katalysiert durch Alkalihydroxide. Durch sekundäre Alkoxylierung des Ausgangsprodukts mit zusätzlichem Olefinoxid entstehen höher alkoxylierte Derivate (Oligomere). Diese Konkurrenzreaktion ist besonders bei Verwendung von Ethylenoxid von Bedeutung, da die entstehende terminale primäre Hydroxygruppe reaktiver ist.
Glykolether aus Isopropylalkohol werden als Lösungsmittel in Lacken, Emaillen und wasserbasierten Beschichtungen eingesetzt, um Glanz, Verlauf und Filmeigenschaften zu verbessern.
2.5. Aminierung von Isopropylalkohol
Isopropylalkohol wird durch Ammonolyse mit Dehydratisierungskatalysatoren oder durch reduktive Ammonolyse mit Hydrierungskatalysatoren aminiert. Beide Methoden erzeugen Isopropylamin und Diisopropylamin. Triisopropylamin wird nur in vernachlässigbaren Mengen gebildet.
Das Verhältnis von Mono- zu Diisopropylamin hängt vom Molverhältnis von Isopropylalkohol zu Ammoniak ab, das typischerweise zwischen 2:1 und 5:1 liegt.
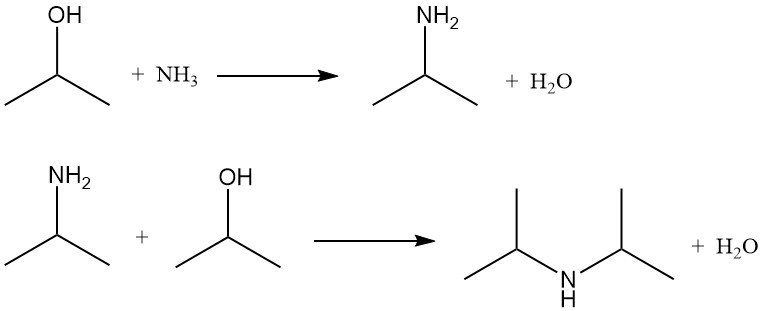
Bei der reduktiven Ammonolyse ist Wasserstoff vorhanden, um die Katalysatorlebensdauer zu verlängern, indem er Verkokung und Teerbildung verhindert, wird aber nicht nennenswert verbraucht. Die Reaktionen werden üblicherweise bei 150–250 °C und 790–2860 kPa in einem Festbettreaktor mit Katalysatoren aus Kupfer, Chrom oder Nickel auf Aluminiumoxid durchgeführt.
Der Umsatz von Isopropylalkohol liegt bei über 85 %, und die Aminausbeute beträgt über 90 %. Nebenprodukte wie Nitrile und Amide werden zur Verbesserung der Ausbeute recycelt.
Die direkte Ammonolyse mit Dehydratationskatalysatoren wird bei 300–500 °C und ähnlichen Drücken durchgeführt. Als Katalysatoren werden Aluminiumoxid, Siliciumdioxid, Titandioxid und Aluminiumphosphat verwendet. Die Ausbeute liegt bei über 80 %, bei minimaler Verkokung und Nitrilbildung, die Kontrolle über die Aminzusammensetzung ist jedoch eingeschränkt.
Isopropylamin wird hauptsächlich in der Herbizidproduktion, insbesondere für 2-Chlor-4-ethyl-6-isopropylamino-s-triazin, und in geringerem Umfang in der Pestizidproduktion eingesetzt. Diisopropylamin wird in Pestiziden und als Korrosionsinhibitor, beispielsweise als Diisopropylammoniumnitrat, eingesetzt.
2.6. Halogenierung von Isopropylalkohol
2-Halogenpropan-Derivate können aus Isopropylalkohol durch Reaktion mit dem entsprechenden Säurehalogenid synthetisiert werden. Dies ist die wirtschaftlichste Methode. Phosphorhalogenide und elementare Halogene können unter geeigneten Bedingungen ebenfalls reagieren, um die Hydroxygruppe zu ersetzen und das Halogenid zu bilden.
Die Halogenierung in wässriger Lösung geht mit einer Oxidation einher. Chlorierung bei 65 °C führt zu Chloracetonderivaten, hauptsächlich 1,3-Dichloraceton und 1,1,3-Trichloraceton. Weitere Chlorierung bei 70–100 °C führt zu einer fast vollständigen Umwandlung in höher chlorierte Produkte, darunter 1,1,1,3,3-Pentachloraceton und Hexachloraceton.
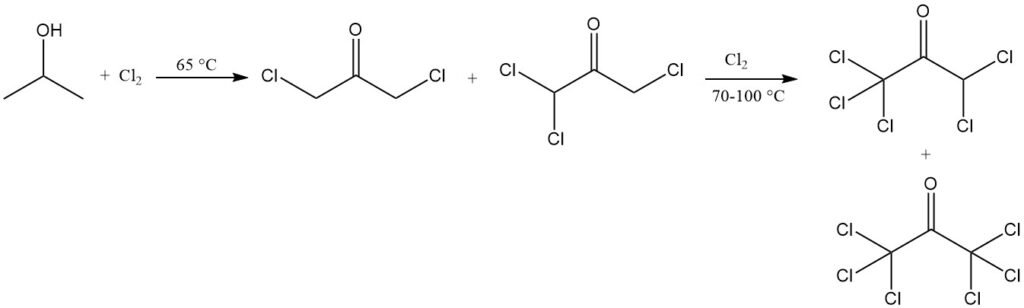
Die Chlorierung von Isopropanol unter bestimmten Bedingungen kann 1,1,1,3-Tetrachloraceton ergeben, das wiederum zu 1,1,1-Trichlor-2,3-epoxypropan, einem Zwischenprodukt für Agrar- und Pharmachemikalien sowie schwer entflammbare Kunststoffe, umgewandelt werden kann.
2.7. Verschiedene Reaktionen von Isopropanol
Isopropylalkohol wird mit Keten acyliert, wodurch Isopropylacetat entsteht:
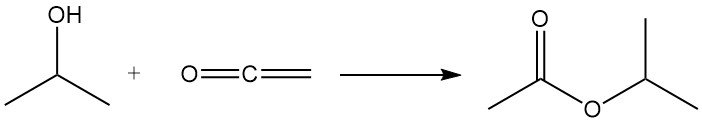
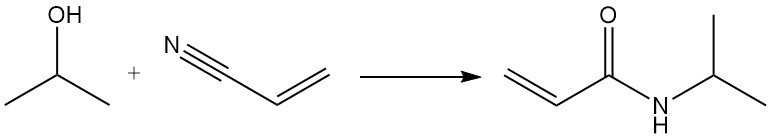
Die Ritter-Reaktion von Isopropanol mit Acrylnitril ergibt N-Isopropylacrylamid:
Isopropylalkohol kann auch mit aromatischen Verbindungen wie Toluol und Phenol zu isopropoxylierten Derivaten kondensieren, die als Zwischenprodukte bei der Synthese von Harzen, Tensiden und Spezialchemikalien verwendet werden.
3. Industrielle Herstellung von Isopropanol
Isopropylalkohol wird industriell in zwei Hauptverfahren hergestellt: der indirekten und der direkten Hydratisierung von Propen. Kleinere Mengen werden durch Hydrierung von Aceton gewonnen.
Die industrielle Herstellung von Isopropylalkohol begann 1920 im petrochemischen Werk von Standard Oil (Exxon) in Bayway, New Jersey. 1921 nahm Union Carbide (Carbide and Carbon Chemicals Corporation) die Produktion in Clendenin, West Virginia, auf. Die Shell Oil Company nahm in den 1930er Jahren ihren Betrieb in Dominguez, Kalifornien, auf. Diese Unternehmen blieben bis Mitte der 1990er Jahre die wichtigsten US-Produzenten.
Das indirekte Hydratisierungsverfahren, auch Schwefelsäureverfahren genannt, war bis 1951 das einzige kommerzielle Verfahren, bis Imperial Chemical Industries (ICI) das erste kommerzielle direkte Hydratisierungsverfahren in Betrieb nahm.
Beide Verfahren verwenden Propylen und Wasser als Ausgangsstoffe. Das indirekte Verfahren kann C3-Raffinerie-Abgasströme mit 40–60 Gew.-% Propylen verarbeiten und eignet sich daher für die Integration in US-Raffinerien. Die direkte Hydratisierung wurde entwickelt, um die mit dem indirekten Verfahren verbundenen Probleme wie Korrosion, hohen Energieverbrauch und Luftemissionen zu überwinden; sie erfordert jedoch hochreines Propylen.
Weitere potenzielle Syntheseverfahren sind die Fermentation von Kohlenhydraten, die Oxidation von Propan und die Hydrolyse von Isopropylacetat. Von diesen ist die Hydrierung des Nebenprodukts Aceton aus der Phenolproduktion das einzige alternative Verfahren von kommerzieller Bedeutung.
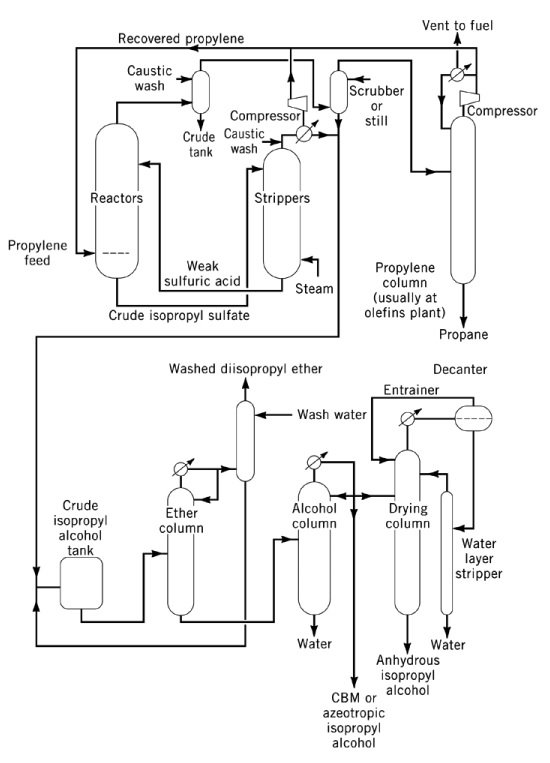
3.1. Herstellung von Isopropanol durch indirekte Hydratisierung von Propylen
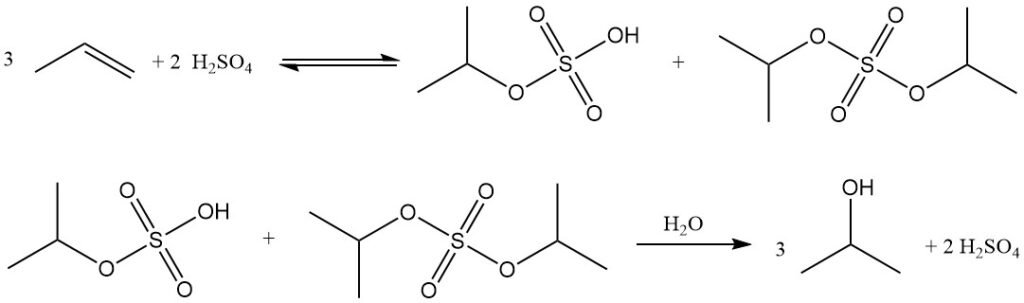
Die indirekte Hydratisierung von Propylen zu Isopropylalkohol ist ein zweistufiger Prozess mit konzentrierter Schwefelsäure als Katalysator. Im ersten Schritt erfolgt die Veresterung zu Sulfatestern, hauptsächlich Isopropylhydrogensulfat, sowie geringen Mengen Diisopropylsulfat. Im zweiten Schritt entsteht durch Hydrolyse dieser Ester Isopropanol und die Schwefelsäure wird regeneriert.
Das wichtigste Nebenprodukt dieses Prozesses ist Diisopropylether (DIPE), der durch die Reaktion intermediärer Sulfatester mit Isopropanol entsteht. Weitere Nebenprodukte sind Aceton (aus der thermischen Zersetzung von Sulfatestern), Mesityloxid, Propylenoligomere (Dimere, Trimere) und Nebenalkohole wie Ethanol, 2-Butanol und n-Propanol aus Verunreinigungen im Ausgangsmaterial.
Schwefelhaltige Verbindungen in Kombination mit ungesättigten Oligomeren können unangenehme Gerüche verursachen, die durch optimierte Reaktionsbedingungen und Nachbehandlung mit Metallen wie Kupfer oder Nickel gemildert werden.
Die Reaktion wird bei 0,7–2,8 MPa und 20–80 °C unter Verwendung von Schwefelsäurekonzentrationen über 60 Gew.-% durchgeführt. Zwei Betriebsarten sind üblich:
- Das Starksäureverfahren ist ein zweistufiger Prozess mit über 80 Gew.-% H2SO4 bei 1–1,2 MPa und 20–30 °C.
- Das Schwachsäureverfahren ist ein einstufiger Prozess mit 60–80 Gew.-% H2SO4 bei ca. 2,5 MPa und 60–65 °C.
Beide Verfahren erreichen eine Selektivität von über 98 % für 2-Propanol und DIPE.
Das Hydrolysat wird gestrippt, wobei ein Gemisch aus Isopropanol, DIPE und Wasser als Kopfprodukt sowie verdünnte Schwefelsäure als Sumpfprodukt entsteht. DIPE wird in der Regel zur Hydratisierung in den Reaktor zurückgeführt. Nach der Destillation wird feuchtes Isopropanol (87 Gew.-%, 91 Vol.-%) mit einem Propylenumsatz von über 93 % erhalten. Die abschließende Dehydratation zu wasserfreiem Isopropanol erfolgt durch azeotrope Destillation mit DIPE oder Cyclohexan als Schleppmittel.
Der Korrosionsschutz erfordert Stahlreaktoren für konzentrierte Säure bei mittleren Temperaturen und Edelstahl, Tantal oder Hastelloy für verdünnte Säure bei höheren Temperaturen. Hochreiner Isopropylalkohol bzw. Isopropylalkohol in Essenzqualität wird durch Nachbehandlung über Aktivkohle, Molekularsieben oder metallhaltigen Festbetten hergestellt, gefolgt von einer abschließenden Destillation in Nichteisenanlagen.
Die indirekte Hydratisierung ist in den USA nach wie vor das wichtigste kommerzielle Verfahren und wird auch von mehreren europäischen und japanischen Herstellern praktiziert.
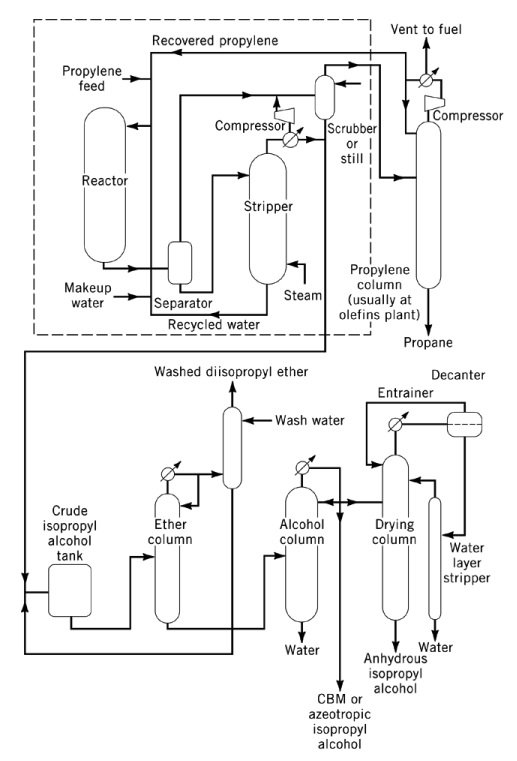
3.2. Herstellung von Isopropanol durch direkte Hydratisierung von Propylen
Die direkte Hydratisierung von Propylen zu 2-Propanol ist eine säurekatalysierte, exotherme Reaktion mit einer Reaktionswärme von −50 kJ/mol. Thermodynamisch begünstigen hohe Drücke und niedrige Temperaturen die Bildung von Isopropylalkohol, obwohl die meisten Katalysatoren mittlere bis hohe Temperaturen benötigen, um kommerzielle Ausbeuten zu erzielen.
Kommerzielle Direkthydratationsverfahren werden in drei Haupttypen eingeteilt: Dampfphasenhydratation, gemischte Dampf-Flüssigphasenhydratation und Flüssigphasenhydratation.
In Dampfphasenverfahren, wie den Veba-Chemie- und ICI-Verfahren, werden Propylen und Wasserdampf über einen sauren Festbettkatalysator geleitet. Das Veba-Chemie-Verfahren verwendet Phosphorsäure auf Siliciumdioxid bei 240–260 °C und 2,5–6,6 MPa und erreicht eine Selektivität von 96 % bei 5–6 % Umsatz pro Durchgang.
Das ICI-Verfahren verwendet einen Wolframoxid-Zinkoxid-Katalysator auf Siliciumdioxid bei 230–290 °C und 20,3–25,3 MPa. In beiden Fällen erfordern die hohe Temperatur und der niedrige Druck die Umwandlungsgrenze und erfordern daher ein umfangreiches Propylenrecycling. Die Anforderungen an die Reinheit der Ausgangsstoffe liegen typischerweise bei etwa 99 Gew.-%.
Die von der Deutsche Texaco AG entwickelte gemischte Dampf-Flüssigphasenhydratation wird in einem Rieselbettreaktor mit einem Sulfonsäure-Kationenaustauscherharz-Katalysator durchgeführt. Die Reaktion läuft bei 130–160 °C und 8–10 MPa mit einem Propylen-Wasser-Molverhältnis von 1:12–15 ab.
Dieses Verfahren erreicht einen Umsatz von über 75 % pro Durchgang und eine Selektivität von 93 %, wenn die Ausgangsstoffreinheit mindestens 92 Gew.-% beträgt. Als Nebenprodukte entstehen während der Reaktion etwa 5 % Diisopropylether (DIPE) und geringe Mengen höherer oligomerer Alkohole. Die Katalysatorlebensdauer beträgt im Normalbetrieb mehr als acht Monate.
Die von Tokuyama Soda entwickelte Flüssigphasenhydratation verwendet einen schwach sauren wässrigen Silicowolframat-Katalysator bei 270 °C und 20,3 MPa. Das Verfahren erreicht einen Umsatz von 60–70 % pro Durchgang bei einer Selektivität von 98–99 Mol-%.
Der Katalysator wird mit minimalem Verlust recycelt, und das Verfahren weist geringe Korrosion und vernachlässigbare Emissionen auf. Die Reinheit des Ausgangsmaterials beträgt 95 Gew.-% oder mehr. Das durch azeotrope Destillation gewonnene Rohisopropanol enthält 88 Gew.-% Isopropanol und wird anschließend auf eine Reinheit von über 99,99 % gereinigt.
Die in der Direkthydratation verwendeten Katalysatoren sind starke Säuren, die Propylen zu einem sekundären Carbokation protonieren können. Beispiele hierfür sind Phosphorsäure auf Träger, Wolframoxid, Molybdatophosphorsäure, Titanoxid, Zinkoxid, Zirkoniumoxid, Silicowolframate, Molybdänoxalat und verschiedene Zeolithe.
Stark saure Ionenaustauscherharze werden für den Betrieb bei mittleren Temperaturen bevorzugt. Bestimmte Polysäureanionen wie Phosphormolybdat und Phosphorwolframat erhöhen nachweislich die Hydratationsraten im Vergleich zu Sulfat oder Phosphat, möglicherweise aufgrund spezifischer Ionenassoziationseffekte mit dem Carbokation.
Der Reaktionsmechanismus beinhaltet die Protonierung von Propylen zur Bildung eines sekundären Carboniumions, gefolgt vom nukleophilen Angriff von Wasser zu protoniertem Isopropylalkohol, der anschließend zum Neutralalkohol deprotoniert. Die Reaktionsgeschwindigkeit ist proportional zur Hydroniumionenkonzentration und unabhängig vom Gegenanion, obwohl Polysäureanionen die Geschwindigkeit beschleunigen können.
Aus thermodynamischer Sicht ist die Gleichgewichtskonstante in der Dampfphase durch log K = 2624/T- 7,584 gegeben, und in der Flüssigphase beträgt die freie Standardenergie ΔF° = 23,25T- 9352 (T in K).
Niedrige Temperaturen reduzieren die DIPE-Bildung, die Katalysatoraktivität setzt jedoch eine praktische Untergrenze. Hohe Drücke erhöhen die Alkoholkonzentration und reduzieren den Bedarf an umfangreichem Propylenrecycling.
3.3. Herstellung von Isopropanol durch Hydrierung von Aceton
Die Hydrierung von Aceton wird in den USA, Russland, Asien und Südamerika eingesetzt. Das Verfahren kann in der Flüssigphase an einem Festbett-Raney-Nickel-Katalysator durchgeführt werden und erreicht eine Selektivität von 99,9 % und einen Umsatz von 99,9 % Aceton.
Alternativ führt die Hydrierung an einem Kupferoxid-Chromoxid-Katalysator bei 120 °C und 196 kPa zu niedrigeren Selektivitäten von etwa 98 % und Umsätzen von etwa 94 %. Hochreines Aceton wird für dieses Verfahren nicht benötigt, was es besonders vorteilhaft in Anlagen macht, in denen überschüssiges Aceton als Nebenprodukt entsteht, wie beispielsweise im Cumol-Phenol-Prozess.
4. Anwendungen von Isopropanol
Isopropylalkohol (2-Propanol) wird hauptsächlich als industrielles Lösungsmittel, chemisches Zwischenprodukt und Antiseptikum verwendet.
4.1. Verwendung von Isopropylalkohol in der chemischen Industrie
Zu den wichtigsten chemischen Derivaten von Isopropanol gehören Methylisobutylketon (MIBK), Methylisobutylcarbinol (MIBC), Diisobutylketon (DIBK) und Isopropylacetat. 2-Propanol ist auch ein Ausgangsstoff für die Herstellung von Isopropylaminen, die zur Herstellung von Herbiziden und Pestiziden verwendet werden. Ein Teil des Diisopropylamins wird zur Synthese von Diisopropylammoniumnitrat, einem Korrosionsinhibitor, verwendet.
Die Verwendung von Isopropylalkohol zur Acetonherstellung ist aufgrund der zunehmenden Verbreitung des Cumoloxidationsprozesses deutlich zurückgegangen.
4.2. Verwendung von Isopropylalkohol als Lösungsmittel
Als Lösungsmittel verfügt Isopropylalkohol über ausgewogene alkoholische, wasser- und kohlenwasserstoffähnliche Eigenschaften und eignet sich daher gut zum Lösen von Ölen, Gummis, Wachsen, Harzen und Alkaloiden. Es wird zur Herstellung von Zementen, Grundierungen, Lacken, Farben, Druckfarben, Beschichtungen und in Extraktionsprozessen verwendet.
In Kosmetika und Körperpflegeprodukten wird es als Lösungsmittel für Lotionen, Parfüms, Shampoos, Hautreiniger, Nagellacke, Make-up-Entferner, Deodorants und Körperöle verwendet. Duftstoffe überdecken den Geruch.
Aerosolformulierungen mit Isopropylalkohol umfassen Haarsprays, Reinigungsmittel, Insektizide, Autoenteiser, Lufterfrischer, Desinfektionsmittel sowie verschiedene Haushalts- und Industriesprays.
4.3. Medizinische Verwendung von Isopropylalkohol
Im pharmazeutischen Sektor wird Isopropylalkohol als Prozesslösungsmittel sowie als aktives Antiseptikum und Desinfektionsmittel im Haushalt, im Krankenhaus und in der Industrie eingesetzt. Er ist wirksamer als Ethanol zur mikrobiellen Kontrolle und wird häufig in 70%igen wässrigen Lösungen als Reinigungsalkohol verwendet.
Es ist auch in medizinischen Einreibungen, Tinkturen, Kopfhauttonika, chirurgischen Nahtbädern und Verbandlösungen sowie in Formulierungen wie Jodtinktur und Grüner Seife enthalten.
4.4. Weitere Verwendungen
Hochreiner Isopropylalkohol (99,99 %) wird in der Elektronikindustrie zur Reinigung von hochintegrierten Bauelementen (LSI) und Siliziumwafern verwendet. Weitere Anwendungen sind die Verwendung als Oktanzahlverbesserer, Vergaser-Enteisungszusatz und Co-Lösungsmittel mit Methanol in Benzinmischungen.
In Extraktionsprozessen werden wässrige Isopropylalkohollösungen zur Flüssig-Flüssig-Extraktion von Fettsäuren aus Pflanzenölen bei niedrigen Temperaturen eingesetzt.
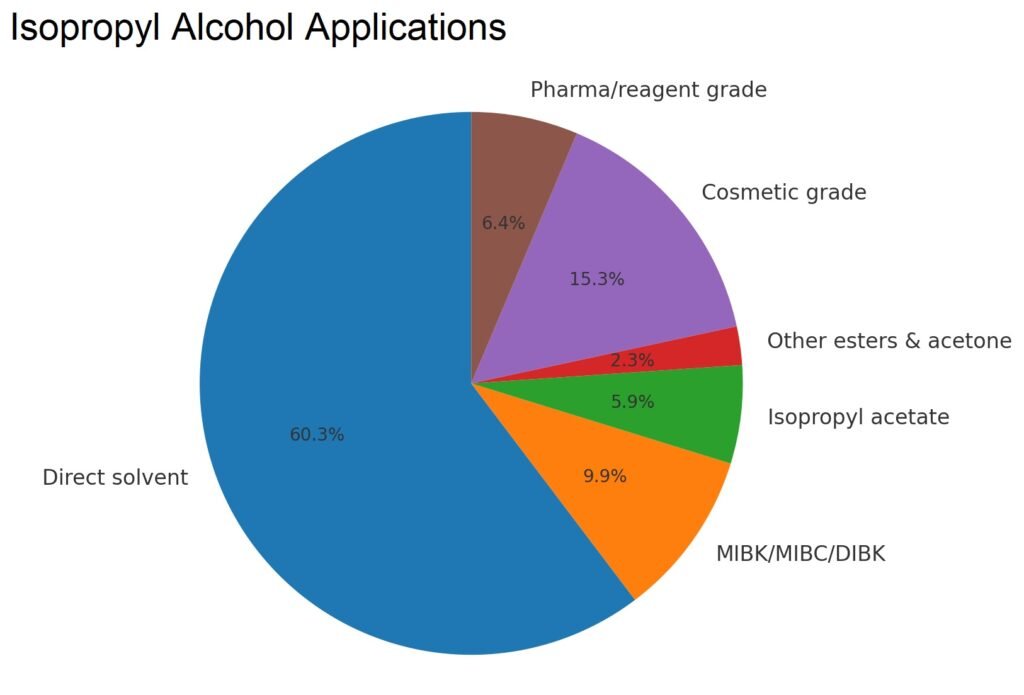
Die US-Verbrauchsdaten in Tabelle 3 zeigen die Hauptverwendung von Isopropanol in Lösungsmitteln, Beschichtungen, chemischen Derivaten, Kosmetika, Pharmazeutika und Spezialanwendungen. Die Entwicklung deutet auf einen Rückgang der Aceton- und Isopropylaminproduktion, aber eine stabile Verwendung in Kosmetika, Pharmazeutika und Hochleistungslösungsmitteln hin.
| Jahr | |||
|---|---|---|---|
| 2002 | 2008 | 2014 | |
| Direktes Lösungsmittel | 243 | 269 | 237 |
| Chemische Derivate | |||
| MIBK/MIBC/DIBK | 71 | 45 | 39 |
| Isopropylamine | 85 | 50 | – |
| Isopropylacetat | 24 | 17 | 23 |
| Andere Ester und Aceton | 17 | 17 | 9 |
| Kosmetikqualität | 52 | 56 | 60 |
| Pharma (USP-Qualität)/Reagenzqualität | 21 | 25 | 25 |
| Gesamt | 513 | 479 | 393 |
5. Toxikologie von Isopropanol
Isopropylalkohol ist in Haushalts- und Industrieprodukten weit verbreitet, darunter in Reinigungsalkohol, Desinfektionsmitteln, Reinigungsmitteln, Kosmetika, Arzneimitteln und Lösungsmitteln. Seine Toxizität ist etwa doppelt so hoch wie die von Ethanol, aber geringer als die von Methanol. Der primäre Expositionsweg ist die orale Aufnahme, seltener auch Inhalation oder dermale Exposition.
Isopropylalkohol wird nach Einnahme schnell resorbiert, wobei maximale Plasmakonzentrationen innerhalb von 30 Minuten erreicht werden. Er verteilt sich gut im Körperwasser mit einem Verteilungsvolumen von 0,45–0,55 l/kg.
Der Stoffwechsel erfolgt hauptsächlich in der Leber durch Alkoholdehydrogenase zu Aceton, Acetol, Methylglyoxal, Propylenglykol, Acetat und Formiat, mit anschließender Umwandlung in Glucose und andere Stoffwechselprodukte.
Aceton ist der Hauptmetabolit und tritt innerhalb von 15 Minuten nach Einnahme in der Atemluft auf. Die Elimination erfolgt hauptsächlich über die Nieren, wobei 20 % unverändert und der Rest als Aceton und seine Metaboliten ausgeschieden werden. Die Eliminationshalbwertszeit von Isopropylalkohol beträgt 2,5–8 Stunden, während die Elimination von Aceton mit einer Halbwertszeit von 7,7–27 Stunden langsamer ist.
Der Toxizitätsmechanismus ist vorwiegend eine Hirnstammdepression, die sowohl durch Isopropylalkohol als auch, in geringerem Maße, durch Aceton verursacht wird. Die klinischen Symptome reichen von leichter Intoxikation bis hin zu schwerer ZNS- und Atemdepression, Kreislaufkollaps, Schock und Koma. Frühe Symptome sind Ataxie, Erbrechen, Bauchschmerzen und Hämatemesis, die in schweren Fällen zu Hypotonie, Hypothermie und Reflexverlust fortschreiten.
Im Gegensatz zu Methanol und Ethylenglykol verursachen Isopropylalkohol und Aceton keine metabolische Azidose mit großer Anionenlücke, sondern Ketonämie, Ketonurie und eine erhöhte osmolare Lücke. Charakteristisch ist ein fruchtiger Geruch im Atem.
Die toxische Dosis von 70%igem Isopropylalkohol beträgt etwa 1 ml/kg. Die Einnahme von 100–250 ml kann tödlich sein. Der Tod tritt durch Lähmung des zentralen Nervensystems ein. Das Einatmen hoher Dampfkonzentrationen kann betäubende Wirkungen und leichte Reizungen von Augen, Nase und Rachen verursachen.
Die Arbeitsplatzgrenzwerte werden von OSHA und ACGIH auf 400 ppm (8-h-TWA) und 500 ppm (STEL) festgelegt. Die Geruchsschwelle liegt zwischen 3 und 200 ppm. Die industrielle Verwendung stellt unter normalen Bedingungen kein signifikantes Gesundheitsrisiko dar.
Tierstudien, einschließlich subchronischer Inhalation, Neurotoxizität, Entwicklungs-, Reproduktions- und Onkogenitätstests, haben keine negativen Auswirkungen gezeigt.
Die Diagnose einer Isopropanolvergiftung basiert auf der Expositionsgeschichte, klinischen Befunden und Laborergebnissen, die eine osmolare Lücke mit Ketose ohne metabolische Azidose zeigen. Die Messung des Serum-Isopropylalkoholspiegels kann die Exposition bestätigen, ist aber nicht immer verfügbar. Die Behandlung einer Isopropanolvergiftung dient in erster Linie der Aufrechterhaltung der Vitalfunktionen, einschließlich Atemwegsschutz, kardiovaskulärer Stabilisierung (um einer möglichen Hypotonie entgegenzuwirken) und Überwachung des Säure-Basen- und Elektrolythaushalts des Patienten. Aktivkohle ist bei dieser Art von Vergiftung wirkungslos und wird daher nicht empfohlen.
Hämodialyse verbessert die Elimination von Isopropylalkohol und Aceton, ist aber in der Regel schweren, lebensbedrohlichen Fällen mit starker Hypotonie, Koma oder sehr hohen Serumkonzentrationen vorbehalten. Die meisten Patienten erholen sich mit sofortiger unterstützender Behandlung vollständig.
Referenzen
- Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
- Logsdon, J.E. and Loke, R.A. (2000). Isopropyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0919151612150719.a01
- Jolliff, H.A. (2017). Isopropyl Alcohol. In: Brent, J., et al. Critical Care Toxicology. Springer, Cham. https://doi.org/10.1007/978-3-319-17900-1_53
- Co, I. N.; Gunnerson, K. J. Chapter 71 – Iatrogenic and Poison-Derived Acid Base Disorders. In Critical Care Nephrology, 3rd ed.; Ronco, C., Bellomo, R., Kellum, J. A., Ricci, Z., Eds.; Elsevier, 2019; pp 417-423.e2. DOI: 10.1016/B978-0-323-44942-7.00071-6
- Gwaltney-Brant, S. M. Chapter 24 – Miscellaneous Indoor Toxicants. In Small Animal Toxicology, 3rd ed.; Peterson, M. E., Talcott, P. A., Eds.; W.B. Saunders, 2013; pp 291-308. DOI: 10.1016/B978-1-4557-0717-1.00024-7
- Slaughter, R. J., Mason, R. W., Beasley, D. M. G., Vale, J. A., & Schep, L. J. (2014). Isopropanol poisoning. Clinical Toxicology, 52(5), 470–478. https://doi.org/10.3109/15563650.2014.914527
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Chemical Agents and Related Occupations. Lyon (FR): International Agency for Research on Cancer; 2012. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 100F.) ISOPROPYL ALCOHOL MANUFACTURE BY THE STRONG-ACID PROCESS. Available from: https://www.ncbi.nlm.nih.gov/books/NBK304434/
- Carls, R.-R.; Osterburg, G.; Prezelj, M.; Webers, W. „Process for the production of isopropyl alcohol.“ U.S. Patent 4,760,203, 1988. Available from: https://patents.google.com/patent/US4760203A/en
- Hirata, S.; Ogawa, S. „Process for producing isopropyl alcohol.“ U.S. Patent 5,763,693, 1998. Available from: https://patents.google.com/patent/US5763693A/en
- Gershbein, L. L.; Pines, H.; Ipatieff, V. N. „Reactions of Isopropyl Alcohol in the Presence of Catalysts Containing Magnesium Oxide.“ J. Am. Chem. Soc., 1947, 69 (11), 2888–2893. DOI: 10.1021/ja01203a074
