Hydrochinon: Herstellung, Reaktionen und Verwendungen
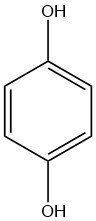
Die Entdeckung von Hydrochinon geht auf das Jahr 1844 zurück, als WOEHLER erstmals über seine Existenz berichtete. Es ist ein farbloser kristalliner Feststoff, der durch Zugabe von Wasserstoff zu 1,4-Benzochinon synthetisiert wird.
Hydrochinon kommt in der Natur auch als Hydrochinon-b-D-glucopyranosid (Arbutin) in verschiedenen Pflanzen wie Bärentraube, Preiselbeere, Preiselbeere und bestimmten Birnenarten vor, oft zusammen mit seinem Methylether Methylarbutin.
Unter heißen, verdünnten wässrigen Säurebedingungen wird Arbutin leicht zu Hydrochinon und Glucose hydrolysiert. Ebenso führt die Hydrolyse von Methylarbutin zur Bildung von Hydrochinonmonomethylether und Glucose.
Inhaltsverzeichnis
1. Herstellung von Hydrochinon
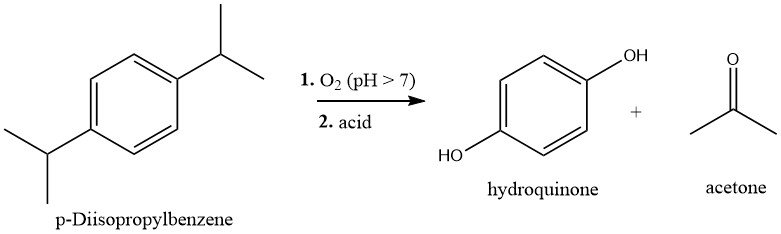
p-Diisopropylbenzol (p-DIPB) wird durch Friedel-Crafts-Alkylierung von Benzol mit Propen synthetisiert. Das resultierende p-DIPB wird gereinigt und dann mit Luft unter leicht alkalischen Bedingungen bei 80–90 °C oxidiert, um Dihydroperoxid (DHP) zu bilden.
Das DHP kann aus der Reaktionsmischung extrahiert oder durch Kristallisation gewonnen und anschließend durch eine säurekatalysierte Hock-Umlagerung zu Hydrochinon und Aceton gespalten werden. Bei diesem Verfahren wird die DHP-Lösung mit einem Schwefelsäurekatalysator (0,2–1,0 %) bei 60–80 °C behandelt. Anschließend wird das Hydrochinon isoliert und kristallisiert.
Die Gesamtausbeute an Hydrochinon, bezogen auf p-DIPB, beträgt etwa 80 %.
1.2. Hydroxylierung von Phenol
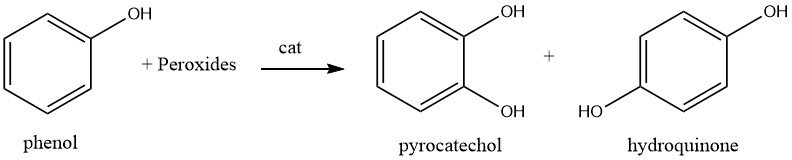
Die Hydroxylierung von Phenol mit Wasserstoffperoxid bei einer Temperatur von etwa 80 °C und einem Katalysator wie einer starken Mineralsäure, Eisen(II)- oder Kobalt(II)-Salz führt zu einer Mischung aus Hydrochinon und Brenzkatechin. Das Verhältnis von Brenzcatechin zu Hydrochinon kann von 3:1 bis 0,1:1 variiert werden, mit einem typischen Verhältnis von 1,5:1, wobei Brenzkatechin das Hauptprodukt ist.
Der Reaktionsmechanismus ist ionischer Natur, wobei Wasserstoffperoxid durch den starken Säurekatalysator polarisiert und Phenol anschließend hydroxyliert wird. Die resultierenden Isomere werden durch eine Reihe von Extraktionen und Lösungsmittelentfernungsvorgängen getrennt.
Das Verhältnis von Hydrochinon- und Catecholprodukten kann durch die Anwesenheit von Supersäuren oder formselektiven Zeolithen beeinflusst werden. Beispielsweise führte die Verwendung eines Vanadium-modifizierten Nafion-Perfluorsulfonat-Polymers bei der Oxidation von Phenol zu einem Hydrochinon-Brenzcatechin-Verhältnis von 12,5:1.
Der Einsatz eines formselektiven Zeoliths bei der Hydroxylierung von Phenol führte zu einer Hydrochinon-Selektivität von 99 %.
1.3. Oxidation von Anilin
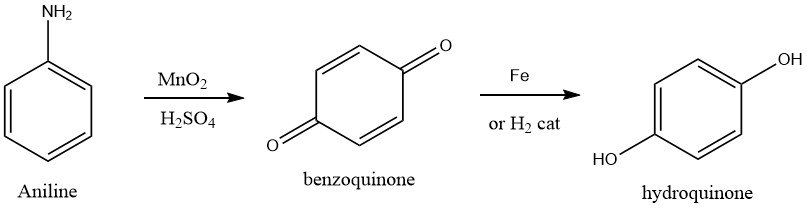
Die Herstellung von Hydrochinon erfolgte in der Vergangenheit durch Anilinoxidation, die als ältestes bekanntes Verfahren gilt. Um dies zu erreichen, wird Anilin mit einem 15–20 %igen Überschuss an Mangandioxid in einer wässrigen Schwefelsäurelösung oxidiert, die auf 0–5 °C gehalten wird.
Bei dieser Reaktion entsteht p-Benzochinon, das durch Dampfstrippen vom Reaktionsgemisch abgetrennt und gesammelt wird. Bei der Reaktion entsteht als Nebenprodukt Mangansulfat, das aus der abgereicherten Reaktionsmischung gewonnen und für landwirtschaftliche Zwecke verkauft werden kann.
Hydrochinon wird dann aus dem p-Benzochinon-Zwischenprodukt durch Reduktion mit Eisen bei 55–65 °C oder durch katalytische Hydrierung gewonnen. Typischerweise wird das technische Produkt kristallisiert, durch Zentrifugieren aus dem wässrigen Strom isoliert und mithilfe eines Vakuumtrockners getrocknet. Die Gesamtausbeute an Hydrochinon aus Anilin beträgt etwa 85 %.
Die Anilinoxidation ist ein diskontinuierlicher Prozess und daher relativ arbeitsintensiv. Auch die Verarbeitungsbedingungen sind stark abrasiv, da gemahlenes Manganerz und feinteiliges Eisen verwendet werden, was eine ständige Wartung erfordert.
Die Entsorgung anorganischer Nebenprodukte, die etwa 85 % des Gesamtgewichts der Produkte ausmachen, stellt ein großes Umweltproblem dar.
1.4. Andere Prozesse
Die Baeyer-Villiger-Oxidation eines 4-Hydroxy-substituierten aromatischen Ketons ergibt Carboxylatester aromatischer Diole mit hoher Ausbeute und einem Wirkungsgrad von 97 %.
Die mikrobiologische Oxidation von Benzol oder Phenol ist hochselektiv und erzeugt Hydrochinon mit bemerkenswerter Selektivität.
Die Luftoxidation von Phenol in Gegenwart eines Kupferkatalysators liefert p-Benzochinon mit einer Selektivität von mehr als 90 %. Die Oxidation von Benzol zu Hydrochinon kann mit Kupfer(I)-chlorid oder Titan erreicht werden.
Die ozoninduzierte Oxidation von Benzol in wässrigem Medium führt zur Bildung von Hydrochinon und p-Benzochinon.
Weitere präparative Methoden umfassen die saure Hydrolyse von Nitrobenzol oder p-Nitrosophenol, die Carbonylierung von Acetylen, die elektrochemische Oxidation von Benzol oder Phenol in verdünnter Schwefelsäure mit anschließender Reduktion und die katalytische Hydrierung von Nitrobenzol in saurer Lösung.
Darüber hinaus kann p-Isopropenylphenol durch alkalisches Cracken von Bisphenol A gewonnen und anschließend mit 30 %igem wässrigem Wasserstoffperoxid unter sauren Bedingungen zu Hydrochinon umgesetzt werden.
2. Chemische Reaktionen von Hydrochinon
Die meisten Oxidationsmittel können Hydrochinon leicht in p-Benzochinon umwandeln. Sogar neutrale wässrige Lösungen von Hydrochinon verdunkeln sich, wenn sie der Luft ausgesetzt werden.
Die Geschwindigkeit der Hydrochinonoxidation durch Luft wird in einer alkalischen Lösung beschleunigt. Das Oxidationsprodukt kann mit Wasser unter Bildung von 1,2,4-Benzoltriol reagieren, und eine weitere Oxidation kann zur Bildung von Huminsäuren führen.
Das Redoxpotential E0 von Hydrochinon beträgt 699 mV, mit einem Halbwellenpotential E1/2 von 560 mV bei pH 0 und 234 mV bei pH 5–6. Durch den Verlust eines Elektrons und die Abspaltung eines Protons bei der Oxidation von Hydrochinon entsteht ein relativ stabiles Semibenzochinon-Radikal, das es Hydrochinon ermöglicht, als Antioxidans zu wirken.
Ein zweiter Ein-Elektronen-Transfer und eine Protoneneliminierung führen zur Bildung von p-Benzochinon. Der äquimolare Ladungstransferkomplex Chinhydron wird aus Hydrochinon und p-Benzochinon gebildet, wobei der Chinhydronkomplex typischerweise dunkelgrünlich-schwarz ist und einen Schmelzpunkt von 171 °C aufweist.
Hydrochinon ist ein Reduktionsmittel mit Reduktionspotential, das zur Reduktion von Silberhalogenid geeignet ist. Silberhalogenidkörner, die Licht ausgesetzt wurden, werden aufgrund von Veränderungen in den freigelegten Silberhalogenidkristallen, die die Energiebarriere für die Reaktion mit Hydrochinon unter Bildung von elementarem Silber und p-Benzochinon verringern, viel schneller reduziert als unbelichtete oder unterbelichtete Körner.
Der Entwicklungslösung wird Natriumsulfit zugesetzt, um die Bildung von Chinhydron zu verhindern, indem p-Benzochinon in Natrium-2,5-dihydroxybenzolsulfonat umgewandelt wird, ein schwächeres Entwicklungsmittel als Hydrochinon.
Die Reaktivität von Hydrochinon ähnelt im Allgemeinen der von Phenol, wobei eine oder beide Hydroxylgruppen in einen Ether oder Ester umgewandelt werden können.
Zu den kommerziell wichtigen Sauerstoffderivaten gehören Hydrochinonmonomethylether, Hydrochinondimethylether und Hydrochinon-bis(2-hydroxyethyl)ether. Hydrochinonester durchlaufen die Fries-Umlagerung, um acylsubstituierte Hydrochinone zu ergeben.
Hydrochinon und seine Ether können unter Friedel-Crafts-Bedingungen C-alkyliert werden, um eine Vielzahl mono- und disubstituierter Produkte herzustellen, darunter 2-tert-Butylhydrochinon, 2,5-Bis[2-(2-methylbutyl)]hydrochinon und 2 -tert-Butyl-4-methoxyphenol (BHA).
Hydrochinon reagiert auch mit Alkylaminen oder Arylaminen unter Bildung substituierter Arylamine, einschließlich p-N-Methylaminophenol (normalerweise als Sulfatsalz vermarktet) und N,N‘-Diphenyl-p-phenylendiamin.
Hydrochinon kann mit Chlor oder Sulfurylchlorid chloriert werden, um mono- bis tetrachlorierte Derivate zu ergeben.
Die Kolbe-Schmitt-Carboxylierung von Hydrochinon mit Kohlendioxid führt zu 2,5-Dihydroxybenzoesäure (Gentisinsäure), während Chinizarin (1,4-Dihydroxyanthrachinon) durch Kondensation von Hydrochinon mit Phthalsäureanhydrid hergestellt werden kann.
Durch katalytische Hydrierung von Hydrochinon entsteht 1,4-Cyclohexandiol.
Die Sulfonierung von Hydrochinon führt zur Bildung von Hydrochinonmono- oder -disulfonsäure, die typischerweise als entsprechendes Kaliumsalz isoliert wird.
3. Verwendung von Hydrochinon
Hydrochinon und seine Derivate finden umfangreiche Anwendung in einer Vielzahl von Bereichen, darunter Fotografie, Gummiindustrie, Farbstoffe und Pigmente, Antioxidantien, Agrarchemikalien und andere Spezialanwendungen.
Unter diesen ergibt sich die größte Nachfrage nach Hydrochinon aus seiner Verwendung als fotografischer Entwickler, vor allem in Schwarzweißfilmen, Lithografien, fotochemischen Bearbeitungen, Mikrofilmen und Röntgenfilmen.
Viele Hydrochinonderivate, wie das Sulfatsalz von p-N-Methylaminophenol und Kalium-2,5-dihydroxybenzolsulfonat, werden auch in fotografischen Anwendungen eingesetzt.
Die Gummiindustrie ist der zweitgrößte Verbraucher von Hydrochinon zur Herstellung von Antioxidantien und Antiozonantien. Zu diesem Zweck werden insbesondere mehrere Hydrochinonderivate wie N,N’-Diaryl-p-phenylendiamine, dialkylierte Hydrochinone, N-Alkyl-p-aminophenole, Dialkyl-p-phenylendiamine und Aralkyl-p-phenylendiamine verwendet.
Hydrochinon, Hydrochinonmonomethylether und p-Benzochinon werden in der Vinylmonomerindustrie häufig verwendet, um die radikalische Polymerisation während der Verarbeitung und Lagerung zu verhindern.
In ähnlicher Weise dienen Hydrochinon und mehrere andere Derivate wie 2-tert-Butylhydrochinon, 2-Methylhydrochinon und 2,5-Di-tert-butylhydrochinon als Stabilisatoren für ungesättigte Polyesterharze.
Darüber hinaus werden bestimmte Hydrochinon-Derivate, darunter Hydrochinon-Dimethylether, Chinizarin, Chloroneb und Ethofumesat, bei der Herstellung von Farbstoffen, Pigmenten, Fungiziden und Herbiziden verwendet.
Fluazifop-butyl ist ein Beispiel für eine neue Familie von Herbiziden, die Hydrochinon als Ausgangsstoff verwenden.
Hydrochinon-bis(2-hydroxyethyl)ether, der durch die Reaktion von Hydrochinon mit Ethylenoxid entsteht, fungiert als Kettenverlängerer in duroplastischen Urethanpolymeren.
Hydrochinon und mehrere Derivate, beispielsweise die von C-alkyliertem oder C-aryliertem Hydrochinon, sind nützliche Monomere für die Herstellung einer Vielzahl von Polymeren, einschließlich Hochleistungskunststoffen, Verbundwerkstoffen und Fasern.
Mit Hydrochinonmonomeren hergestellte Materialien weisen hohe Zug- und Schlagfestigkeiten, gute Witterungsbeständigkeit, Lösungsmittelbeständigkeit, Flammhemmung, Transparenz gegenüber Mikrowellenstrahlung und Beibehaltung der Festigkeit bei erhöhter Temperatur auf.
Hydrochinon (U.S.P.-Qualität) und mehrere Derivate werden in topischen Formulierungen als Hautbleich- und Depigmentierungsmittel verwendet.
Zu den neuen Anwendungen für Hydrochinon gehören seine sauerstoffbindenden Eigenschaften, die für den Einsatz bei der Kesselwasseraufbereitung genutzt werden können.
Referenz
- Hydroquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_499
