Glykolsäure: Herstellung, Reaktionen und Verwendungen

Feste Glykolsäure ist die einfachste α-Hydroxycarbonsäure. Es bildet farblose, monokline, prismatische Kristalle. Diese Säure weist eine hohe Löslichkeit in verschiedenen Lösungsmitteln auf, darunter Wasser, Methanol, Ethanol, Aceton und Ethylacetat.
Die Flüchtigkeit von Glykolsäure ist begrenzt und die Tendenz, bei Hitzeeinwirkung zu verdampfen, ist minimal. Folglich kann es unter Vakuumbedingungen nicht effektiv destilliert werden.
Versuche, es zu destillieren, führen häufig zu einer Selbstveresterung, begleitet von Wasserverlust, was zur Bildung von Di- und Polyglykoliden führt.
Inhaltsverzeichnis
Physikalische Eigenschaften von Glykolsäure
In reiner Form ist Glykolsäure kristallisierbar und kann auch unter Vakuum nicht ohne Zersetzung destilliert werden.
Die physikalischen Eigenschaften sind folgende:
- Molmasse = 76 g/mol
- Schmelzpunkt = 78-80 °C
- Siedepunkt = 100 °C (Zersetzung)
- Dichte bei 25 °C = 1,49
- Brechungsindex (20 °C) = 1,423
- pKa = 3,81 bei 25 °C
Chemische Reaktionen von Glykolsäure
Glykolsäure weist die Fähigkeit zur Dimerisierung durch Wasserabspaltung auf, was zur Bildung eines zyklischen Diesters führt, der als 1,4-Dioxan-2,5-dion bekannt ist. Diese Diester werden aufgrund ihrer ersten Entdeckung bei Studien mit Milchsäure allgemein als Lactide bezeichnet.

Die Polymerisation von Glykolsäure durch Polykondensation ergibt Polyglykolid oder Poly(glykolsäure) (PGA), ein biologisch abbaubares und thermoplastisches Polymer. Diese als Estolidbildung bezeichnete Art der Veresterung ist nicht auf α-Hydroxycarbonsäuren beschränkt.

Ein weiteres wichtiges Merkmal von Glykolsäure ist, dass die Nähe ihrer beiden funktionellen Gruppen die dazwischenliegende(n) C-C-Bindung(en) schwächt. Folglich führt die Behandlung solcher Verbindungen mit Schwefelsäure zur Abspaltung von Ameisensäure. Bei Einwirkung von konzentrierter Schwefelsäure zersetzt sich Ameisensäure unter Bildung von Kohlenmonoxid und Wasser.
Diese Eliminierungsreaktion läuft mit hoher Effizienz ab und ist daher ein wertvolles Werkzeug für die quantitative Bestimmung von Glykolsäure.
Auch für Glykolsäure ist eine oxidative Spaltung möglich. Wenn beispielsweise Glykolsäure in Gegenwart von Eisen(II)-Ionen mit Wasserstoffperoxid behandelt wird, unterliegt sie leicht einer Kohlendioxideliminierung.
Glykolsäure kann in der Dampfphase katalytisch zu Glyoxylsäure dehydriert werden.
Wenn Glykolsäure mit PCl3 reagiert, entsteht Chloracetylchlorid (ClCH2COCl).
Produktion von Glykolsäure
Glykolsäure wird üblicherweise durch Hydrolyse von geschmolzener Monochloressigsäure unter Verwendung einer 50 %igen wässrigen Lösung von Natriumhydroxid bei Temperaturen im Bereich von 90 bis 130 °C synthetisiert.
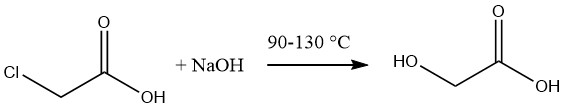
Die resultierende Glykolsäurelösung hat eine ungefähre Konzentration von 60 %, begleitet von einem Natriumchloridgehalt von 12–14 %. Die Entfernung des Salzes kann durch Eindampfen und anschließende Extraktion der Säure mit Aceton erreicht werden.
Es wurden alternative Ansätze untersucht, bei denen die Hydrolyse mit Säurekatalysatoren bei höheren Temperaturen von 150–200 °C unter Verwendung von Wasser oder Druckdampf durchgeführt wird.
Bei diesem Prozess entsteht als Nebenprodukt anstelle von Natriumchlorid Chlorwasserstoff, der durch Destillation abgetrennt werden kann. Allerdings erfordert diese Methode den Einsatz erheblicher Wassermengen, was einen erheblichen Nachteil darstellt.
In den Vereinigten Staaten umfasst die kommerzielle Produktion von Glykolsäure (von Du Pont) die Behandlung von Formaldehyd oder Trioxymethylen mit Kohlenmonoxid und Wasser in Gegenwart von Säurekatalysatoren unter Drücken von mehr als 30 MPa.

Eine weitere von Degussa bereits eingesetzte Methode ist die elektrolytische Reduktion von Oxalsäure.
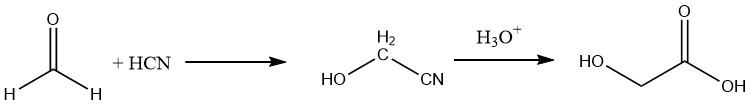
Darüber hinaus kann Glykolsäure mit einer Ausbeute von ca. 90 % durch Hydrolyse des entsprechenden Nitrils hergestellt werden, das durch Umsetzung von Formaldehyd mit Blausäure gewonnen wird.
Eine aktuelle Studie zeigt, dass Glykolsäure durch einen selektiven Oxidationsprozess von Ethylenglykol (EG) unter Verwendung hocheffizienter bimetallischer PtMn/MCM-41-Nanokatalysatoren hergestellt werden kann.
Verwendung von Glykolsäure
Glykolsäure ist im Handel in Form wässriger Lösungen mit Konzentrationen von 57 % (Hoechst) bzw. 70 % (Du Pont) erhältlich. Der weltweite jährliche Verbrauch dieser Lösungen beträgt etwa 2000–3000 Tonnen.
In verschiedenen Branchen findet Glykolsäure Anwendung beim Färben, Drucken und Knittern von Textilien. Aufgrund seiner Fähigkeit, mit Calcium(II)-Ionen Chelate zu bilden, eignet es sich besonders zur Maskierung von Entkalkungen in der Lederindustrie. Es wird auch in Alaun– und Chrombeizmitteln sowie in Pelzverarbeitungsbetrieben verwendet.
Aufgrund ihrer geringen Korrosionswirkung und bakteriziden Eigenschaften wird Glykolsäure häufig in saure Reinigungsmittel eingearbeitet. Es ist besonders wirksam bei der Reinigung von Milchbehältern, Milchverarbeitungsgeräten und Trinkbrunnen sowie zum Entfernen von Rost und Ablagerungen in Wärmetauschern und Rohrleitungen.
Glykolsäure hat eine hemmende Wirkung auf das Wachstum eisenoxidierender Bakterien. Durch seine Verwendung entfällt die Notwendigkeit der gleichzeitigen Zugabe von Chelatbildnern und Bakteriziden.
Aufgrund der komplexierenden Eigenschaften von Glykolsäure eignet sie sich auch für Anwendungen wie Kupferpolituren, Ätzmittel für Lithografieplatten sowie für die Formulierung von Elektropolier- und Galvanisierungsbädern.
Derivate der Glykolsäure
Methylglykolat und Ethylglykolat sind zwei Glykolsäureester, die üblicherweise als Ausgangsmaterialien für die Laborsynthese reiner Glykolsäure verwendet werden. Früher wurden sie auch als Lösungsmittel für Harze und Nitro- oder Acetylcellulose eingesetzt. Abgesehen von diesen Estern haben nur Carboxymethylcellulose und n-Butylglycolat kommerzielle Bedeutung.
n-Butylglykolat
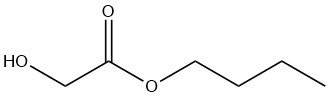
n-Butylglykolat ist eine farblose Flüssigkeit, die mit den meisten organischen Lösungsmitteln mischbar ist. Seine Wasserlöslichkeit ist bei 20 °C auf 8 Gew.-% begrenzt, obwohl die Verbindung selbst bis zu 25 Gew.-% Wasser enthalten kann.
Herstellung von n-Butylglykolat
Bei der Herstellung von n-Butylglykolat wird Natriumchloracetat mit n-Butylalkohol bei Temperaturen zwischen 125 und 160 °C behandelt und anschließend im Vakuum destilliert.
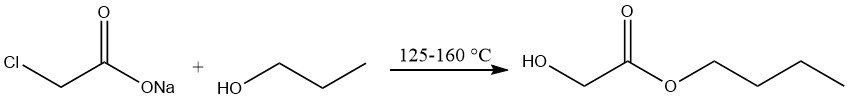
Verwendung von n-Butylglykolat
n-Butylglykolat findet vor allem als Zusatzstoff in Lacken Anwendung und wird wegen seiner geringen Flüchtigkeit geschätzt. Zu den Handelsnamen für n-Butylglykolat gehören Polysolvan-O (Hoechst) und GB-Ester (Wacker).
Es verleiht Nitrozelluloselacken eine gleichmäßige Verlaufseigenschaften und einen hohen Glanz. Im Fall von Acetylzellulose wirkt es unter Bedingungen hoher Luftfeuchtigkeit wirksam als Bräunungshemmer.
Aufgrund seiner guten Mischeigenschaften wird n-Butylglykolat auch als Zusatz in Alkydharzen und Ölfarben eingesetzt.
n-Butylglykolat gilt als ungefährlich.
Referenz
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- Process for manufacture of glycolic acid. – https://patents.google.com/patent/US2152852A/en
- Glycolic Acid Production from Ethylene Glycol. – https://pubs.acs.org/doi/10.1021/acssuschemeng.1c03717
