Crotonaldehyd: Eigenschaften, Reaktionen, Produktion und Verwendung
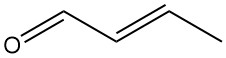
Crotonaldehyd [4170-30-3], auch bekannt als 2-Butenal, ist eine farblose Flüssigkeit mit stechendem Geruch und starken tränentreibenden Eigenschaften. Es hat die chemische Formel CH3CH=CHCHO und liegt in zwei Stereoisomeren vor: cis-Crotonaldehyd [15798-64-8] und trans-Crotonaldehyd [123-73-9].
Im Handel erhältlicher Crotonaldehyd enthält eine Mischung beider Isomere, wobei das trans-Isomer aufgrund seiner größeren thermodynamischen Stabilität die dominierende Form ist (>95 %).</p >
Crotonaldehyd kommt natürlicherweise in verschiedenen Pflanzen und Pflanzenprodukten vor, darunter Buschbohnen, Rapsöl und Sojaöl.
Inhaltsverzeichnis
| Eigenschaft | Wert |
|---|---|
| Molekularmasse | 70,09 g/mol |
| Siedepunkt | 102,2 °C |
| Schmelzpunkt | -76 °C |
| Dichte (20°C) | 0,852 g/cm3 |
| Brechungsindex (n20D) | 1,438 |
| Verdampfungswärme | 515 J/g |
| Crotonaldehyd-Wasser-Azeotrop | 24,8 Gew.-% H2O |
| Azeotrop-Siedepunkt | 84 °C |
| Löslichkeit in Wasser (20°C) | 181 g/L |
| Löslichkeit von Wasser in Crotonaldehyd (20 °C) | 9,5 g/100 g |
| Dampfdruck (bei 20 °C) | 4,3 kPa |
| Flammpunkt | 13 °C |
| Selbstzündungstemperatur | 165 °C |
| Explosionsgrenzen in der Luft |
Unterer Wert: 2,1 Vol.-% Obermaterial: 15,5 Vol.-% |
2. Chemische Reaktionen von Crotonaldehyd
Crotonaldehyd ist aufgrund des Vorhandenseins sowohl einer Carbonylgruppe als auch einer Kohlenstoff-Kohlenstoff-Doppelbindung in seiner Struktur hochreaktiv. Bei Verunreinigungen mit starken Säuren oder Laugen kommt es leicht zu exothermen Kondensationsreaktionen.
Die Einwirkung starker Säuren katalysiert die Dimerisierung von Crotonaldehyd zu Dicrotonaldehyd (5,6-Dihydro-2,6-dimethyl-2H-pyran-3-carboxaldehyd).
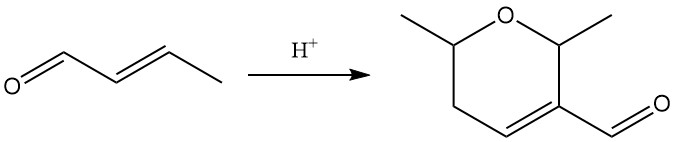
Zu den Hauptreaktionen von Crotonaldehyd gehören Hydrierung, Reduktion, Oxidation und Addition.
Sowohl die Carbonylgruppe als auch die C-C-Doppelbindung können reduziert werden. Die katalytische Hydrierung, typischerweise unter Verwendung von Nickel- oder Kupferkatalysatoren, bietet den wirtschaftlichsten Ansatz.
Die selektive Hydrierung der Olefineinheit bei niedrigeren Reaktionstemperaturen und -drücken war ein früher zur Herstellung von n-Butanal eingesetztes Verfahren. Derzeit ist die Hydroformylierung von Propen die bevorzugte Methode zur Butyraldehydsynthese.
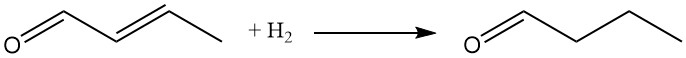
Durch die Hydrierung beider funktioneller Gruppen entsteht n-Butanol, das heute üblicherweise durch n-Butyraldehyd-Hydrierung hergestellt wird.
Selektive katalytische Hydrierung an der Carbonylgruppe führt zu Crotylalkohol (CH3CH=CHCH2OH).

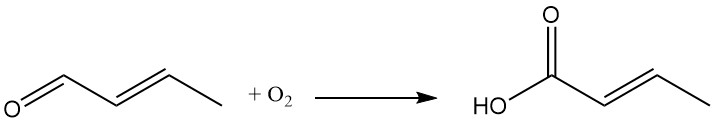
Durch die Oxidation von Crotonaldehyd entsteht Crotonsäure.
Die Anlagerung verschiedener Moleküle an die Doppelbindung von Crotonaldehyd macht es zu einem wertvollen chemischen Zwischenprodukt. Wichtig für die Synthese von 3-Alkoxybutyraldehyden ist beispielsweise die durch einen basischen Katalysator katalysierte Addition von Alkoholen oder Thiolen an die olefinische Doppelbindung.
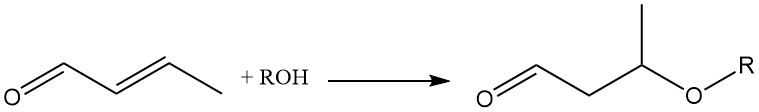
Durch die Zugabe von Methanol zu Crotonaldehyd entsteht das Zwischenprodukt 3-Methoxybutyraldehyd, das nacheinander hydriert und verestert wird, um Speziallösungsmittel wie 3-Methoxybutanol (1) und 3-Methoxybutylacetat (2) herzustellen.

Crotonaldehyd kann auch als Dienophil in Diels-Alder-Reaktionen verwendet werden.
3. Herstellung von Crotonaldehyd
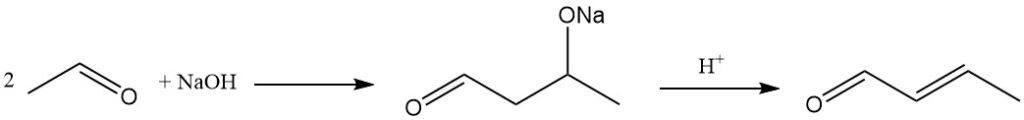
Die vorherrschende industrielle Methode zur Herstellung von Crotonaldehyd ist die Aldolkondensation von Acetaldehyd, gefolgt von der Dehydratisierung des resultierenden Aldols und der anschließenden Destillation. Dieser Prozess ergibt ein Produkt mit einer Reinheit von etwa 99 %.
Die Aldolisierungsreaktion kann durch eine Vielzahl basischer Katalysatoren katalysiert werden, darunter Alkali- oder Erdalkalimetallkatalysatoren, Ammoniumsalze, Zeolithe, Molekularsiebe und tonartige Materialien.
Als Katalysatoren für den Dehydratisierungsschritt, der Aldol in Crotonaldehyd umwandelt, werden Essigsäure, Mineralsäuren oder saure Kationenaustauscherharze verwendet.
Celanese Chemicals und Daicel sind bedeutende kommerzielle Hersteller von Crotonaldehyd. Eine vereinfachte kontinuierliche Crotonaldehyd-Produktionsanlage ist in Abbildung 1 dargestellt.
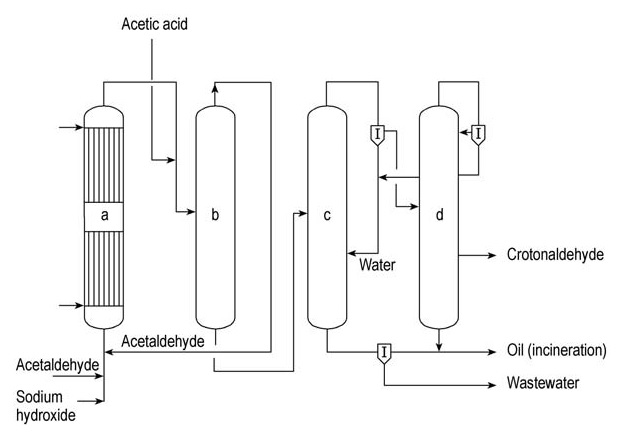
a) Aldolreaktor; b) Acetaldehyd-Strippkolonne; c) Azeotrop-Destillationskolonne; d) Rektifikationskolonne
In diesem Prozess wird Acetaldehyd in einem wassergekühlten Aldolreaktor (a) unter Verwendung einer wässrigen Lösung von Natriumhydroxid als Katalysator. Anschließend wird das Produkt mit Essigsäure neutralisiert, bevor es in eine Strippkolonne (b) eingespeist wird.
Nicht umgesetzter Acetaldehyd wird am Kopf dieser Kolonne zurückgewonnen und zum Aldolreaktor (a) zurückgeführt. Das Sumpfprodukt der Kolonne (b), das Zwischenaldol, wird in die Azeotropdestillationskolonne (c) eingespeist. Hier wird das Aldol dehydriert und das Crotonaldehyd-Wasser-Azeotrop destilliert.
Dieses Azeotrop wird anschließend in Wasser und eine wässrige Crotonaldehydphase mit etwa 10 % Wasser aufgetrennt. Das Wasser wird zur Azeotropkolonne (c) zurückgeführt und tritt als Sumpfprodukt aus.
Der wässrige Crotonaldehydstrom wird dann in die Rektifikationskolonne (d) eingespeist, wo sich ein weiteres Crotonaldehyd-Wasser-Azeotrop bildet und über Kopf austritt. Dieses Azeotrop wird in Wasser, das in die Azeotropsäule (c) zurückgeführt wird, und wässriges Crotonaldehyd, das in die Rektifikationssäule (d) zurückgeführt wird, aufgetrennt.
Aus dieser Kolonne wird als Seitenstrom reiner Crotonaldehyd gewonnen.
Schwere Fraktionen werden vom Boden der Kolonne (d) entfernt und mit organischen Rückständen aus der Azeotropkolonne (c) zusammengeführt, bevor sie verbrannt werden. Das aus Kolonne (c) erzeugte Abwasser wird in einer speziellen Abwasserreinigungsanlage behandelt.
Alternative Produktionsmethoden
Während die Aldolkondensation von Acetaldehyd nach wie vor die vorherrschende industrielle Methode bleibt, wurden alternative Technologien erforscht. Eine Methode ist die Oxidation von Butadien zu seinem Monoepoxid, gefolgt von der Isomerisierung zu Crotonaldehyd.
Dieses Verfahren weist einige Ähnlichkeiten mit dem Wacker-Hoechst-Verfahren zur Acetaldehydproduktion aus Ethylen auf. Allerdings scheint die Verwendung von Paraldol als Alternative zu Aldol für die Herstellung von 1,3-Butylenglykol in Kosmetikqualität vielversprechender zu sein als seine Anwendung in der Crotonaldehyd-Synthese.
Andere Methoden, wie die katalytische Oxidation von Olefinen, Dehydrierung von Allylalkohol mit Aminen, Dampfphasenhydratisierung von Acetylen und die enzymatische Oxidation von 2-Buten haben keine praktische Bedeutung für die Crotonaldehydproduktion erlangt.
Crotonaldehyd kann auch als Nebenprodukt bei der Synthese von 1,3-Butylenglykol und bei der Essigsäureproduktion durch Methanolcarbonylierung entstehen. Darüber hinaus entsteht bei unvollständigen Verbrennungsprozessen, wie sie beispielsweise in Autoabgasen auftreten, Crotonaldehyd als Bestandteil des Abgases.
4. Verwendung von Crotonaldehyd
Crotonaldehyd wird als Vorstufe bei der Synthese verschiedener Industrieprodukte verwendet.
Große Mengen Crotonaldehyd werden bei der Herstellung von Sorbinsäure, einem gängigen Lebensmittelkonservierungsmittel, verwendet. Die Synthese umfasst die Kondensation von Crotonaldehyd mit Keten in Gegenwart organischer Zinksalze, gefolgt von der Depolymerisation des resultierenden Polyesters, entweder thermisch oder unter Verwendung einer Mineralsäure.
α-Tocopherol, einer der acht natürlich vorkommenden Bestandteile mit Vitamin-E-Aktivität, wird industriell durch Kondensation von Phytol mit 2,3,6-Trimethylhydrochinon synthetisiert gebildet aus Crotonaldehyd und Diethylketon durch einen vierstufigen Prozess.
3-Methoxybutanol wird durch Zugabe von Methanol zu Crotonaldehyd und anschließende Hydrierung hergestellt. Dieses Produkt und sein Acetatester werden als Speziallösungsmittel verwendet und besonders wegen ihrer Fähigkeit zur Steuerung der Viskosität, des Trocknungsverhaltens und des Glanzes in Lacken und Lacken geschätzt.
Crotonaldehyd ist ein Vorläufer für eine Vielzahl chemischer Zwischenprodukte. Ein Paradebeispiel ist Crotonsäure, die durch Oxidation von Crotonaldehyd gewonnen wird. Diese von Crotonaldehyd abgeleiteten Zwischenprodukte werden in verschiedenen Sektoren verwendet, darunter:
- Pharmazeutika und biokompatible/medizinische Produkte
- Agrochemikalien
- Harze, polymere Verdickungsmittel
- Farben und Beschichtungen
- Farbstoffe
- Gummi und Gummi-Antioxidantien
- Gelatine-Härtung
- Klebstoffe
- Ledergerben und Leimen (Leder und Papier)
- Metallaufheller
- Schmierstoffe
- Korrosionsinhibitoren
5. Toxikologie von Crotonaldehyd
Crotonaldehyd stellt aufgrund seiner stark reizenden Eigenschaften ein erhebliches Gesundheitsrisiko dar. Hier ist eine Aufschlüsselung seiner Auswirkungen:
Auswirkungen auf die menschliche Gesundheit
- Crotonaldehyd reizt Augen, Haut und Atemwege. Studien legen unterschiedliche Schwellenwerte für Reizungen nahe, die zwischen 0,035 ppm und 0,56 ppm für die Geruchserkennung bzw. Reizung liegen.
- Einatmen kann zu Brennen in der Nase und den Atemwegen, Tränenfluss, Husten, Bronchokonstriktion und möglicherweise zu Lungenödemen oder tiefen Lungenschäden führen.
- Crotonaldehyd kommt in Tabakrauch, Motorabgasen und Holzverbrennungen vor. Es kommt auch natürlicherweise in einigen Lebensmitteln vor.
Grenzwerte für die berufsbedingte Exposition
In Ermangelung spezifischer berufsbedingter Expositionsgrenzwerte können Richtlinien wie AEGLs (Acute Exposure Guideline Levels) und ERPGs (Emergency Response Planning Guidelines) zur Risikobewertung bei Unfällen oder Notfällen herangezogen werden.
Toxikologische Daten
- Akute Toxizität:
- Oral LD50 (Ratte): 174 mg/kg
- Inhalation LC50 (Ratte, männlich, 4h): 336 mg/m3
- Dermal LD50 (Meerschweinchen): 26 mg/kg
- Genotoxizität: Während Crotonaldehyd in vitro (in einer Laborumgebung) Addukte bildet, sind die Beweise für eine in vivo-Mutagenität weniger eindeutig.
- Crotonaldehyd ist gemäß CLP-Verordnung (EG) Nr. 1272/2008 als mutagen eingestuft.
Auswirkungen auf Tiere und Mikroorganismen
- Tiere:
- Fische sind die empfindlichsten Arten gegenüber Crotonaldehyd, mit einem 96-Stunden-LC50 (tödliche Konzentration für 50 % der Population) von 0,65 mg/L für Regenbogenforellen.
- Crotonaldehyd reizt die Atemwege verschiedener Tiere, wobei Ratten am empfindlichsten sind (4-stündige Inhalation LC50 von 120 ppm).
- Mikroorganismen sind weniger anfällig als Tiere, wobei Pseudomonas putida einen 18-Stunden-EC10 (Wirkungskonzentration für 10 % der Bevölkerung) von aufweist 10,4 mg/L.
Crotonaldehyd wird trotz seiner hohen biologischen Abbaubarkeit (> 83 %) als Meeresschadstoff eingestuft.
Referenzen
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2
- CROTONALDEHYDE; IARC MONOGRAPHS VOLUME 63. – https://publications.iarc.fr/81
