Brenzcatechin: Herstellung, Reaktionen und Verwendung
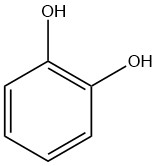
Catechol, auch Brenzcatechin oder 1,2-Dihydroxybenzol genannt, ist eine organische Verbindung mit der Summenformel C6H4(OH)2. Es ist eine kristalline Substanz mit einem charakteristischen phenolischen Duft.
Catechol ist ein aromatisches Diol, das ursprünglich 1839 durch die Trockendestillation von Catechin von Reinsch entdeckt wurde. Heute wird es industriell aus Phenol synthetisiert.
Brenzcatechin wurde in einer Reihe von Quellen gefunden, darunter roher Rübenzucker, roher Holzteer, ausgewählte Eukalyptusarten, Zwiebeln und Kohle.
Brenzkatechin und seine Derivate können durch eine Vielzahl von Techniken wie Trockendestillation und andere Verfahren aus Substanzen wie Tannin, Lignin, Holz und Steinkohle hergestellt werden. Darüber hinaus kommt es im Tabakrauch vor und kommt in Form von Schwefelsäureester im Urin von Menschen und Pferden vor.
Inhaltsverzeichnis
1. Produktion von Brenzcatechin
In der Vergangenheit wurde Brenzcatechin hauptsächlich durch den Prozess der Verkokung von Kohle bei niedriger Temperatur hergestellt. Allerdings wird diese Technik derzeit nur in seltenen Fällen eingesetzt.
1.1. Hydrolyse von 2-Chlorphenol

In industriellen Umgebungen kann die Herstellung von Brenzkatechin durch Hydrolyse von 2-Chlorphenol unter Verwendung einer Lösung aus Bariumhydroxid und Natriumhydroxid erfolgen. Die Rückgewinnung von Barium, das aus Carbonat in Hydroxid umgewandelt und anschließend in den Prozess zurückgeführt wird, trägt zur Komplexität der Methode bei. Als Reaktion darauf wurden alternative Techniken entwickelt, die ausschließlich Ätzalkali verwenden.
Beispielsweise wird die Reaktion von 1 Mol 2-Chlorphenol mit 2,3 Mol einer Natriumhydroxidlösung im Bereich von 4–8 % bei 190 °C für eine Dauer von 3 Stunden in einem Kupferautoklaven in Gegenwart von Kupfer durchgeführt (II) Sulfat oder Kupfer(I)oxid. Die Selektivität für Brenzkatechin beträgt 81–86 %, während die Umwandlung von 2-Chlorphenol zwischen 96–99 % liegt.
Anschließend wird die resultierende Mischung mit Schwefelsäure neutralisiert und anschließend das entstandene Rohbrenzkatechin extrahiert. Das Lösungsmittel wird zurückgewonnen und Brenzkatechin durch Destillation gereinigt. Dieses Produktionsverfahren wurde bis 1973 für die industrielle Brenzcatechinproduktion eingesetzt.
1.2. Hydroxylierung von Phenol
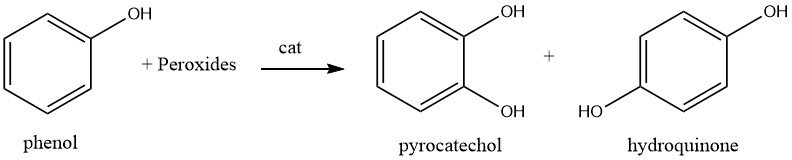
Die Herstellung von Brenzkatechin erfolgt derzeit durch direkte Hydroxylierung von Phenol mit Peroxiden, wobei auch Hydrochinon entsteht.
Derzeit sind weltweit drei Anlagen in Betrieb, die diese Methode anwenden, wobei jede Anlage ein eigenes Peroxid oder einen anderen Katalysator verwendet.
Aufgrund der exothermen Natur der Reaktion und der Tendenz von Benzoldiolen, leichter oxidiert zu werden als Phenol, wird die Reaktion mit einem erheblichen Überschuss an Phenol durchgeführt.
Eine von Rhone-Poulenc betriebene Anlage in Frankreich setzt Phenol mit 70 % Wasserstoffperoxid (Molverhältnis 20:1) in Gegenwart von Phosphorsäure und katalytischen Mengen Perchlorsäure bei 90 °C um. Dies führt zur Produktion von Brenzcatechin und Hydrochinon im Verhältnis von etwa 3:2.
Die Reaktion verläuft elektrophil und Phosphorsäure wird als Maskierungsreagenz eingesetzt, um Nebenreaktionen zu verhindern, die durch Spurenmengen an Metallionen verursacht werden, wie z. B. die Bildung von Resorcin durch eine Radikalreaktion, die zu einer geringeren Ausbeute führt.
Nach der Reaktion werden Phosphor- und Perchlorsäure durch Waschen mit Wasser entfernt und die Reaktionsmischung gleichzeitig mit Diisopropylether extrahiert, destilliert und kontinuierlich getrennt.
Brichima SpA (heute Enichem) in Italien verwendet Schwermetallverbindungen, wie etwa geringe Mengen Ferrocen und/oder Kobaltsalze, als Katalysator und setzt Phenol mit 60 %igem wässrigem Wasserstoffperoxid bei 40 °C um. Brenzcatechin und Hydrochinon entstehen im Verhältnis 1,5-4,1 durch einen schnell ablaufenden Radikalkettenmechanismus.
In Japan produziert Ube Industries Brenzkatechin mit Hydrochinon durch Hydroxylierung von Phenol mit Ketonperoxid (Methylethylketonperoxid), das in situ aus einem Keton und Wasserstoffperoxid in Gegenwart eines Säurekatalysators gebildet wird.
Der Prozess wird durch Zugabe einer Spurenmenge Säure, wie Schwefel- oder Sulfonsäure, einer kleinen Menge Keton und 60 % wässrigem Wasserstoffperoxid zu Phenol bei 70 °C durchgeführt. Das in situ gebildete Ketonperoxid reagiert schnell und elektrophil mit Phenol, und Brenzkatechin und Hydrochinon werden in einem Molverhältnis von etwa 3:2 in einer Ausbeute von über 90 % (bezogen auf umgesetztes Phenol) produziert.
Wenn eine feste Säure wie Ton als Katalysator verwendet wird, beträgt das Molverhältnis von Brenzkatechin und Hydrochinon etwa 1:1. Die Verwendung einer geringen Katalysatormenge verhindert Korrosion und die Reaktionsmischung kann destilliert werden, ohne den Katalysator nach der Reaktion zu entfernen. Das zugesetzte Keton kann dem Prozess wieder zugeführt werden, indem es durch Destillation zurückgewonnen wird.
Die in allen drei Verfahren eingesetzten Trenn- und Reinigungsmethoden sind grundsätzlich gleich. Das Reaktionsgemisch wird durch Destillation in verschiedenen Destillationskolonnen aufgetrennt.
Wasser wird entfernt, niedrigsiedende Fraktionen (Lösungsmittel, Ketone usw.) und nicht umgesetztes Phenol werden zurückgewonnen und recycelt, die Brenzkatechinfraktion wird in ein Flockenprodukt umgewandelt und Hydrochinon wird durch Umkristallisation der entsprechenden Fraktion aus Wasser gereinigt.
1.3. Dehydrierung von 1,2-Cyclohexandiol

Brenzkatechin kann mit einer Ausbeute von 90 % durch Dehydrierung von 1,2-Cyclohexandiol unter Verwendung eines Pd/Te-Katalysatorsystems bei einer Temperatur von 300 °C synthetisiert werden. Es wurde berichtet, dass Brenzcatechin als einziges Produkt dieses Prozesses entsteht.
Darüber hinaus kann Brenzkatechin mithilfe der folgenden Methoden synthetisiert werden: (1) Alkalifusion von 2-Phenolsulfonsäure und Phenol-2,4-disulfonsäure; (2) Oxidation von Salicylaldehyd mit Wasserstoffperoxid in wässriger alkalischer Lösung; (3) Demethylierung von Guajakol unter Verwendung von Bromwasserstoffsäure oder Aluminiumchlorid; und (4) Hydrolyse von 2-Aminophenol unter Verwendung eines Halogenwasserstoffs.
2. Chemische Reaktionen von Brenzcatechin
Die Dehydrierung von 1,2-Cyclohexandiol unter Verwendung eines Pd/Te-Katalysatorsystems bei 300 °C erzeugt Brenzkatechin als einziges Produkt in einer Ausbeute von 90 %.
Brenzkatechin bildet mit Eisen(III)-chlorid eine deutliche Grünfärbung, bei Zugabe von Natriumhydroxid oder Ammoniak kommt es zu einem Farbumschlag nach Rot. Solche Eigenschaften sind einzigartig für Brenzcatechin und können bei seiner Identifizierung und Erkennung hilfreich sein.
Brenzkatechin bildet mit fast allen Metallen stabile Koordinationsverbindungen und dient somit als nützliches analytisches Reagenz für den Metallnachweis.
Alkalihydroxide oder -carbonate reagieren mit Brenzkatechin, einer schwachen Säure, unter Bildung von Mono- und Disalzen. Die Schwermetallsalze von Brenzcatechin, insbesondere seine Bleisalze, sind in Wasser unlöslich. Dadurch kann die Reaktion von Brenzkatechin mit Bleiacetat die Trennung und quantitative Analyse von Brenzcatechin von seinen Isomeren Hydrochinon und Resorcin erleichtern.
Als stärkstes Reduktionsmittel unter den drei Benzoldiol-Isomeren reagiert Brenzcatechin mit Schwermetallsalzlösungen unter Bildung feiner elementarer Metallniederschläge.
Die oxidative Spaltung von Brenzkatechin mit Sauerstoff in Gegenwart von Kupfer(I)-chlorid und Methanol führt zur Bildung von cis,cis-Muconsäuremonomethylester. Ebenso führt die vorsichtige Oxidation von Brenzcatechin mit Silberoxid oder Silbercarbonat auf Celite zur Bildung von 1,2-Benzochinon.
Brenzcatechin reagiert mit Acylhalogeniden unter Bildung der entsprechenden Mono- und Diester. Diese Verbindungen werden durch Fries-Umlagerung, katalysiert durch Aluminiumchlorid, in phenolische Ketone umgewandelt.
Eine Reimer-Tiemann-Reaktion mit Chloroform und Alkali oder die Zugabe von Glyoxylsäure und anschließende oxidative Decarboxylierung können eine Aldehydgruppe in den aromatischen Kern einführen.
Mit üblichen Methoden lassen sich Mono- und Diether des Brenzkatechins herstellen, die aufgrund ihrer benachbarten Hydroxylgruppen Zyklisierungsreaktionen eingehen können.
Methylendioxybenzol und Dibenzo-18-kronen-6-polyether können durch Reaktion von Brenzcatechin mit Dichlormethan bzw. Bis(2-chlorethyl)ether erhalten werden.
Brenzkatechin kuppelt mit Aryldiazoniumsalzen zu Azoverbindungen, die zu 4-Aminobrenzkatechin reduziert werden können.
Brenzkatechin kann mit Formaldehyd Kondensationsreaktionen eingehen, um Bis(dihydroxyphenyl)methan zu erzeugen, und mit Phthalsäureanhydrid, um polyzyklische Verbindungen wie Hystazarin und Alizarin zu bilden.
Brenzcatechin kann an der 3- und 4-Position alkyliert, halogeniert, nitriert, carboxyliert und sulfoniert werden.
3. Verwendung von Brenzcatechin
Brenzcatechin dient verschiedenen Zwecken, unter anderem als fotografischer Entwickler, analytisches Reagenz und Antioxidans. Der größte Teil des Catechins wird jedoch in Form seiner Derivate verwendet. Beispielsweise entstehen durch O-Methylierung von Brenzcatechin Guajakol (2-Methoxyphenol) und Veratrol (1,2-Dimethoxybenzol).
Guajakol wird zur Synthese von Vanillin (4-Hydroxy-3-methoxybenzaldehyd) verwendet, das als Aromastoff verwendet wird. Ethylvanillin (3-Ethoxy-4-hydroxybenzaldehyd), abgeleitet von Guethol (2-Ethoxyphenol, ein Homolog von Guajakol), ist eine wertvolle Aromaverbindung, da sein Geschmack drei- bis viermal stärker ist als der von Vanillin.
Eugenol (2-Methoxy-4-allylphenol), Safrol (5-Allyl-1,3-benzodioxol) und Piperonal [3,4-(Methylendioxy)benzaldehyd], die daraus hergestellt werden können, dienen als nützliche Duftstoffe in Parfümerie.
Kaliumguajakolsulfonat (4-Hydroxy-3-methoxybenzolsulfonsäure-Monokaliumsalz) und Guajakolglycerylether [3-(2-Methoxyphenoxy)-1,2-propandiol] werden in der Medizin als schleimlösend eingesetzt.
L-α-Methyldopa (3-Hydroxy-α-methyl-L-tyrosin) und L-Dopa (3-Hydroxy-L-tyrosin), abgeleitet von Vanillin, werden als blutdrucksenkende bzw. gegen Parkinson wirkende Arzneimittel eingesetzt.
Darüber hinaus wird Trimethoprim, das aus Vanillin synthetisiert wird, als Antiinfektivum eingesetzt. Carbazochrom und seine Natriumsulfonatform sind blutstillende Mittel, die im medizinischen Bereich häufig eingesetzt werden. Mittlerweile ist Papaverin, das als krampflösendes, gefäßerweiterndes und glattes Muskelrelaxans wirkt, für sein therapeutisches Potenzial bei bestimmten Erkrankungen bekannt.
Zwei wichtige Carbamat-Insektizide, Carbofuran (2,3-Dihydro-2,2-dimethyl-7-benzofuranylmethylcarbamat) und Propoxur (2-Isopropoxyphenyl-N-methylcarbamat), die aus Brenzcatechin gewonnen werden, haben als Agrarchemikalien an Bedeutung gewonnen.
Diese Insektizide werden in großem Umfang zur Bekämpfung von Schädlingen eingesetzt und von Bayer unter den Handelsnamen Furadan bzw. Baygon vermarktet.
Die chemische Verbindung 4-tert-Butylcatechol wird durch Ringalkylierung von Brenzcatechin synthetisiert. Es wird wegen seiner Nützlichkeit als Polymerisationsinhibitor bei der Herstellung und Lagerung von Monomeren wie Styrol und Butadien hoch geschätzt.
Referenz
- Phenol Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_313
