Benzylchlorid: Herstellung, Reaktionen und Verwendungen
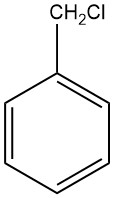
Benzylchlorid ist ein Toluolderivat mit Chlorsubstitution in der Seitenkette. Es ist eine wichtige Verbindung mit vielen industriellen Anwendungen. Es wurde ursprünglich 1853 von S. Cannizzaro durch die Reaktion zwischen Benzylalkohol und Salzsäure synthetisiert.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzylchlorid
Benzylchlorid ist eine farblose Flüssigkeit mit einem starken, stechenden Geruch. Es ist ein starkes Tränenmittel, das sowohl die Augen als auch die Schleimhäute stark reizt.
Hier sind einige wichtige physikalische Eigenschaften von Benzylchlorid:
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht (Mr) | 126,58 |
| Siedepunkt bei 101,3 kPa | 179,4°C |
| Schmelzpunkt (mp) | -39,2°C |
| Dichte (ρ) bei 10°C | 1,1188 g/cm³ |
| Dichte (ρ) bei 20°C | 1,1081 g/cm³ |
| Dichte (ρ) bei 30°C | 1,1004 g/cm³ |
| Dichte (ρ) bei 50°C | 1,0870 g/cm³ |
| Dichte (ρ) bei 87°C | 1,072 g/cm³ |
| Brechungsindex (n20D) | 1,5389 |
| Dynamische Viskosität (η) bei 15°C | 1.501 mPa·s |
| Dynamische Viskosität (η) bei 20°C | 1,38 mPa·s |
| Dynamische Viskosität (η) bei 25°C | 1,289 mPa·s |
| Dynamische Viskosität (η) bei 30°C | 1,175 mPa·s |
| Oberflächenspannung (σ) bei 15°C | 38,43 mN/m |
| Oberflächenspannung (σ) bei 20°C | 37,80 mN/m |
| Oberflächenspannung (σ) bei 30°C | 36,63 mN/m |
| Oberflächenspannung (σ) bei 88°C | 29,15 mN/m |
| Oberflächenspannung (σ) bei 17°C | 19,5 mN/m |
| Spezifische Wärme bei 0°C | 178 J mol⁻¹ K⁻¹ (1403 J kg⁻¹ K⁻¹) |
| Spezifische Wärme bei 20°C | 181 J mol⁻¹ K⁻¹ (1432 J kg⁻¹ K⁻¹) |
| Spezifische Wärme bei 25°C | 183 J mol⁻¹ K⁻¹ (1444 J kg⁻¹ K⁻¹) |
| Spezifische Wärme bei 50°C | 189 J mol⁻¹ K⁻¹ (1495 J kg⁻¹ K⁻¹) |
| Spezifische Wärme bei 100°C | 212 J mol⁻¹ K⁻¹ (1675 J kg⁻¹ K⁻¹) |
| Verdampfungswärme bei 25°C | 50,1 kJ/mol (396 kJ/kg) |
| Verbrennungswärme bei konstantem Volumen | 3708 kJ/mol (29,29 × 10³ kJ/kg) |
| Flammpunkt | 60°C |
| Zündtemperatur | 585°C |
| Explosionsgrenzen in der Luft | Unterer Wert: 1,1 Vol.-%, Oberer Wert: 14 Vol.-% |
| Explosionsgrenzen in Chlor | Unterer Teil: Ungefähr 6 Vol.-%, Oberer Teil: Ungefähr 60 Vol.-% |
| Spezifische Leitfähigkeit bei 20°C | 1,5 × 10⁻⁸ S/cm |
| Dampfdruck bei 0°C | 0,025 kPa |
| Dampfdruck bei 10°C | 0,05 kPa |
| Dampfdruck bei 20°C | 0,12 kPa |
| Dampfdruck bei 30°C | 0,37 kPa |
| Dampfdruck bei 50°C | 0,99 kPa |
| Dampfdruck bei 100°C | 7,96 kPa |
| Dampfdruck bei 130°C | 23,40 kPa |
| Dampfdruck bei 179,4°C | 101,33 kPa |
Benzylchlorid bildet verschiedene Azeotrope, Beispiele finden sich in der folgenden Tabelle:
| Komponente | BP, °C | Benzylchlorid, Gew.-% |
|---|---|---|
| Benzaldehyd | 178 | 50 |
| Hexansäure | 179 | 95 |
| Isovaleriansäure | 171 | 38 |
| Valeriansäure | 175 | 25 |
| Ethylacetoacetat | 175 | 35 |
| Methylacetoacetat | 167 | <80 |
| 1,3-Dichlor-2-propanol | 169 | 57 |
| 2,3-Dichlor-2-propanol | 171 | 40 |
| Ethylenglykol | ca. 167 | ca. 30 |
Die Löslichkeit von Benzylchlorid in Wasser variiert mit der Temperatur und beträgt 0,33 g/L bei 4 °C, 0,49 g/L bei 20 °C und 0,55 g/L bei 30 °C. Es löst sich leicht in Lösungsmitteln wie Chloroform, Aceton, Essigsäureestern, Diethylether und Ethanol.
Die Löslichkeit von Chlor in 100 g Benzylchlorid ändert sich mit der Temperatur und erreicht 8,0 g bei 30 °C, 5,4 g bei 50 °C und 2,1 g bei 100 °C.
2. Chemische Reaktionen von Benzylchlorid
Benzylchlorid ist ein Ausgangsmaterial für die Synthese von Benzalchlorid und Benzotrichlorid durch Seitenkettenchlorierung. Bei der Kernchlorierung entstehen Chlorbenzylchloride. Es wird in einer wässrigen Lösung mit Natriumdichromat und Natriumcarbonat zu Benzaldehyd und Benzoesäure oxidiert.

Benzylchlorid reagiert mit Metallen unter Bildung unterschiedlicher Produkte. Beispielsweise reagiert es mit Magnesium in Diethylether unter Bildung von Benzylmagnesiumchlorid, einem Grignard-Reagenz. Mit Kupferpulver oder Natrium entsteht 1,2-Diphenylethan als Hauptprodukt der Wurtz-Synthese.
Es reagiert mit starken Lewis-Säure-Katalysatoren wie FeCl3, AlCl3 und ZnCl2 unter Bildung von Friedel-Crafts-Selbstkondensationsprodukten vom Typ (C7H6)n. Diese Polymere sind jedoch kommerziell nicht von Bedeutung, obwohl sie den Grad der Kondensation durch Änderung der Reaktionsbedingungen steuern können.
Es reagiert mit Benzol oder Toluol in Gegenwart von Friedel-Crafts-Katalysatoren unter Bildung von Diphenylmethan bzw. den isomeren Benzyltoluolen.
Benzylchlorid reagiert mit Schwefelwasserstoff und Alkalimetallen unter Bildung von Benzylmercaptan bzw. Dibenzylsulfid. Durch die Reaktion mit Natriumsalzen von Carbonsäuren entstehen die entsprechenden Benzylester.
Bei der Hydrolyse mit heißem Wasser entsteht Benzylalkohol. Diese Reaktion wird jedoch nicht industriell genutzt, da der gebildete Benzylalkohol durch die dabei entstehende Salzsäure wieder in Benzylchlorid umgewandelt wird. Es fördert auch die Bildung von Dibenzylether. Allerdings ergibt die Hydrolyse in Gegenwart von Alkali Benzylalkohol.
Benzylchlorid reagiert mit Natriumcyanid unter Bildung von Phenylacetonitril (Benzylcyanid). Bei der Reaktion mit Ammoniak oder Aminen entstehen primäre, sekundäre, tertiäre Amine und quartäre Ammoniumsalze.
Bei der Reaktion mit Hexamethylentetramin entsteht Benzaldehyd, die sogenannte Sommelet-Reaktion.
3. Herstellung von Benzylchlorid

3.1. Reaktionsmechanismus
Der Prozess der Chlorierung von Toluol umfasst zwei unterschiedliche Mechanismen: Radikalketten- und elektrophile polare Mechanismen. Der Radikalkettenmechanismus besteht aus mehreren Schritten:
1. Ketteninitiierung:
Chlorgas (Cl2) wird durch Lichtenergie (hν) initiiert und erzeugt zwei Chlorradikale (2 Cl• ).
2. Kettenausbreitung:
- Chlorradikale (Cl•) reagieren mit der aliphatischen Seitenkette (RH) und bilden ein Methylradikal (R•) und Chlorwasserstoff (HCl).
- Methylradikale (R•) reagieren dann mit mehr Chlor (Cl2) und erzeugen Methylchlorid (RCl) und weitere Chlorradikale (Cl•).
3. Kettenabbruch:
- Chlorradikale (Cl•) können die Kette beenden, indem sie sich zu Chlorgas (Cl2) verbinden.
- Methylradikale (R•) können die Kette auch beenden, indem sie miteinander zu Dimethylverbindungen (RR) reagieren.
Dieser Chlorierungsprozess ist stark exotherm und setzt Energie im Bereich von 96 bis 105 kJ/mol Chlor frei. Aufgrund der schnellen Bildung von Chlorradikalen und der Verdrängung von Wasserstoff können die Radikalkettenlängen je nach Substrat und Reaktionsbedingungen zwischen 103 und 106 variieren.
Da Seitenkettenchlorierung und Kernchlorierung grundsätzlich unterschiedlichen Mechanismen folgen, ist es möglich, Selektivität zu erreichen. Um eine hohe Effizienz bei der Seitenkettenchlorierung zu gewährleisten, müssen bestimmte Bedingungen erfüllt sein:
- Optimale Radikalkonzentration: Halten Sie eine ideale Radikalkonzentration aufrecht.
- Beseitigen Sie elektrophile Effekte: Entfernen Sie Komponenten, die elektrophile Reaktionen auslösen könnten.
- Kettenabbruch verhindern: Eliminieren Sie Substanzen, die Radikalketten vorzeitig beenden können.
- Vermeiden Sie Nebenreaktionen: Minimieren Sie Bedingungen, die zu unerwünschten Reaktionen führen.
- Radikale Reaktionen fördern: Treffen Sie Vorsichtsmaßnahmen, die radikale Reaktionen gegenüber elektrophilen begünstigen.
Gehen Sie auf jeden dieser Punkte ein:
1. Die Bildung von Chlorradikalen kann durch radikalbildende Mittel wie 2,2´-Azobis(isobutyronitril) (AIBN), Benzoylperoxid oder erhöhte Temperaturen (100–200 °C) verstärkt werden. Auch die Bestrahlung mit UV-Licht oder β-Strahlung kann Chlormoleküle anregen.
2. Friedel-Crafts-Katalysatoren begünstigen die Kernchlorierung. Daher sollten die Ausgangsmaterialien frei von Stoffen sein, die die Kernchlorierung fördern, wie beispielsweise Eisensalze. Reaktormaterialien wie Glas, emaillierter Stahl und Polytetrafluorethylen werden bevorzugt.
3. Sauerstoff ist ein Radikalfänger und seine Anwesenheit sollte minimiert werden. Destilliertes Chlor oder Spülen mit einem Inertgas kann zur Entfernung von Sauerstoff beitragen.
4. Wasser kann zur Bildung von Salzsäure führen und eine Hydrolyse der chlorierten Verbindungen verursachen. Bei der Chlorierung entstehender Chlorwasserstoff kann zur Kernchlorierung beitragen.
5. Zu hohe Chlorkonzentrationen können zu unerwünschten Nebenreaktionen führen. Das Einbringen eines Inertgases in den Chlorstrom und der Einsatz kleinerer Reaktoreinheiten können zur Abmilderung dieses Problems beitragen.
Bei der radikalischen Chlorierung von Toluol werden alle drei Wasserstoffatome in der Seitenkette nach und nach durch Chlor ersetzt, wodurch Gemische aus Benzylchlorid, Benzalchlorid und Benzotrichlorid entstehen.
3.2. Fertigungsprozess
Um Benzylchlorid mit minimaler Produktion von Nebenprodukten wie Benzalchlorid und Benzotrichlorid herzustellen, besteht ein Ansatz darin, die Chlorierung auf nur 30–40 % des Toluoleinsatzes zu beschränken und die resultierende Mischung dann durch Fraktionierung aufzutrennen.
Eine andere Methode besteht darin, Alkyl- oder Arylsulfide als Radikalketteninitiatoren zu verwenden, um die Seitenkette ohne UV-Licht zu monochlorieren.
In modernen industriellen Prozessen wird Benzylchlorid durch Seitenkettenchlorierung von Toluol in Photoreaktoren vom kontinuierlichen Schleifentyp aus emailliertem Stahl oder Glas hergestellt. Ältere Methoden mit mit Silber, Blei oder Nickel ausgekleideten Reaktionssäulen wurden aufgrund von Korrosionsproblemen eingestellt.
Im kontinuierlichen Verfahren wird die Chlorierung typischerweise auf 20–40 % des Toluoleinsatzes begrenzt, um die Bildung höher chlorierter Nebenprodukte zu minimieren. Die resultierende Mischung, die immer noch erhebliche Mengen Toluol und typischerweise 0,5–2 % Benzalchlorid enthält, wird einer Destillation unterzogen.
Bei der Destillation werden Hochsieder zur weiteren Reinigung abgetrennt und Toluol in den Reaktor zurückgeführt.
Mithilfe der Online-Nahinfrarotspektroskopie wird die Zusammensetzung des Reaktionsgemischs in Chlorierungsreaktoren und Destillationsanlagen überwacht und ermöglicht so eine effiziente Steuerung der Toluol- und Chlorzuführungen im kontinuierlichen Prozess.
Der Hauptnachteil dieser Methode sind jedoch die hohen Kosten, die mit Destillationsprozessen aufgrund der erheblichen Menge an recyceltem Toluol verbunden sind.
Ein typischer Anlagenaufbau für die kontinuierliche Benzylchloridproduktion ist in Abbildung 1 dargestellt.

Frisches Toluol gelangt in den Vorchlorierer (R0) und strömt dann durch eine Kaskade aus vier zusätzlichen Photoreaktoren (R1-R4), die mit genau dosierten Mengen Chlor versorgt werden, wobei der Chlorgehalt von Reaktor zu Reaktor abnimmt.
Typischerweise wird der letzte Reaktor in der Kaskade vor der Reinigung mit reinem Stickstoff gespült, um gelöstes Chlorgas aus der Reaktionsmischung zu entfernen. In der anschließenden Rohdestillation (C1) wird nicht umgesetztes Toluol entfernt, so dass Benzylchlorid (zusammen mit geringen Mengen Benzalchlorid) im Destillationssumpf zurückbleibt.
Das chlorierte Rohprodukt wird zur weiteren Reinigung zur Endqualität in die Feindestillationseinheit (C2) geleitet. Das verbleibende Sumpfprodukt ist eine Mischung aus Benzyl- und Benzalchloriden, die zur Wiederverwertung bei der Herstellung von Benzalchlorid oder Benzotrichlorid geeignet ist.
Die kombinierten Abgase aus den Reaktoren werden zum Vorchlorierer (R0) zurückgeführt, wo restliches Chlor mit frischem oder recyceltem Toluol reagiert.
Das chlorfreie Abgas, das hauptsächlich aus Chlorwasserstoff und Stickstoff besteht, wird in einem Wäschersystem behandelt, in dem HCl von Wasser absorbiert wird, wodurch konzentrierte Salzsäure in technischer Qualität entsteht.
Alternativ kann reines Benzylchlorid durch Dampfphasenchlorierung in speziellen Reaktoren hergestellt werden, wobei die Temperatur am Chloreinspeisepunkt im Bereich der Siedepunkte von Toluol und Benzylchlorid gehalten wird.
Unter diesen Bedingungen wird Benzylchlorid schnell kondensiert und gesammelt, während Chlorwasserstoff oben austritt und Toluol verflüssigt und recycelt wird. Der Reaktor arbeitet kontinuierlich und das Sumpfprodukt besteht typischerweise aus 0,9 % Toluol, 93,6 % Benzylchlorid und 5,5 % Destillationsrückstand.
Diese Methode birgt inhärente Risiken, einschließlich der Zündtemperatur von Toluol in Chlorgas (185 °C) und der explosiven Natur von Toluol-Chlor- und Benzylchlorid-Chlor-Gemischen über einen weiten Konzentrationsbereich.
Ein anderer Ansatz zur Herstellung von Benzylchlorid beinhaltet die Chlormethylierung von Benzol, obwohl diese Methode keine kommerzielle Bedeutung hat.
4. Verwendung von Benzylchlorid
Benzylchlorid wird zur Herstellung von Benzylalkohol, Benzylbutylphthalat, Phenylessigsäure und quartären Ammoniumsalzen verwendet. Es wird auch zur Herstellung von Benzylestern, Triphenylmethanfarbstoffen, Dibenzyldisulfid, Benzylphenol und Benzylamin verwendet.
Benzylalkohol wird als Lösungsmittel, Duftstoff und Antiseptikum verwendet. Benzylbutylphthalat ist ein Weichmacher, der in Polyvinylchlorid (PVC) verwendet wird. Phenylessigsäure wird zur Herstellung von synthetischem Penicillin verwendet. Quartäre Ammoniumsalze werden als Desinfektionsmittel und Phasentransferkatalysatoren eingesetzt.
Benzylester werden in der Aromen- und Duftstoffindustrie verwendet. Als Farbstoffe und Pigmente werden Triphenylmethanfarbstoffe verwendet. Dibenzyldisulfid ist ein Antioxidans, das in Schmiermitteln verwendet wird. Benzylphenol wird als Stabilisator für Polymere verwendet. Benzylamine werden als Arzneimittel und Zwischenprodukte bei der Herstellung anderer Chemikalien verwendet.
5. Toxikologie von Benzylchlorid
Die akute orale Toxizität von Benzylchlorid beträgt bei Ratten 1230 mg/kg und bei Mäusen 1620 mg/kg. Das REACH-Registrierungsdossier legt jedoch einen niedrigeren LD50-Wert von 560 mg/kg bei Ratten nahe. Bei subkutaner Verabreichung in einer Öllösung beträgt die LD50 bei Ratten 1000 mg/kg.
Eine 2-stündige Exposition gegenüber Benzylchlorid in Konzentrationen von 100-1000 mg/m3 führte bei Ratten und Mäusen zu Schleimhautreizungen und Konjunktivitis.
In einer subchronischen Studie mit wiederholter Gabe an Ratten waren schwere akute und chronische Gastritis im Vormagen, oft begleitet von Geschwüren, sowie akute Myokardnekrose und Herzödeme die Haupttodesursachen.
Benzylchlorid ist bekanntermaßen ein starkes hautsensibilisierendes Mittel bei Meerschweinchen und weist schwache mutagene Eigenschaften auf.
In Versuchen mit Ratten führten subkutane Injektionen wöchentlicher Dosen von 80 mg/kg über ein Jahr und eine anschließende Nachbeobachtungszeit zur Entwicklung lokaler Sarkome mit Lungenmetastasen. Die mittlere Induktionszeit für diese Tumoren betrug 500 Tage.
Die dermale Anwendung von Benzylchlorid bei Mäusen führte zur Beobachtung von Hautkarzinomen.
Eine nachfolgende Studie zur Karzinogenität von in Maisöl verabreichtem Benzylchlorid ergab bei einer Dosis einen statistisch signifikanten Anstieg von Schilddrüsen-C-Zelltumoren bei weiblichen Ratten und verschiedenen Arten von Tumoren, darunter Hämangiosarkom, Vormagenkarzinom und Lungen-Alveolar-Bronchiolar-Karzinom bei Mäusen -abhängige Art und Weise.
Benzylchlorid wird leicht aus der Lunge und dem Magen-Darm-Trakt absorbiert. Nach oraler Verabreichung kommt es zur Ausscheidung verschiedener Verbindungen im Urin, darunter N-Acetyl-S-benzylcystein, Benzylalkohol, Benzaldehyd und Benzoesäure.
Für den Menschen gilt eine Konzentration von 16 ppm Benzylchlorid in der Luft bereits innerhalb einer Minute als unzumutbar. Es ist ein starkes Tränenmittel, das starke Reizungen an Augen, Nase und Rachen verursacht und das Potenzial hat, Lungenödeme auszulösen.
Obwohl es nur begrenzte Hinweise auf die Karzinogenität von α-chlorierten Toluolen und Benzoylchlorid beim Menschen gibt, wird Benzylchlorid auf der Grundlage der verfügbaren Daten und ausreichender Hinweise auf krebserzeugende Wirkungen bei Tieren nach verschiedenen Klassifizierungssystemen, einschließlich GHS, als wahrscheinlich krebserregend für den Menschen eingestuft ( Kategorie 1B), IARC (Kategorie 2A) und MAK-Klassifizierung (Kategorie 2).
Referenz
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
