Benzylalkohol: Herstellung, Reaktionen und Verwendung
Benzylalkohol ist der einfachste und wichtigste industrielle aromatische Alkohol und wurde erstmals 1832 von Liebig und Wohler aus Bittermandelöl hergestellt. Cannizzaro bestimmte seine Struktur 1853 anhand seiner gleichnamigen Reaktion, bei der Benzaldehyd durch Alkali in Benzoesäure und Benzylalkohol disproportioniert wird .
Benzylalkohol kommt natürlicherweise sowohl in freier Form als auch in Form von Estern vor, beispielsweise als Essig-, Benzoe-, Salicyl- und Zimtsäureester. Es kommt in Peru- und Tolubalsam, Hyazinthen- und Mauerblümchenöl, Ylang-Ylang-Öl und anderen ätherischen Ölen vor. Es kommt auch als Glucosid in Mais vor.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzylalkohol
Benzylalkohol ist eine farblose Flüssigkeit mit schwach aromatischem Geruch und leicht reizender Wirkung auf die Schleimhäute. Bei vielen organischen Lösungsmitteln ist es nicht vorhanden.
Die folgende Tabelle zeigt einige der physikalischen Eigenschaften von Benzylalkohol:
| Eigenschaft | Wert |
|---|---|
| Summenformel | C7H8O |
| Molekulargewicht | 108,14 g/mol |
| Siedepunkt | 205,4 °C bei 101,3 kPa |
| Schmelzpunkt | -15,4 °C |
| Brechungsindex | 1,5400 |
| Dichte | 1,061 g/cm³ bei 0 °C |
| Spezifische Wärme | 1972 J/kg·K bei 20 °C |
| Schmelzwärme | 82,9 J/g |
| Verdampfungswärme | 467,0 J/g bei 205,4 °C |
| Standard-Verbrennungsenthalpie | 34,58 kJ/g |
| Flammpunkt | 101 °C |
| Selbstentzündungstemperatur | 435 °C |
| Untere Explosionsgrenze | 1,3 Vol.-% bei 170 °C und 101,3 kPa |
| Obere Explosionsgrenze | 13,0 Vol.-% |
| Löslichkeit in Wasser | 4,0 g/100 g bei 20 °C |
| Löslichkeit von Wasser in Benzylalkohol | 5,1 g/100 g bei 20 °C |
| Dynamische Viskosität | 5,584×10⁻³ Pa·s bei 20 °C |
| Oberflächenspannung | 39,96×10⁻³ N/m bei 20 °C |
| Dipolmoment | 5,571×10⁻³⁰ C·m (1,67 D) |
| Relative Dielektrizitätskonstante | 11,92 bei 30 °C |
| Relative Dielektrizitätskonstante | 9,81 bei 60 °C |
2. Chemische Reaktionen von Benzylalkohol
Die einzigartigen Eigenschaften von Benzylalkohol sind in erster Linie auf seine Hydroxylgruppe zurückzuführen, die sich wie aliphatische Alkohole verhält. Seine Nähe zum aromatischen Ring macht es jedoch reaktiver. Benzylalkohol ist weniger sauer als isomere Kresole und löst sich daher in wässrigen Alkalien nicht vollständig auf.
Wenn Benzylalkohol mit Dehydratisierungsmitteln wie Aluminiumoxid erhitzt wird, entstehen verschiedene Verbindungen, darunter Dibenzylether, Toluol und Benzaldehyd. Dibenzylether kann auch durch Reaktion von Benzylalkohol mit Alkylhalogeniden in Gegenwart von Bis(acetylacetonato)nickel als Katalysator gebildet werden.

Bei der Oxidation von Benzylalkohol entsteht je nach Oxidationsmittel und Reaktionsbedingungen Benzaldehyd oder Benzoesäure. Beispielsweise oxidiert Salpetersäure Benzylalkohol zu Benzaldehyd, während festes Natriumpermanganat-Monohydrat ihn zu Benzoesäure oxidiert.
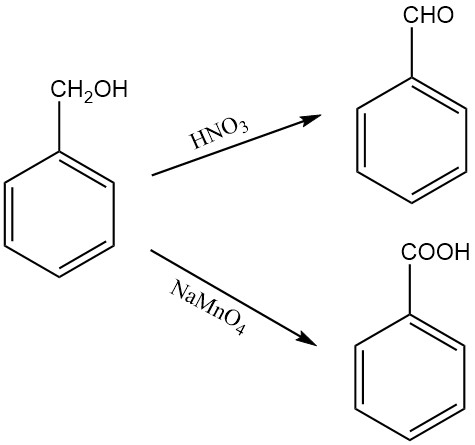
Benzylalkohol kann unter Oppenauer-Oxidationsbedingungen auch zu Benzaldehyd oxidiert werden, wobei Furfural als Wasserstoffakzeptor verwendet wird. Durch Lufteinwirkung kann Benzylalkohol allmählich zu Benzaldehyd oxidiert werden.
Bei der Dehydrierung von Benzylalkohol in der Gasphase unter Verwendung von Kupfer- oder Edelmetallkatalysatoren entsteht ebenfalls Benzaldehyd als Hauptprodukt.
Durch die Hydrierung von Benzylalkohol unter verschiedenen Bedingungen können verschiedene Produkte entstehen, darunter Toluol, Benzol, Methylcyclohexan, Cyclohexan und Hydroxymethylcyclohexan. Benzylalkohol reagiert auch mit Halogenwasserstoffen unter Bildung der entsprechenden Benzylhalogenide.

Darüber hinaus kann Benzylalkohol bei der Chlorierung der Seitenketten aromatischer Verbindungen in Benzoylchlorid umgewandelt werden. Bei der Reaktion mit Ammoniak oder Aminen kann es auch in verschiedene Alkylamine umgewandelt werden.
Friedel-Crafts-Katalysatoren können zur Alkylierung von Benzylalkohol verwendet werden. Beispielsweise ergibt die Reaktion von Benzylalkohol mit Benzol Diphenylmethan, während die Reaktion mit Phenol eine Mischung aus 2- und 4-Benzylphenolen ergibt.
Benzylalkohol reagiert mit organischen und anorganischen Säuren, Säurehalogeniden oder Säureanhydriden unter Bildung von Estern. Durch säurekatalysierte Reaktionen mit Aldehyden entstehen Acetale. Darüber hinaus ergibt die Reaktion von Benzylalkohol mit Kohlenmonoxid in Gegenwart von Carbonylkatalysatoren Phenylessigsäure.
Durch die Behandlung von Benzylalkohol mit bestimmten Katalysatoren wie wasserfreiem Aluminiumchlorid oder Zinkchlorid wird Wasser entfernt, wodurch harzige Produkte entstehen. Bereits geringe Mengen Bromwasserstoff und Eisen(II) können bei Temperaturen über 150 °C eine exotherme Polykondensationsreaktion von Benzylalkohol auslösen.
Diese Reaktion kann die Temperatur auf 240 °C erhöhen und einen plötzlichen Druckanstieg in einem geschlossenen Gefäß verursachen. Daher wird empfohlen, Benzylalkohol nicht über 100 °C zu erhitzen, es sei denn, er ist frei von sauren Verunreinigungen und gelöstem Eisen.
3. Herstellung von Benzylalkohol
Es gibt nur zwei industriell wichtige Methoden zur Herstellung von Benzylalkohol:
- Hydrolyse von Benzylchlorid
- Hydrierung von Benzaldehyd
3.1. Herstellung von Benzylalkohol durch Hydrolyse von Benzylchlorid

Die Hydrolyse von Benzylchlorid ist eine reversible Reaktion, die in Gegenwart basischer Verseifungsmittel, die die als Nebenprodukt entstehende Salzsäure neutralisieren, nahezu quantitativ durchgeführt werden kann.
Die Reaktion wird typischerweise durch Erhitzen von Benzylchlorid mit einem Überschuss einer wässrigen Lösung eines Alkali- oder Erdalkalimetalloxids, -hydroxids oder -carbonats durchgeführt. Soda ist das bevorzugte Verseifungsmittel.
Um Benzylalkohol im industriellen Maßstab herzustellen, wird typischerweise folgendes Verfahren angewendet:
- Zu 610 Teilen kochender 10 %iger Sodalösung werden unter Rühren 126,5 Teile Benzylchlorid gegeben.
- Die Reaktionsmischung wird unter Rückfluss erhitzt und gerührt, bis kein Kohlendioxid mehr entweicht (dies dauert etwa 5–6 Stunden).
- Die Reaktionsmischung wird abgekühlt und die obere Schicht, bestehend aus rohem Benzylalkohol, entfernt.
- Die nachstehende Natriumchloridlösung wird mit organischem Lösungsmittel wie Benzol oder Toluol extrahiert, um gelösten Benzylalkohol zurückzugewinnen.
- Der rohe Benzylalkohol wird durch fraktionierte Destillation bei reduziertem Druck gereinigt, um reines Produkt zu erhalten.
Die Ausbeute an Benzylalkohol beträgt bei diesem Verfahren 67 % und an Dibenzylether 8 %.
Um die Reaktionszeit zu verkürzen, kann der letzte Rückstand an Benzylchlorid nach 3-stündiger Verseifung mit Sodalösung mit Natronlauge hydrolysiert werden. Dadurch verkürzt sich die gesamte Verseifungszeit auf 4 Stunden.
Der Prozentsatz des bei der Reaktion gebildeten Dibenzylethers kann durch Verwendung eines inerten Lösungsmittels wie Benzol, Toluol oder Xylol oder durch Hydrolyse des Benzylchlorids in einem kontinuierlichen Prozess reduziert werden.
In einem neuen kontinuierlichen Verfahren werden Benzylchlorid und das alkalische Verseifungsmittel im Gegenstrom in einem inerten organischen Lösungsmittel in einem Durchflussreaktor umgesetzt. Der Alkohol wird in einer Extraktionszone durch ein inertes organisches Lösungsmittel aus der wässrigen alkalischen Phase extrahiert.
Anschließend wird der rohe Benzylalkohol in einer Waschzone mit Wasser gewaschen. Strömungsreaktor, Extraktionszone und Waschzone sind in einer speziellen Apparatur integriert. Dieses Verfahren kann bei niedrigen Reaktionstemperaturen (120–150 °C) und mit einem geringen stöchiometrischen Überschuss an Verseifungsmittel (5–25 %) durchgeführt werden.
Es wurden auch zweistufige Verfahren zur Herstellung von Benzylalkohol entwickelt, die jedoch keine große kommerzielle Bedeutung erlangten.
3.2. Herstellung von Benzylalkohol durch Hydrierung und Reduktion von Benzaldehyd
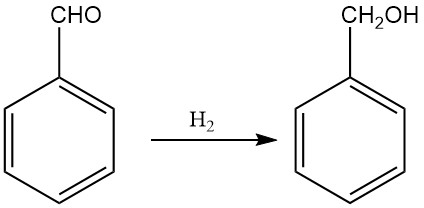
Die industrielle Produktion von Benzylalkohol durch Hydrierung von Benzaldehyd erlangte Bedeutung, da große Mengen an Benzaldehyd als Nebenprodukt des Dow-Verfahrens zur Phenolherstellung und des Snia Viscosa-Verfahrens zur Caprolactam-Herstellung zur Verfügung standen.
Abhängig von den Reaktionsbedingungen kann Benzaldehyd zu einer Vielzahl von Produkten hydriert werden, darunter Benzylalkohol, Toluol, Hydroxymethylcyclohexan und Methylcyclohexan. Durch Anpassung der Reaktionsbedingungen und Katalysatoren können jedoch hohe Ausbeuten an Benzylalkohol erzielt werden.
Geeignete Katalysatoren für die Hydrierung von Benzaldehyd sind unter anderem:
- Mit Übergangsmetallen dotiertes Raney-Nickel
- Nickel- oder Platinmetalle mit Phosphinen oder Phosphinoxiden
- Palladium kombiniert mit einem organischen Stickstoff, einer Alkalibase, Wasser oder einem anderen Übergangsmetall
Bei der Hydrierung von Benzaldehyd bei Temperaturen von 70–200 °C und einem Wasserstoffdruck von 1–4 MPa werden in kurzen Reaktionszeiten hohe Ausbeuten an Benzylalkohol erhalten.
Ein bekanntes kontinuierliches Verfahren verwendet einen Platin-Aluminiumoxid-Lithiumoxid-Katalysator, um Benzaldehyd effizient und selektiv zu Benzylalkohol zu hydrieren.
Andere Methoden, die Reduktionsmittel wie Stannan, Natriumhydrid, Zink oder Mikroorganismen verwenden, haben keine industrielle Bedeutung.
Die Cannizzaro-Reaktion wird nicht mehr industriell zur Herstellung von Benzylalkohol eingesetzt.
3.3. Herstellung von Benzylalkohol durch Oxidation von Toluol
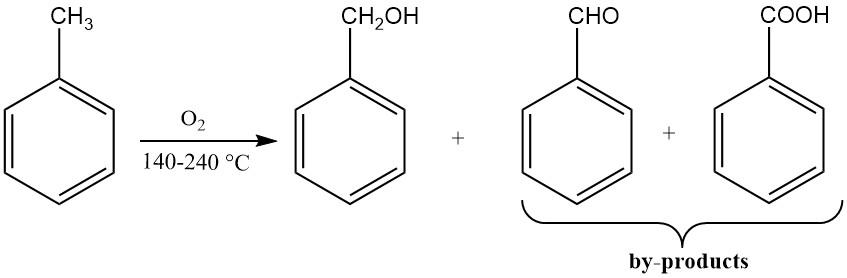
Die katalytische Oxidation von Toluol führt zu geringen Ausbeuten an Benzylalkohol, da die Reaktionsbedingungen eine weitere Oxidation zu Benzaldehyd und Benzoesäure begünstigen. Bei den meisten Benzylalkohol-Produktionsprozessen, bei denen Toluol als Rohstoff verwendet wird, entstehen Zwischenprodukte als Nebenprodukte.
Ein Verfahren besteht darin, Toluol mit sauerstoffarmer Luft bei 170–220 °C und ausreichendem Druck zu oxidieren, um das Reaktionsmedium flüssig zu halten. Diese Reaktion wird in Gegenwart von Stabilisatoren für organische Hydroperoxide wie Natriumpyrophosphat oder Natriumfluorid durchgeführt.
Lässt man nicht mehr als 10 % des Toluols reagieren, entsteht als Hauptprodukt Benzylhydroperoxid. Die anschließende Zersetzung von Benzylhydroperoxid bei 165 °C in Gegenwart löslicher Kobaltsalze ergibt Benzylalkohol.
Als Nebenprodukte entstehen Benzaldehyd und Benzoesäure. Benzylhydroperoxid kann auch mit Alkalimetallsulfiten zu Benzylalkohol reduziert werden.
Ein weiteres Verfahren besteht darin, Toluol in flüssiger Phase an der Luft in Gegenwart von Säuren, Säurechloriden oder Säureanhydriden zu oxidieren. Dabei entstehen die Benzylester dieser Säuren, die dann zu Benzylalkohol verseift werden können.
Beispielsweise ergibt die Oxidation von Toluol in Gegenwart von Essigsäureanhydrid bei 140–240 °C und 1–3 MPa Benzylacetat. Die Oxidation wird abgebrochen, nachdem 10 % des Toluols reagiert haben. Nach der Verseifung des Oxidationsprodukts können aus 500 g umgesetztem Toluol 350 g Benzylalkohol, 55 g Benzaldehyd und 67 g Benzoesäure gewonnen werden.
Im durch Oxidation von Toluol gewonnenen Benzylalkohol sind unvermeidlich phenolische Verunreinigungen wie Kresole enthalten. Diese Verunreinigungen können durch Waschen des Benzylalkoholdampfes mit einem Gegenstrom einer Alkalibenzylatlösung in einer Bodenkolonne oder einer Füllkörperkolonne entfernt werden.
3.4. Andere Herstellungsprozesse
Die Hydrierung von Benzoesäureestern zu Benzylalkohol ist eine attraktive Methode, wenn Benzoesäureester in großen Mengen hergestellt werden, beispielsweise bei der Herstellung von Dimethylterephthalat nach dem Witten-Verfahren.
Für diese Reaktion werden Kupferkatalysatoren bevorzugt. Benzoesäureester können mit einem Kupferkatalysator auf Erdalkalioxiden oder -carbonaten zu Benzylalkohol hydriert werden. Die Selektivität kann durch Zugabe von Chrom zum Katalysator verbessert werden. Die Reaktion wird typischerweise bei Temperaturen von 100–300 °C und Drücken über 6 MPa durchgeführt.
Weitere Katalysatoren für die Hydrierung von Benzoesäureestern zu Benzylalkohol sind Ruthenium, Rhodium, Platin und Palladium, aktiviert durch Alkalimetallarene, Ketyle oder Alkoxide. Diese Katalysatoren ermöglichen die Durchführung der Reaktion unter milden Bedingungen und mit hoher Selektivität.
Dreistufige Verfahren zur Herstellung von Benzylalkohol aus Toluol umfassen typischerweise die Hydrierung von Methylbenzoat in Gegenwart eines Kupfer-Chrom-Katalysators:
- Oxidation von Toluol zu Benzoesäure
- Veresterung mit Methanol
- Hydrierung von Methylbenzoat zu Benzylalkohol
Bei diesem Verfahren wird Benzylalkohol zu sehr geringen Kosten hergestellt.
Andere Prozesse wie die Hydrierung oder elektrochemische Reduktion von Benzoesäure, die Hydrolyse von Benzylsulfonsäure und die Decarboxylierung von Benzylformiat sind für die industrielle Produktion von Benzylalkohol nicht wichtig, können aber zur Herstellung von Derivaten verwendet werden, die am aromatischen Ring substituiert sind.
Benzylalkohol kann auch aus Benzylbenzoat gewonnen werden, das als Nebenprodukt bei der Benzoesäureherstellung entsteht.
4. Verwendung von Benzylalkohol
Benzylalkohol ist ein gutes Lösungsmittel für Oberflächenbeschichtungen, Harze, Celluloseester, Ether, Alkydharze, Acrylharze und Fette. Es wird auch in Tinten für Kugelschreiber, zur Verbesserung des Verlaufs und Glanzes von Oberflächenbeschichtungen sowie als Hilfsmittel beim Färben von Wolle, Polyamiden und Polyestern verwendet.
Da es einen schwachen Geruch hat, wird es als Lösungs- und Verdünnungsmittel in Parfüms und Aromen verwendet.
Benzylalkohol wird auch als Entwicklungsbeschleuniger in der Farbfotografie verwendet.
Es wird als Lokalanästhetikum in der Pharmazie und aufgrund seiner mikrobiziden Wirkung als Bestandteil von Salben und anderen Präparaten eingesetzt.
Benzylalkohol ist ein Ausgangsmaterial für viele Benzylester, die als Geruchsstoffe, Geschmacksstoffe, Stabilisatoren für flüchtige Parfüme und Weichmacher verwendet werden.
Es wird auch bei der extraktiven Destillation von m- und p-Xylolen sowie m- und p-Kresolen verwendet.
Weitere Verwendungsmöglichkeiten von Benzylalkohol sind:
- Lösungsmittel zum Reinigen und Entfetten
- Kraftstoffzusatz
- Inhaltsstoff von Körperpflegeprodukten (z. B. Shampoo, Spülung, Zahnpasta)
- Pharmazeutischer Hilfsstoff (z. B. Konservierungsmittel, Lösungsvermittler)
- Agrarchemikalien (z. B. Mitizid, Insektizid)
5. Toxikologie von Benzylalkohol
Benzylalkohol ist ein vielseitiger Duft-, Konservierungs- und antimikrobieller Wirkstoff, der in Arzneimitteln, Seifen, Reinigungsmitteln, Kosmetika und Lebensmitteln verwendet wird. Es wird von der US-amerikanischen Food and Drug Administration als „allgemein als sicher angesehen“ (GRAS) eingestuft, es wurden jedoch noch keine Grenzwerte für die Umwelt- oder Arbeitsplatzexposition festgelegt.
Benzylalkohol ist mäßig toxisch, mit akuten oralen LD50-Werten von 1,2 g/kg bei Ratten und 1,6 g/kg bei Mäusen. Es kann auch in toxischen Mengen über die Haut aufgenommen werden, wobei die dermale LD50 bei Meerschweinchen weniger als 5 ml/kg beträgt.
Benzylalkohol wird nicht als Karzinogen eingestuft und es liegen keine Daten zu seinen teratogenen oder reproduktiven Wirkungen vor. Es ist jedoch wichtig zu beachten, dass Benzylalkohol für Neugeborene hochgiftig ist und die geschätzte tödliche Dosis deutlich niedriger ist als bei Erwachsenen.
Benzylalkohol wird häufig als Konservierungsmittel in intravenösen Arzneimittellösungen verwendet, aufgrund seiner hohen Toxizität bei Neugeborenen ist jedoch Vorsicht geboten.
Benzylalkohol ist außerdem stark giftig und reizt die Augen und kann leichte bis mittelschwere Hautreizungen verursachen. Bei manchen Menschen kann es zu Überempfindlichkeitsreaktionen auf Benzylalkohol kommen, sowohl topisch als auch parenteral.
Zu den Symptomen einer Benzylalkoholvergiftung gehören Erbrechen, Durchfall, Depression des Zentralnervensystems, Erregbarkeit, Muskelparalyse, Krämpfe, Atemnot und Kollaps.
Um die Exposition gegenüber Benzylalkohol zu reduzieren, ist es wichtig, geeignete Belüftungssysteme, umluftunabhängige Atemgeräte, Schutzbrillen, Handschuhe und Kleidung zu verwenden.
Referenz
- Benzyl Alcohol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_001
