Ameisensäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Ameisensäure?
Methansäure, besser bekannt als Ameisensäure, ist die einfachste Carbonsäure mit der Formel HCOOH. Sie ist eine farblose, ätzende Flüssigkeit mit stechendem Geruch, die vollständig mit Wasser und vielen polaren Lösungsmitteln mischbar, aber nur teilweise mit Kohlenwasserstoffen mischbar ist.
Ameisensäure hat ihren Namen von Ameisen (lat. Formica), aus denen sie erstmals durch Trockendestillation gewonnen wurde. Die erste wissenschaftliche Studie über ihre Eigenschaften, „Über einige ungewöhnliche Beobachtungen und Experimente, die mit einem bei Ameisen vorkommenden Säuresaft durchgeführt wurden“, wurde bereits 1670 veröffentlicht.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Ameisensäure
Ameisensäure ist eine farblose, klare, ätzende Flüssigkeit mit stechendem Geruch. Sie ist die stärkste unsubstituierte Alkylcarbonsäure.
Die Temperaturabhängigkeit der Dichte von Ameisensäure ist in Tabelle 1 angegeben.
| Temperatur, °C | Dichte, g/cm3 |
|---|---|
| 0 | 1,244 |
| 10 | 1,232 |
| 15 | 1,226 |
| 20 | 1,220 |
| 25 | 1,214 |
| 30 | 1,207 |
| 40 | 1,195 |
| 50 | 1,182 |
| 60 | 1,169 |
| 70 | 1,156 |
| 80 | 1,143 |
| 90 | 1,130 |
| 100 | 1,117 |
Ameisensäure nimmt beim Erstarren nicht an Volumen zu und neigt zur Unterkühlung.
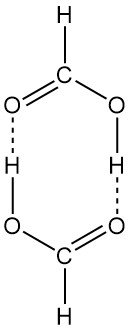
Tabelle 2 zeigt die Dampfdruckkurve von reiner Ameisensäure. Der Ameisensäuredampf weicht erheblich vom Verhalten eines idealen Gases ab, da die Moleküle in der Dampfphase teilweise dimerisieren. Bei Raumtemperatur und Normaldruck besteht der Ameisensäuredampf zu 95 % aus dimerisierter Ameisensäure.
| Flüssigkeit | Feststoff | ||
|---|---|---|---|
| Temperatur, °C | Druck (kPa) | Temperatur, °C | Druck (kPa) |
| -5,23 | 1,083 | -5,07 | 0,664 |
| 0,00 | 1,488 | 0,00 | 1,096 |
| 8,25 | 2,392 | 8,25 | 2,392 |
| 12,57 | 3,029 | - | - |
| 20,00 | 4,473 | - | - |
| 29,96 | 7,248 | - | - |
| 39,89 | 11,357 | - | - |
| 49,93 | 17,347 | - | - |
| 59,98 | 25,693 | - | - |
| 70,04 | 37,413 | - | - |
| 79,93 | 52,747 | - | - |
| 100,68 | 101,667 | - | - |
| 110,62 | 135,680 | - | - |
Die Enthalpie der Gasphasendimerisierung beträgt -63,8 kJ/mol.
Die ringförmige dimere Struktur existiert sowohl in der Dampfphase als auch in Lösung. Flüssige Ameisensäure besteht aus langen Molekülketten, die durch Wasserstoffbrücken miteinander verbunden sind. Feste Ameisensäure kann auch in zwei polymorphen Formen (α und β) isoliert werden.
Ameisensäure und Wasser bilden ein maximal siedendes azeotropes Gemisch, dessen Siedepunkt bei 107,6 °C bei 101,3 kPa liegt; es besteht aus 77,6 Gew.-% Ameisensäure und 22,4 Gew.-% Wasser.
Die Variation der dynamischen Viskosität mit der Temperatur ist in Tabelle 3 dargestellt. Die dynamische Viskosität von Ameisensäure-Wasser-Gemischen nimmt ungefähr linear ab, wenn der Wassergehalt der Ameisensäure zunimmt. Die Wärmeleitfähigkeit von Ameisensäure ist aufgrund ihrer ausgeprägten Polarität deutlich höher als die von vergleichbaren Flüssigkeiten.
| Temperatur, °C | Viskosität, mPa.s |
|---|---|
| 10 | 2,262 |
| 20 | 1,804 |
| 30 | 1,465 |
| 40 | 1,224 |
| 50 | 1,025 |
Die physikalischen Eigenschaften der Ameisensäure sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [64-18-6] |
| Formel | HCOOH |
| Molekulargewicht | 46,03 g/mol |
| Schmelzpunkt | 8,3 °C |
| Siedepunkt | 100,8 °C |
| pKa | 3,74 |
| Schmelzwärme | 276 J/g |
| Verdampfungswärme (bei Siedepunkt) | 483 J/g |
| Dielektrizitätskonstante |
Flüssigkeit (bei 20 °C): 57,9 Feststoff (bei -10,1 °C): 11,7 |
| Brechungsindex | 1,37140 |
| Oberflächenspannung σ |
(bei 20°C): 37,67×10-3 N/m (bei 40 °C): 35,48×10-3 N/m (bei 60 °C): 33,28×10-3 N/m (bei 80 °C): 31,09×10-3 N/m |
| Bildungswärme |
Flüssigkeit (bei 25 °C): -425,0 kJ/mol Dampf (bei 25 °C, Monomer): -378,57 kJ/mol (bei 25 °C, Dimer): -820,94 kJ/mol |
| Verbrennungswärme | Flüssigkeit (bei 25 °C): -254,8 kJ/mol |
| Entropie |
Flüssigkeit (bei 25 °C): 129,0 J K-1 mol-1 Dampf (bei 25 °C, Monomer): 248,88 J K-1 mol-1 (bei 25 °C, Dimer): 332,67 J K-1 mol-1 |
| Neutralisationswärme | 56,9 kJ/mol |
2. Reaktionen von Ameisensäure
Obwohl Ameisensäure bei Raumtemperatur relativ stabil ist, handelt es sich tatsächlich um eine thermisch instabile Verbindung, die zwei Hauptalternativen für die Zersetzung aufweist: Dehydratations- und Dehydrierungsreaktionen.
HCOOH → CO + H2O
HCOOH → CO2 + H2
Die in der flüssigen Phase vorherrschende Dehydratationsreaktion wird in Gegenwart von Oxidkatalysatoren oder starken Säuren begünstigt, während die Dehydrierungsreaktion durch Metallkatalysatoren gefördert wird.
Ameisensäure wird in Konzentrationen nahe 100 % besonders instabil, und dies muss bei der Lagerung hochkonzentrierter Ameisensäure berücksichtigt werden. Im Allgemeinen ist die Zersetzung von Ameisensäure eine Funktion sowohl der Säurekonzentration als auch der Temperatur.
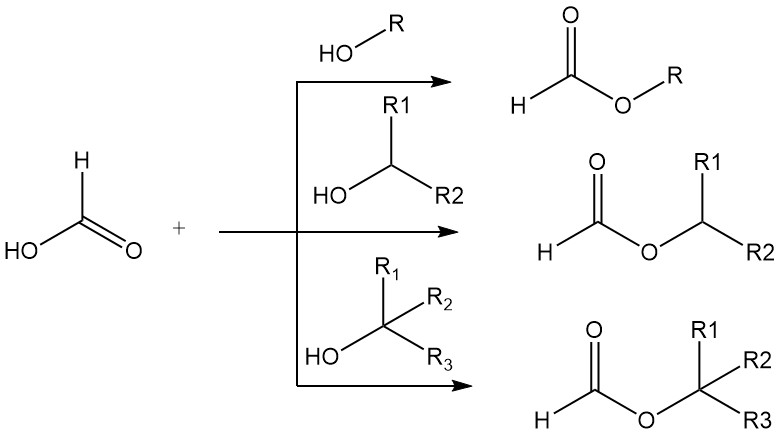
Ameisensäure weist viele der typischen chemischen Eigenschaften der aliphatischen Carbonsäuren auf, z. B. Veresterung und Amidierung, aber wie es für das erste Mitglied einer homologen Reihe üblich ist, gibt es deutliche Unterschiede in den Eigenschaften von Ameisensäure und ihren höheren Homologen.
Ameisensäure bildet Ester mit primären, sekundären und tertiären Alkoholen. Der hohe Säuregehalt der Ameisensäure macht den Einsatz von Mineralsäurekatalysatoren bei einfachen Veresterungen unnötig. Primäre und sekundäre Alkohole werden in reiner Ameisensäure 15.000–20.000-mal schneller verestert als in reiner Essigsäure.
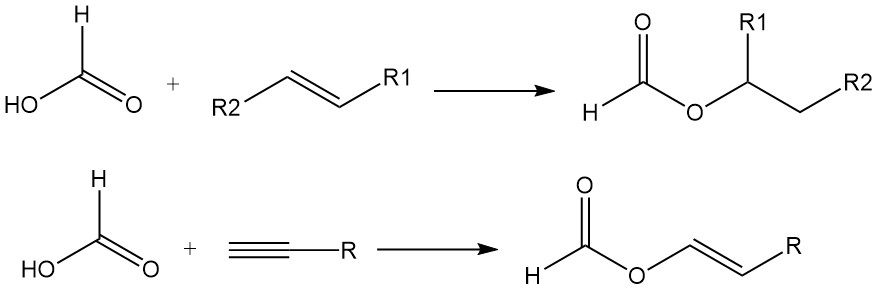
Ameisensäure bindet außerdem an die Doppelbindungen von Olefinen und bildet Ester. Acetylene reagieren in der Dampfphase mit Ameisensäure zu Vinylformiaten.
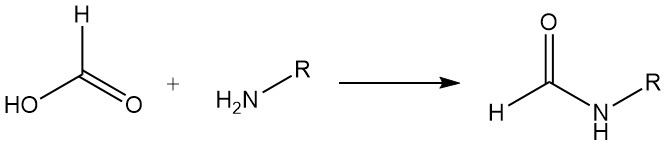
Ameisensäure reagiert mit den meisten Aminen zu Formylaminoverbindungen. Beispielsweise wird bei der Herstellung von Formamiden Ameisensäure verwendet, um eine Formylierung durch Dehydratation zu erreichen. Bei bestimmten Diaminen kommt es zur Imidazolbildung. Beide Reaktionstypen sind für die Synthese von Nutzen.
Ameisensäure und tertiäre organische Basen bilden Additionsverbindungen (Verhältnisse von Ameisensäure zu Base 3:1 und 2:1). Additionsverbindungen von Ameisensäure und Trimethylamin oder Triethylamin können als flüssige Reduktionsmittel in vielen selektiven Reduktionen verwendet werden. Die Reduktion von Schwefeldioxid zu Schwefel ist annähernd quantitativ.
Ameisensäure löst Eisen und Zink und korrodiert die meisten Stahlsorten. Die Reaktion mit Eisen ergibt Fe(II)-Formiat und Wasserstoffgas. Unter den üblichen Metallen und Legierungen zeigen Aluminium, Kupfer und Nickel eine gewisse Beständigkeit.
2 HCOOH + Fe → Fe(OOCH)2 + H2
Ameisensäure ist in relativ verdünnten Lösungen in Wasser am korrosivsten. Bei Weichstahl wird die höchste Korrosionsrate bei einer Lösungskonzentration von etwa 20 % beobachtet, bei der auch die Leitfähigkeit der Lösung am höchsten ist. Einige Korrosionsinhibitoren können einen sehr guten Schutz bieten.
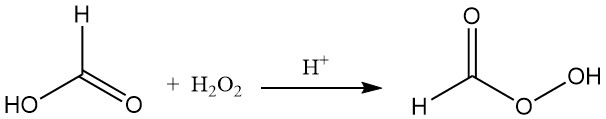
Ameisensäure reagiert in Gegenwart eines sauren Katalysators mit Wasserstoffperoxid zu instabiler Perameisensäure (HCOOOH).
Das Formylwasserstoffatom weist einen gewissen aldehydischen Charakter auf, und Ameisensäure reduziert einige Salze und Oxide zu Metallen. Sie kann auch in vielen organischen Reaktionen als Reduktionsmittel (Hydridspender) verwendet werden und H2 ersetzen.
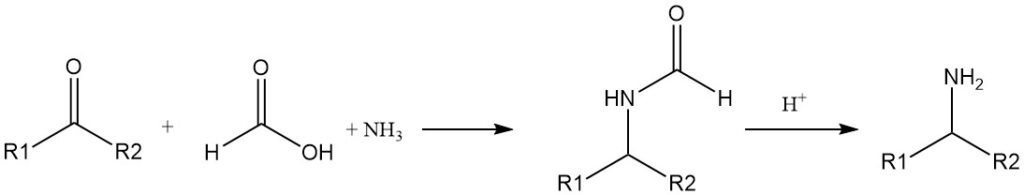
Die Reduktion von Iminen (Schiff-Basen) durch Ameisensäure ist seit langem bekannt. Primäre Amine können aus Ketonen, Ammoniak und Ameisensäure hergestellt werden (Leuckart-Reaktion).
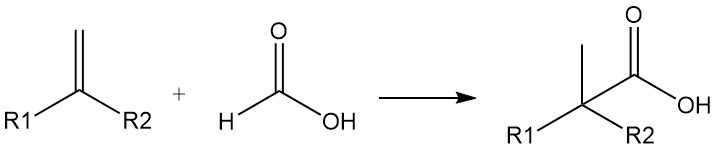
Auch Ameisensäure kann als Kohlenmonoxidquelle genutzt werden. Aus Olefinen und Ameisensäure lassen sich in Gegenwart von Schwefel- oder Flusssäure hochverzweigte Carbonsäuren herstellen (Kochsche Carbonsäuresynthese). Die Reaktion verläuft durch Zugabe von CO.
3. Herstellung von Ameisensäure
Ameisensäure wird heute hauptsächlich auf zwei Wegen hergestellt: durch Hydrolyse von Methylformiat und durch Herstellung von freier Ameisensäure aus Formiatsalzen.
Der auf Methylformiat basierende Prozess ist derzeit vorherrschend. Ungefähr 90 % der installierten Kapazität basieren auf diesem Verfahren. Die wirtschaftlichen Nachteile der früher praktizierten Methoden führten zur Entwicklung eines Verfahrens, das speziell auf die Herstellung von Ameisensäure ohne unerwünschte Nebenprodukte ausgerichtet ist.
In den 1970er Jahren wurde die Hydrolyse von Methylformiat zu Methanol und Ameisensäure von verschiedenen Unternehmen kommerziell zu einem wirtschaftlich machbaren Verfahren weiterentwickelt.
Dieses Verfahren umfasst die Carbonylierung von Methanol und die anschließende Hydrolyse des erzeugten Methylformiats. Das aus diesem Verfahren resultierende Methanol wird in die erste Stufe zurückgeführt.
Ameisensäureanlagen nach diesem Verfahren wurden 1981 bei BASF (Deutschland) und 1982 bei Kemira (Finnland) in Betrieb genommen. Neuere Großproduzenten, die dieses Verfahren anwenden, sind die chinesischen Unternehmen Feicheng Acid Chemicals und Luxi Chemical Group.
Das andere aktuelle Herstellungsverfahren umfasst die Bildung von freier Säure aus ihren Salzen. Zu diesem Zweck werden hauptsächlich Natriumformiat und Calciumformiat verwendet. Die Acidolyse wird normalerweise mit Schwefelsäure oder Phosphorsäure durchgeführt. Als Nebenprodukte entstehen Sulfat- oder Phosphatsalze.
3.1. Herstellung von Ameisensäure durch Hydrolyse von Methylformiat
Das theoretisch einfachste Verfahren zur Herstellung von Ameisensäure ist die Reaktion von Kohlenmonoxid mit Wasser. Unter 150 °C ist die Reaktion sehr langsam, und obwohl bei höheren Temperaturen schnell ein Gleichgewicht erreicht wird, muss der Druck erhöht werden, um akzeptable Ameisensäurekonzentrationen zu erhalten.
CO + H2O → HCOOH
Die thermodynamischen Hürden können umgangen werden, wenn Methylformiat als Zwischenprodukt entsteht.
Die Flüssigphasencarbonylierung von Methanol zu Methylformiat in Gegenwart eines basischen Katalysators wie Natrium- oder Kaliummethanolat (NaOCH3 bzw. KOCH3) und die anschließende Hydrolyse zu Ameisensäure werden seit Anfang der 1980er Jahre industriell praktiziert.
Kaliummethanolat ist in Methylformiat besser löslich als Natriummethanolat und weist dementsprechend eine höhere Reaktionsgeschwindigkeit auf. Das in der zweiten Stufe freigesetzte Methanol wird in die erste Stufe zurückgeführt.
CH3OH + CO → HCOOCH3
HCOOCH3 + H2O → HCOOH + CH3OH
Das Methylformiatverfahren wird beispielsweise von Eastman Chemical Company, BASF, Kemira, Luxi Chemical Group und Feicheng Acid Chemicals verwendet.
Die Reaktionsbedingungen für den ersten Carbonylierungsschritt sind in allen Verfahren weitgehend ähnlich, unterscheiden sich jedoch in ihrer Herangehensweise an die Hydrolysephase.
3.1.1. Carbonylierung
Den veröffentlichten Daten zufolge scheinen typische Reaktionsbedingungen 80 °C, 4,5 MPa Druck und 2,5 Gew.-% Natriummethoxidkatalysator zu sein. Unter diesen Bedingungen beträgt die Methanolumwandlung etwa 30 % und die Kohlenmonoxidumwandlung etwa 95 %.
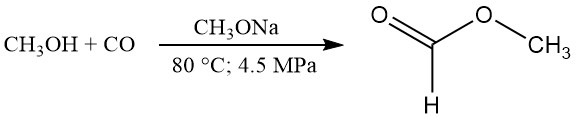
Eine nahezu quantitative Umwandlung von Methanol in Methylformiat kann durch Rückführung des nicht umgewandelten Methanols erreicht werden. Die Carbonylierungsrate kann durch Erhöhung der Temperatur, des CO-Partialdrucks, der Katalysatorkonzentration oder der Grenzfläche zwischen Gas- und Flüssigphase erhöht werden.
Als Nebenreaktion produziert der Katalysator Formiatsalze (Na und K). Formiatsalze sind in Methylformiat weniger löslich als in Methanol. Daher muss das Risiko einer Verkrustung und Verstopfung durch Ausfällung des Katalysators kontrolliert werden.
Das Kohlenmonoxid darf keine nennenswerte Menge Kohlendioxid enthalten, da sonst das katalytisch inaktive Carbonat ausgefällt wird.
Das nicht zersetzte Alkalimetallmethoxid im Methylformiat muss neutralisiert werden, um die Rückreaktion, d. h. die Zersetzung des Methylformiats in Methanol und CO bei Erhitzung, zu vermeiden.
3.1.2. Hydrolyse
Das Hydrolysegleichgewicht von Methylformiat ist relativ ungünstig, hängt aber von der Wasserkonzentration in einer Weise ab, die die Verwendung eines hohen stöchiometrischen Wasserüberschusses begünstigt, was zu Problemen bei der Suche nach einer energieeffizienten Methode zur Entfernung des überschüssigen Wassers führt.
Ameisensäure wirkt als Hydrolysekatalysator (Autokatalyse). Eine Möglichkeit, die ungünstige Lage des Hydrolysegleichgewichts zu überwinden, besteht darin, Methylformiat in Gegenwart eines Zusatzstoffs, z. B. eines tertiären Amins, zu hydrolysieren.
Die Base bildet mit Ameisensäure ein salzartiges Addukt; daher nimmt die Konzentration an freier Ameisensäure ab und das Hydrolysegleichgewicht verschiebt sich in Richtung der Produkte. In einem nachfolgenden Schritt kann Ameisensäure unzersetzt von der Base abdestilliert werden.
3.2. Herstellung von Ameisensäure aus Formiaten
Die Reaktion von Formiatsalzen mit Mineralsäuren (normalerweise Schwefelsäure) ist das älteste kommerzielle Verfahren zur Herstellung von Ameisensäure und hat noch immer industrielle Bedeutung. Perstorp ist der größte Produzent von Ameisensäure durch Acidolyse von Formiatsalzen.
Natriumformiat, Kaliumformiat und Calciumformiat sind industriell aus der Herstellung von mehrwertigen Alkoholen erhältlich.
Die Acidolyse von Formiatsalzen ist technisch unkompliziert, aber die unvermeidliche Produktion von Nebenproduktsalzen wie Natrium- und Calciumsulfat ist ein klarer Nachteil dieses Verfahrens.
2 HCOONa + H2SO4 → 2 HCOOH + Na2SO4
(HCOO)2Ca + H2SO4 → 2 HCOOH + CaSO4
Einige chinesische Patente beschreiben die Herstellung von Ameisensäure aus CO2 und Alkalimetall- oder Erdalkalimetallhydroxiden, gefolgt von einer Ansäuerung mit Phosphorsäure. Kohlenmonoxid kann bei der Phosphorproduktion entstehen. Die entstehenden Phosphatsalze werden als Düngemittel verwendet.
3.2.1. Formiate als Polyol-Nebenprodukte
Formiatsalze entstehen als Nebenprodukte bei der Herstellung von Pentaerythrit, Trimethylolpropan und 2,2-Dimethyl-1,3-propandiol (Neopentylglykol).
Pentaerythrit wird beispielsweise durch die Reaktion von Formaldehyd mit Acetaldehyd in einem wässrigen alkalischen Medium hergestellt. Der Aldehyd als Zwischenprodukt reagiert weiter mit Formaldehyd durch die Cannizzaro-Reaktion zu Pentaerythrit und Ameisensäure.
Die gebildete Ameisensäure reagiert sofort mit dem vorhandenen Alkali und ergibt das entsprechende Formiatsalz als Endprodukt.
3 HCHO + CH3CHO → (HOCH2)3CCHO
(HOCH2)3CCHO + HCHO + H2O → C(CH2OH)4 + HCOOH
HCOOH + NaOH → HCOONa + H2O
2 HCOOH + Ca(OH)2 → (HCOO)2Ca + 2 H2O
Außerdem wird das überschüssige Alkali im Prozess durch Ameisensäure neutralisiert. Das Pentaerythritprodukt wird durch schrittweise Konzentration und fraktionierte Kristallisation isoliert.
3.2.2. Formiate aus Kohlenmonoxid
Formiatsalze können durch einen direkten Prozess hergestellt werden, der auf der Reaktion von CO mit einer Base wie NaOH und KOH basiert.
NaOH (aq) + CO → HCOONa (aq)
KOH (aq) + CO → HCOOK (aq)
3.3. Herstellung von Ameisensäure aus Kohlendioxid
Die Hydrierung von Kohlendioxid in Alkohol erzeugt Ameisensäure in einer nahezu wasserfreien Umgebung, was bei der Produktgewinnung von Vorteil ist. Lösliche Ru-Komplexe sind die bevorzugten Katalysatoren, und ein Komplexbildner wird verwendet, um die Reaktion thermodynamisch günstig zu gestalten.
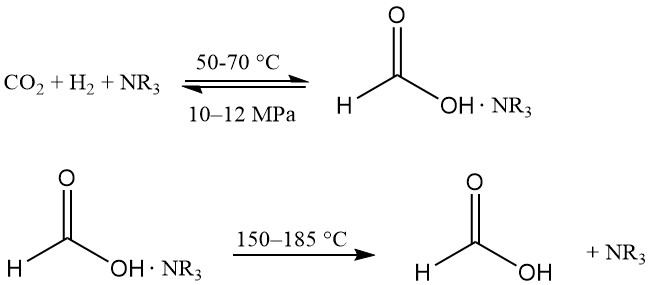
Diese Technologie wurde erstmals in den 1980er Jahren von BP Chemicals eingeführt und von BASF weiterentwickelt.
Die Reaktion findet in einer Mischung aus tertiärem Amin (normalerweise n-Trihexylamin) und Alkohol (z. B. Methanol) bei 50–70 °C und 10–12 MPa statt. Zur Erleichterung der Phasentrennung wird etwas Wasser hinzugefügt. Der Ameisensäure-Amin-Komplex wird bei 150–185 °C thermisch dissoziiert.
Der Prozess muss den teuren Übergangsmetallkomplexkatalysator aktiv halten, aber auch Spuren davon in aktiver Form bei der Ameisensäuredestillation vermeiden, da er die Zersetzung der Säure katalysieren kann. Mögliche Katalysatorrückstände können mit CO reversibel inaktiviert werden.
Es befinden sich mehrere elektrochemische Prozesse zur Herstellung von Ameisensäure oder Formiatsalz aus Kohlendioxid in der Entwicklung. Der Prozess der CO2-Elektrolyse ist im Grunde der umgekehrte Betrieb einer Brennstoffzelle. In einem Elektrolyseur wird CO2 an der Kathode reduziert, während die Sauerstoffentwicklungsreaktion an der Anode stattfindet.
In den letzten Jahren haben große Verbesserungen bei Katalysatorsystemen und Elektroden zu deutlich höheren Erträgen, faradischen Wirkungsgraden und Brennstoffeffizienzen geführt.
3.4. Herstellung von Ameisensäure aus Biomasse
Nahezu jede pflanzliche Biomasse kann mit hoher Selektivität zu Ameisensäure zu Ameisensäure, CO2 und Wasser oxidiert werden, indem Polyoxometallate als Sauerstoff liefernde Katalysatoren verwendet werden.
Die Mineralsäurehydrolyse von Zellulose und Hemizellulose bei etwa 200 °C erzeugt eine Mischung aus Lävulinsäure, Ameisensäure und Furfural. Die Gesamtreaktion von C6-Zuckern zu Lävulinsäure und Ameisensäure ist in Schema 1 dargestellt.
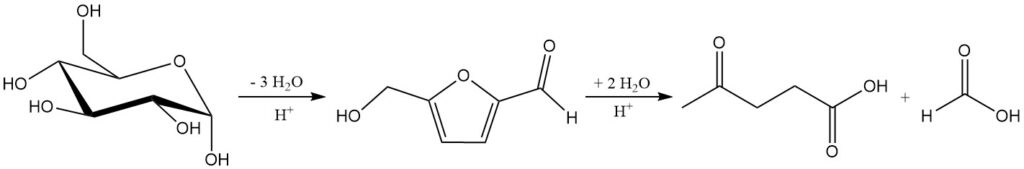
3.5. Rückgewinnung von Ameisensäure
3.5.1. Azeotrope Destillation
Ameisensäure-Wasser-Gemische können durch einfache Destillation nicht über die azeotrope Zusammensetzung hinaus konzentriert werden. Die Konzentration der Ameisensäure im azeotropen Gemisch steigt, wenn die Destillation unter Druck durchgeführt wird, aber der höhere Siedepunkt bei hohem Druck erhöht auch die Zersetzungsrate der Ameisensäure.
Eine Kombination aus Destillation unter Druck und anschließender Vakuumdestillation kann praktisch alle gewünschten Konzentrationen erzeugen.
3.5.2. Extraktion
Es wurden mehrere Technologien entwickelt, bei denen eine reaktive Extraktion verwendet wird, um Ameisensäure in eine separate organische Phase zu überführen, oder Ameisensäure an einen schwachen Komplexbildner in der Wasserphase gebunden wird. In beiden Fällen kann das Azeotrop vermieden werden.
Wenn eine Phasentrennung durchgeführt wird, ist es möglich, die Gesamtmenge an Wasser, die verdampft werden muss, zu reduzieren. Normalerweise werden sekundäre Amide oder tertiäre Amine verwendet.
Bei der Extraktivdestillation wird Ameisensäure in einer Destillationskolonne mittels eines im Gegenstrom zugeführten basischen Extraktionsmittels extrahiert, das in den Sumpf der Kolonne eingespeist wird. Erhitzt man dieses Gemisch in einer nachgeschalteten Kolonne, wird die Ameisensäure aus dem salzartigen Addukt freigesetzt und destilliert.
4. Verwendung von Ameisensäure
Aufgrund ihrer Säure, ihrer aldehydischen Natur und ihrer reduzierenden Eigenschaften wird Ameisensäure in vielen Bereichen eingesetzt. Im Gegensatz zu Mineralsäuren verdunstet Ameisensäure rückstandsfrei. In Europa wird der Großteil der Ameisensäure in der Futtermittelindustrie und als Silierhilfsmittel verwendet.
4.1. Verwendung von Ameisensäure zur Konservierung von Biomasse
4.1.1. Silage
Der Begriff Silage bezieht sich traditionell auf die Silierung von Futterpflanzen (hauptsächlich Gräser) zur Fütterung von Rindern auf Bauernhöfen. Der Verbrauch ist klimaabhängig; die Silierung auf Ameisensäurebasis eignet sich besonders für feuchte Bedingungen. Nordeuropa ist das Hauptverbrauchsgebiet.
Die Silierung basiert auf einer Fermentation unter anaeroben Bedingungen, wobei von Milchsäurebakterien produzierte Milchsäure die Silage konserviert. Milchsäure senkt den pH-Wert und verhindert so unerwünschtes mikrobielles Wachstum.
Die Zugabe von Ameisensäure führt zu einem schnellen anfänglichen Abfall des pH-Werts, was das Wachstum von Milchsäurebakterien fördert und das Wachstum von Bakterien unterdrückt, die unerwünschte Verbindungen wie Buttersäure produzieren. Wenn der pH-Abfall durch Ameisensäure verstärkt wird, wird die spontane Gärung eingeschränkt.
Zu den Vorteilen gehören mehr Restzucker und Protein. Es ist bekannt, dass die Einschränkung der Gärung einen positiven Effekt auf die freiwillige Aufnahme in der Milchkuhfütterung hat und so die Milchproduktion steigert.
Futterpflanzen wie Gras, Mais, Klee und Luzerne werden geschnitten, zerkleinert und dann in Silos oder Ballen, die mit luftdichter Folie abgedeckt sind, fermentiert. Ameisensäure eignet sich hervorragend zum Silieren von schwer zu silierenden Materialien, insbesondere von nassen oder zuckerarmen Futterpflanzen, die auch eine hohe Pufferkapazität haben können.
Ameisensäure wird auch verwendet, um die Fermentation beim Silieren von gekräuseltem, feuchtigkeitsreichem Getreide einzuschränken.
Nebenprodukte der Lebensmittel- und Getränkeindustrie, wie z. B. verbrauchte Maische aus Brauereien, können mit Ameisensäurelösungen konserviert werden, um Tierfutter mit langer Haltbarkeit bereitzustellen.
Ameisensäure wird in verschiedenen Formulierungen verwendet, manchmal in Mischungen mit anderen kurzkettigen organischen Säuren wie Propionsäure, und wird oft mit einem Formiatsalz gepuffert, um die Handhabungssicherheit zu erhöhen und Korrosion zu reduzieren.
4.1.2. Tierische Biomasse
Tierische Biomasse kann auch mit Ameisensäure konserviert werden. Die größte Verwendung findet sie bei der Verarbeitung von Nebenprodukten der Fischindustrie zur Herstellung von Fischsilage. Die ordnungsgemäße Behandlung von Fischabfällen wird häufig durch Umweltgesetze vorgeschrieben, und die Herstellung von Fischsilage kann eine wirtschaftlich sinnvolle Lösung sein.
Fischsilage ist ein flüssiges, proteinreiches Produkt, das durch Senkung des pH-Werts von zerkleinerten Fischteilen mit einem sauren Konservierungsmittel hergestellt wird. Unter diesen Bedingungen produzieren die Enzyme aus den Fischinnereien in wenigen Tagen das endgültige, lange haltbare Produkt.
Ameisensäure ermöglicht auch eine effiziente Trennung von Fischöl während des Silierprozesses. Die Säure wirkt auch als Verarbeitungshilfsmittel, indem sie die mikrobielle Gasbildung („Kochen“) reduziert. Fischsilage kann als Fisch- und Schweinefutter oder als Rohstoff für Fischmehl und -öle verwendet werden.
Ameisensäure ist die bevorzugte Säure für diese Anwendung, normalerweise in Kombination mit einem geeigneten Antioxidans. Die Anwendung ist in den wichtigsten Lachs produzierenden Ländern, z. B. Norwegen, eine Standardmethode und wird voraussichtlich mit der Intensivierung der Aquakultur, insbesondere in Ost- und Südostasien, an Bedeutung gewinnen.
Schlachtabfälle können ähnlich wie Fischabfälle mit Säuren, meist Ameisensäure-Milchsäure-Mischungen, konserviert werden. Die Produkte sind für Pelztiere und, mit Einschränkungen, für Tierfutter geeignet.
4.2. Verwendung von Ameisensäure in der Lederindustrie
Einer der weltweit größten Verbraucher von Ameisensäure ist die Gerbereiindustrie. Da die Gerbereiindustrie in Niedriglohnländer abgewandert ist, waren die Wachstumszahlen in Asien sehr hoch und kompensierten den Rückgang in Europa und Nordamerika.
China ist der größte Lederproduzent und macht etwa 30 % der Weltproduktion aus.
Durch die Vorbehandlung der Häute bleiben diese in einem leicht alkalischen Zustand, aber zum Gerben sind saure Bedingungen erforderlich. Daher werden die Häute vor dem Gerben in einem als Beizen bezeichneten Prozess mit Säure (normalerweise Schwefel- und Ameisensäure) behandelt.
Ohne diese Behandlung würden sich die Gerbstoffe schnell an der Oberfläche der Haut festsetzen, während die innere Schicht roh bliebe.
Schwefelsäure senkt den pH-Wert der Lauge, während Ameisensäure in der Lage ist, schnell und gleichmäßig durch die Kollagenfasern zu dringen. Sie stellt sicher, dass das Gerbmittel (normalerweise basisches Chromsulfat) die gesamte Dicke der Haut durchdringt.
Beim Färben von Leder wird Ameisensäure als Egalisierungsmittel verwendet, um die Farbe von einem Bereich des Leders in einen anderen zu bewegen, was zu einer gleichmäßigeren und glatteren Farbverteilung führt.
4.3. Verwendung von Ameisensäure in Textilien
In der Textilindustrie wird Ameisensäure als pH-regulierendes Mittel beim Färben von Wolle, Nylon und anderen natürlichen und synthetischen Fasern mit Säure- und Chromfarbstoffen verwendet. Darüber hinaus wird Ameisensäure verwendet, um alkalische Lösungen zu neutralisieren und das Spülen beim Waschen zu erleichtern.
Der verbesserte Lebensstandard und die erhöhte Faserproduktion, insbesondere für Exportmärkte, werden voraussichtlich die Nachfrage nach Ameisensäure beim Färben und Veredeln von Textilien in Asien erhöhen.
4.4. Verwendung von Ameisensäure als Futterzusatz
Organische Säuren und Salze haben eine lange Geschichte in der Futtermittelindustrie, wo sie häufig als Konservierungsmittel und zur Ansäuerung von Ferkelfutter verwendet werden. Seit 2006, als die EU antibiotische Wachstumsförderer (AGPs) verbot, hat die Verwendung von organischen Säuren in Futtermitteln zugenommen.
Ameisensäure hat eine starke Ansäuerungswirkung, aber auch antimikrobielle Wirkungen, die zum Schutz von Futter und Trinkwasser vor bakterieller Kontamination verwendet werden. Ameisensäure ist bei einem pH-Wert von 4,0 sehr wirksam gegen Salmonellen, Escherichia coli und Campylobacter.
Sie wirkt sich positiv auf die Darmflora von Tieren aus und kann sowohl die scheinbare Verdaulichkeit von Energie und Protein als auch die Aufnahme und Speicherung einiger Mineralien verbessern. Sie scheint die Wachstumsleistung von abgesetzten Ferkeln und Mastschweinen bei niedrigeren Dosierungen als andere organische Säuren und Salze zu verbessern.
In der Geflügelindustrie wird Ameisensäure seit langem verwendet, um das Wachstum von Krankheitserregern in Futtermitteln und Futtermaterialien zu verhindern. Mischungen von Ameisensäure mit Propionsäure, Milchsäure oder mittelkettigen Fettsäuren haben eine breitere antimikrobielle Wirkung als Ameisensäure allein.
4.5. Verwendung von Ameisensäure in Arzneimitteln und Lebensmittelzusatzstoffen
Pharmazeutika und Lebensmittelchemikalien sind schätzungsweise der größte einzelne Sektor, in dem Ameisensäure in Asien (hauptsächlich in China) verwendet wird.
Ameisensäure wird als synthetisches Zwischenprodukt für verschiedene Arzneimittel und Lebensmittelchemikalien verwendet, darunter synthetisches Insulin (Reinigung von rekombinantem Insulin), Koffein, Aspartam und Vitamin B1. Sie wird auch häufig zur pH-Anpassung bei der Herstellung verschiedener Chemikalien verwendet.
Weitere Anwendungen in Lebensmitteln umfassen die Dekontamination von Salmonellen und die Verwendung als Konservierungsmittel (E236, in den USA, aber nicht in der EU, Australien und Neuseeland zugelassen) und als Aromastoff.
Die Verwendung von Ameisensäure zur Lebensmittelkonservierung umfasst die Begasung von Obst wie Äpfeln und Kirschen, um Fäulnis nach der Ernte zu reduzieren. Ameisensäure ist besonders wirksam bei der Zerstörung von Pilzsporen auf Oberflächen und Behältern, in denen Obst gelagert wird.
Bei einigen Anwendungen zur Lebensmittelkonservierung wird Ameisensäure mit Milchsäure und/oder Propionsäure gemischt. Die Mischung ist minimal ätzend, aber aufgrund ihres niedrigen pH-Werts hilft sie, schädliche Mikroorganismen zu zerstören und verhindert deren Ausbreitung, wodurch die Haltbarkeit des Produkts verlängert wird.
4.6. Andere Verwendungen
4.6.1. Gummikoagulation
Ameisensäure wird bevorzugt zur Koagulation von Latex eingesetzt, einer Suspension mikroskopisch kleiner Naturkautschukpartikel (Polyisopren) in einem wässrigen Medium. Die Oberflächen der Latexpartikel sind geladen, wodurch eine Abstoßung zwischen ihnen entsteht und eine Koagulation verhindert wird.
Beim Koagulationsprozess neutralisiert Ameisensäure diese Ladungen und beseitigt die Abstoßung. Das Ergebnis des Prozesses ist ein gleichbleibendes, hochwertiges Naturkautschukprodukt. Die Verwendung stärkerer Säuren führt zu einem zu schnellen und inhomogenen pH-Abfall. Dadurch koaguliert der Latex ungleichmäßig, was seine mechanischen Eigenschaften beeinträchtigen kann.
Schwächere Säuren wie Essigsäure sind weniger effizient als Ameisensäure und führen zu einem viel höheren Säureverbrauch.
4.6.2. Gasentschwefelung
Ameisensäure wird als Entschwefelungskatalysator bei der Rauchgasentschwefelung von Kohlekraftwerken verwendet. Schwefel, dessen Gehalt in Kohle bis zu 5 % betragen kann, wird beim Brennprozess als Schwefeldioxid freigesetzt.
Das Auffangen von Schwefeldioxid durch Leiten des Rauchgases durch eine wässrige Kalksteinaufschlämmung führt zu Gips (Calciumsulfat). Die Zugabe von Ameisensäure zum Entschwefelungszyklus erhöht die Effizienz der Schwefelabtrennung.
4.6.3. Bohrlochsäuerungsmittel
Ameisensäure wird zur Stimulation von Hochtemperaturbohrungen in Öl- und Gasfeldern verwendet, wenn die herkömmlichen Salzsäuresysteme (HCl) nicht ausreichend gehemmt werden können.
Die Bohrlochsäuerung wird erreicht, indem Säure in die Bohrung gepumpt wird, um Kalkstein, Dolomit und Kalzitzement zwischen den Sedimentkörnern der Reservoirgesteine aufzulösen.
Ameisensäure hat den Vorteil einer guten Hemmung gegen Rohrkorrosion bei Temperaturen von bis zu 200 °C (möglicherweise verursacht durch eine Schutzschicht aus Zersetzungsprodukten).
Gemischte HCl-Ameisensäure kann weitere Vorteile bieten. Ameisensäure dissoziiert in Gegenwart von HCl nicht, daher findet keine Reaktion mit dem Karbonat statt, bis das HCl praktisch verbraucht ist. HCl/Ameisensäure-Gemische können daher eine größere Durchdringung erreichen.
4.6.4. Ameisensäure als Quelle von Wasserstoff und Kohlenmonoxid
Unter Hydrolysebedingungen kann das Formiat-Ion ein Bicarbonat-Ion und Wasserstoff bilden.
HCO2– + H2O → HCO3– + H2
Sowohl Palladium als auch Kohle haben sich als aktive Katalysatoren erwiesen.
Die Dehydrierungsreaktion wird durch Metallkatalysatoren gefördert.
HCOOH → CO2 + H2
Das Interesse an der Wasserstofferzeugung in Brennstoffzellen auf Basis von Ameisensäure oder Kaliumformiat ist gestiegen. Lange Betriebszeiten und sofortiges Aufladen ohne Abhängigkeit von der Steckdose sind die Vorteile bei der Anwendung in tragbaren Geräten.
Die Zersetzung von Ameisensäure in Gegenwart starker Säuren wie Schwefelsäure ist eine saubere CO-Quelle für die auf Kohlenmonoxid basierende Chemie.
Ameisensäure oder ihre Salze können als Wasserstoffquelle in chemischen Reaktionen verwendet werden, ohne dass H2 als Zwischenprodukt entsteht (Leuckart-Reaktionsmechanismus). Die als Transferhydrierung bekannte Reaktion ist selektiv und wird von vielen Metallen, sogar Zinkpulver, katalysiert.
Bei Verwendung chiraler Katalysatorkomplexe kann Ameisensäure als Wasserstoffquelle bei der asymmetrischen Hydrierung dienen, einem üblichen Reaktionsschritt bei der Synthese vieler Feinchemikalien und Pharmazeutika.
4.6.5. Reinigungsmittel
Ameisensäure wird als Wirkstoff in kommerziellen Reinigungsprodukten wie Entkalkern, Rostlösern, Mehrzweckreinigern und Entfettern sowie in gewerblichen Waschmitteln verwendet. Beim Entkalken bildet sich Calciumsalz, wenn Calciumcarbonat durch eine Säure aufgelöst wird.
Je leichter dieses Salz löslich ist, desto geringer ist das Risiko von Salzablagerungen, die die Wirksamkeit der Säure verringern. In Badezimmerreinigern soll es die Eigenschaften eines effizienten Entkalkungsmittels mit denen eines biologisch abbaubaren Biozids kombinieren.
4.6.6. Verwendung als Lösungsmittel
Ameisensäure kann zum Auflösen von Polyamiden (z. B. Nylon 66 und Nylon 46) oder Seide verwendet werden, um Fasern und Membranen herzustellen. Sie ist auch ein nützlicher Bestandteil in Halbleiterreinigungslösungen.
5. Toxikologie von Ameisensäure
Ameisensäure weist je nach Expositionsweg (Einatmen, Verschlucken oder Hautkontakt) und Konzentration eine Reihe toxischer Wirkungen auf.
Akute Toxizität:
- Haut und Schleimhäute: Ameisensäure ist ätzend und kann bei Hautkontakt Nekrose (Gewebetod) und Reizung/Verätzung der Schleimhäute an der Eintrittsstelle (Augen, Mund, Nasengänge) verursachen.
- Verschlucken: Der Methanolstoffwechsel kann toxische Mengen an Ameisensäure erzeugen, was zu einer metabolischen Azidose führt. Die orale Einnahme von Ameisensäurelösungen kann zu schweren Reizungen und Verätzungen des Magen-Darm-Trakts führen.
- Einatmen: Das Einatmen von Ameisensäuredämpfen reizt die Atemwege, wobei die Schwere mit der Konzentration zunimmt. Hohe Konzentrationen können tödlich sein.
- Dermale Absorption: Ameisensäure kann leicht durch die Haut absorbiert werden, was zu systemischen Wirkungen führt.
Die LD50 nach oraler Verabreichung beträgt bei Ratten 730 mg/kg.
Bei Ratten beträgt die LC50 nach 4-stündiger Inhalation des Dampfes 7,85 mg/l. Die vorherrschenden Symptome der inhalativen Aufnahme sind Reizung der Augen, Reizung und Verätzung der Nasenschleimhäute und Hornhauttrübung.
Bei Kaninchen führt die intravenöse Verabreichung von gepufferter Ameisensäure im Bereich von 0,46–1,25 g pro Kilogramm Körpergewicht zu einer ZNS-Depression; höhere Dosierungen verursachen Krämpfe. Subkutan verabreichte Dosen von 0,8 g/kg bei Hunden und über 0,4 g/kg bei Katzen führen zu Taumeln, während eine Dosis von 0,4 g/kg bei Katzen zu Schläfrigkeit führt.
Bei Hunden führen intravenös verabreichte tödliche Dosen zu tonischen und klonischen Krämpfen.
Chronische Exposition gegenüber Ameisensäure in niedrigen Konzentrationen in Tierstudien zeigte keine signifikanten Auswirkungen auf Körpergewicht oder Organgewicht. Sie kann jedoch den Glutathionspiegel in Leber und Nieren senken.
Ameisensäure hat in verschiedenen In-vitro- und In-vivo-Tests kein genotoxisches Potenzial gezeigt. Einige Studien deuten jedoch auf einen verwirrenden Effekt eines niedrigen pH-Werts bei hohen Konzentrationen hin, der weiterer Untersuchungen bedarf.
Referenz
- Ameisensäure, Ullmanns Enzyklopädie der industriellen Chemie. – https://onlinelibrary.wiley.com/doi/full/10.1002/14356007.a12_013.pub3
