Acétamide : propriétés, production et applications

Qu’est-ce que l’acétamide ?
L’acétamide, également appelé éthanamide ou amide d’acide acétique, est un composé organique de formule chimique C2H5NO. C’est un solide blanc, inodore et hygroscopique formé d’acide acétique et d’ammoniac. L’acétamide est naturellement présent dans les racines de betteraves sucrières et dans les terrils de déchets de mines de charbon, comme sous-produit mineur de la dégradation des matières organiques.
Table des matières
1. Propriétés physiques de l’acétamide
L’acétamide pur a un goût amer et est inodore. Son odeur caractéristique de souris est attribuée à des traces d’impuretés, probablement issues de l’acétonitrile. L’acétamide se présente sous deux formes cristallines : une forme trigonale stable et une forme orthorhombique métastable. Il est très soluble dans l’eau, l’éthanol, le chloroforme, la glycérine et le benzène chaud, et légèrement soluble dans l’éther diéthylique.
Le tableau 1 présente les principales propriétés physiques de l’acétamide.
| Propriété | Valeur |
|---|---|
| Numéro de registre CAS | 60-35-5 |
| Formule moléculaire | C2H5NO |
| Masse molaire | 59,07 g·mol−1 |
| Point de fusion | 81–82 °C |
| Point de fusion (trigonale) | 80,0–80,1 °C |
| Point triple | 353,33 K |
| Point d'ébullition (1 atm) | ≈221 °C |
| Densité (20 °C) | ≈1,16 g/cm3 |
| Densité de fusion à 85 °C | 0,9986 g·mL−1 |
| Chaleur de fusion (ΔHm) | 264 kJ·kg−1 |
| Constante diélectrique | 59 |
| Moment dipolaire | 12,41 × 10−30 C·m |
| Pression de vapeur à 272 K | 10 kPa |
| Pression de vapeur à 278 K | 20 kPa |
| Pression de vapeur à 281 K | 30 kPa |
| Pression de vapeur à 284 K | 40 kPa |
| Pression de vapeur à 285 K | 50 kPa |
| Pression de vapeur à 287 K | 60 kPa |
| Pression de vapeur à 288 K | 70 kPa |
| Pression de vapeur à 290 K | 80 kPa |
| Pression de vapeur à 291 K | 90 kPa |
| Pression de vapeur à 292 K | 100 kPa |
2. Propriétés chimiques de l’acétamide
L’acétamide est un amide aliphatique simple et présente les propriétés caractéristiques de la fonction amide.
L’acétamide présente un comportement amphotère lorsqu’il est dissous dans l’eau. L’hydrolyse en eau neutre est lente, mais en présence d’acides ou de bases forts, il réagit instantanément pour produire de l’acide acétique et de l’ammoniac.
La constante d’autodissociation de l’acétamide est d’environ 3,2 × 10-11 à 94 °C, ce qui démontre une faible tendance à l’auto-ionisation dans des conditions thermiques.
L’acétamide réagit avec les acides minéraux pour former des complexes solides. Des sels de bromure d’hydrogène, de chlorure d’hydrogène et d’acide nitrique avec l’acétamide ont été isolés et caractérisés.
La phase fondue de l’acétamide est utilisée pour dissoudre les sels métalliques dont la conductivité, la stabilité et l’aptitude à l’électrodéposition ont été évaluées.
3. Production d’acétamide
L’acétamide est obtenu par plusieurs voies de synthèse. Sa production industrielle se fait par déshydratation continue de l’acétate d’ammonium, méthode standard de laboratoire.
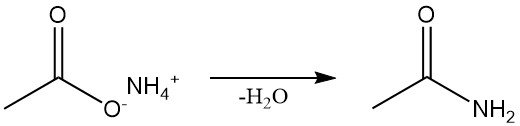
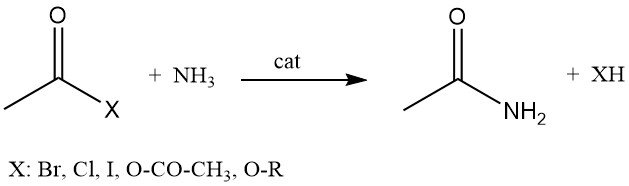
L’acétamide peut également être produit par la réaction d’halogénures d’acétyle, d’anhydride acétique ou d’alkyle acétates avec de l’ammoniac.
Une autre méthode de fabrication de l’acétamide consiste à hydrater l’acétonitrile en présence de catalyseurs acides ou basiques. Ce procédé est largement utilisé car l’acétonitrile est un sous-produit de la fabrication de l’acrylonitrile.
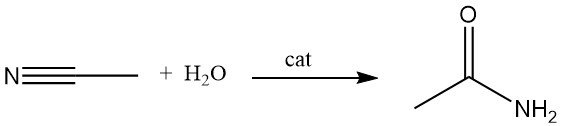
L’hydratation de l’acétonitrile catalysée par le cuivre peut atteindre des rendements de conversion allant jusqu’à 83 %. Certains micro-organismes sont également capables de catalyser cette réaction à température ambiante.
4. Utilisations de l’acétamide
L’acétamide est utilisé comme solvant et comme plastifiant. Ses applications sont nombreuses et variées dans de nombreux secteurs industriels.
L’acétamide inhibe l’accumulation d’acide dans les encres d’impression, les laques, les explosifs et les parfums. Il est utilisé comme hydratant doux et comme agent adoucissant pour le cuir, les textiles, le papier et certains plastiques.
L’acétamide est également utilisé comme intermédiaire dans la synthèse de produits pharmaceutiques, de pesticides et d’antioxydants pour plastiques. Des dérivés de l’acétamide, notamment des thiourées substituées contenant de l’acétamide, ont été étudiés pour leur activité antivirale contre les virus de l’herpès.
L’acétamide est utilisé comme plastifiant et stabilisant dans la production de polymères. Il a été étudié comme agent cryoprotecteur et comme composant de lubrifiants et de formulations ignifuges.
Certains dérivés de l’acétamide sont utilisés comme modificateurs du comportement alimentaire dans les études agricoles.
En recherche en laboratoire, l’acétamide est souvent utilisé comme composé modèle pour étudier les propriétés structurales et de liaison hydrogène des amides.
5. Toxicologie de l’acétamide
L’acétamide a été utilisé comme source d’azote non protéique chez les ruminants, tels que les ovins et les vaches laitières. Des concentrations alimentaires d’environ 2 à 3 % semblent non toxiques. L’ajout d’acides dibasiques tampons dans l’alimentation permet un apport plus élevé en éliminant l’ammoniac libéré lors de la digestion.
Le Centre international de recherche sur le cancer (CIRC) classe l’acétamide comme cancérogène possible pour l’homme (Groupe 2B).
L’exposition orale chronique chez le rat a démontré une hépatocarcinogénicité : l’administration pendant un an de 2,36 % d’acétamide dans l’alimentation a entraîné un cancer du foie. Des études complémentaires ont révélé des effets hépatotoxiques et hématopoïétiques.
Le mécanisme précis de la toxicité de l’acétamide reste flou. Son profil diffère de celui du diméthylacétamide et semble lié à la formation d’hydroxylamine à partir de son principal métabolite, l’acide acétohydroxamique.
L’acétamide ne présente pas de toxicité sur le développement. Les études de reproduction menées chez les rongeurs n’ont pas mis en évidence d’altération de la spermatogenèse, de modifications hormonales ni de lésions des organes reproducteurs accessoires.
Chez la souris, l’administration orale d’acétamide a induit des tumeurs hépatiques bénignes et malignes. L’incidence des lymphomes malins a également augmenté chez les souris mâles. Globalement, ces résultats étayent la classification de l’acétamide comme hépatocarcinogène chez les rongeurs, avec un potentiel cancérogène chez l’homme.
Références
1. Wagner, F.S., Jr. (2002). Acetamide. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a02.pub2
2. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
3. Mohammadi, S.; Foroumadi, A. Acetamide. In *Encyclopedia of Toxicology*, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 39–42. DOI: 10.1016/B978-0-12-824315-2.01089-7
