Acide sorbique : propriétés, réactions, production et utilisations
Qu’est-ce que l’acide sorbique ?
L’isomère trans, trans de l’acide 2,4-hexadiénoïque, communément appelé acide sorbique, est un acide gras insaturé à chaîne courte dont la formule chimique est C6H8O2. Il s’agit d’un acide organique naturel qui se présente sous la forme d’un solide incolore à l’odeur légère.
L’acide sorbique tire son nom de « Sorbus aucuparia Linnaeus », la nomenclature scientifique du sorbier. En 1859, Hofmann a isolé par distillation une huile à l’odeur caractéristique des baies de sorbier non mûres.
Le constituant principal de cette huile était l’acide parasorbique, identifié comme la d-lactone de l’acide sorbique. Les acides forts, ou alcalis, catalysent la conversion de l’acide parasorbique en acide sorbique isomérique. Les baies de sorbier non mûres contiennent environ 0,1 % d’acide parasorbique.
L’acide sorbique se trouve dans les dépôts graisseux de certains pucerons sous forme de 2-sorboyl-1,3-dimyristine. Doebner a établi la structure de l’acide sorbique en 1890, et il a été synthétisé pour la première fois en 1900.
Müller (Allemagne) et Gooding (États-Unis) ont découvert indépendamment les propriétés antimicrobiennes de l’acide sorbique en 1939-1940. La production industrielle d’acide sorbique et de sorbate de potassium a commencé dans les années 1950, d’abord aux États-Unis, puis en Allemagne et au Japon.
L’acide sorbique est utilisé comme conservateur alimentaire principal en raison de sa sécurité et de ses caractéristiques sensorielles favorables.
Table des matières
1. Propriétés physiques de l’acide sorbique
L’acide sorbique forme des cristaux en forme d’aiguilles ou de plaques avec une odeur douce et caractéristique et un goût légèrement acide. Sa solubilité dans l’eau est limitée, avec des valeurs de 0,16 g, 0,58 g et 3,9 g pour 100 ml à 20 °C, 50 °C et 100 °C, respectivement.
La solubilité de l’acide sorbique dans les alcools anhydres de faible poids moléculaire et dans l’acide acétique anhydre est d’environ 11 à 12 g pour 100 ml. Les graisses liquides peuvent dissoudre 0,5 à 1 g d’acide sorbique pour 100 ml.
L’acide sorbique est volatil dans la vapeur sans se décomposer. Cette propriété est utilisée pour son isolement analytique à partir de produits alimentaires.
Les propriétés physiques importantes de l’acide sorbique sont répertoriées dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [110-44-1] |
| Formule | C6H8O2 |
| Masse moléculaire | 112,13 g/mol |
| Point de fusion | 132–135 °C |
| Point d'ébullition | 228 °C (décomposition) |
| Température de sublimation | supérieure à 60 °C |
| Indice de réfraction | 1,4248 |
| Densité | 1,204 g/cm3 |
| Constante de dissociation | 1,73×10-5 à 25 °C |
| pKa | 4,76 |
| Pression de vapeur à 20 °C | <0,001 kPa |
| Pression de vapeur à 100 °C | 0,25 kPa |
| Pression de vapeur à 120 °C | 1,3 kPa |
2. Réactions chimiques de l’acide sorbique
La réactivité de l’acide sorbique est caractérisée par la présence d’un groupe carboxyle et d’un système de double liaison conjuguée.
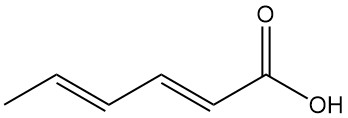
Les réactions des acides carboxyliques comprennent des réactions typiques comme la formation de sels, d’esters et d’autres dérivés. L’hydrure de lithium et d’aluminium réduit sélectivement le groupe carboxyle en alcool sorbylique (2,4-hexadiène-1-ol).
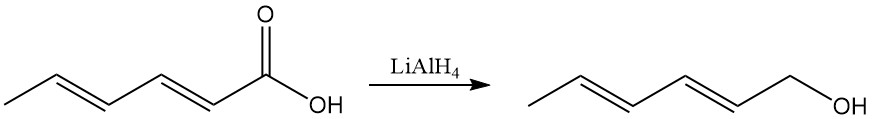
Contrairement à l’acide sorbique, les sels alcalins ont une solubilité dans l’eau plus élevée, ce qui les rend préférés pour les systèmes de conservation aqueux. Le sorbate de potassium est produit à partir d’acide sorbique et d’hydroxyde de potassium et présente une bonne solubilité dans l’eau.
Le sorbate de calcium est formé d’acide sorbique et d’hydroxyde de calcium et se caractérise par une faible solubilité dans l’eau.
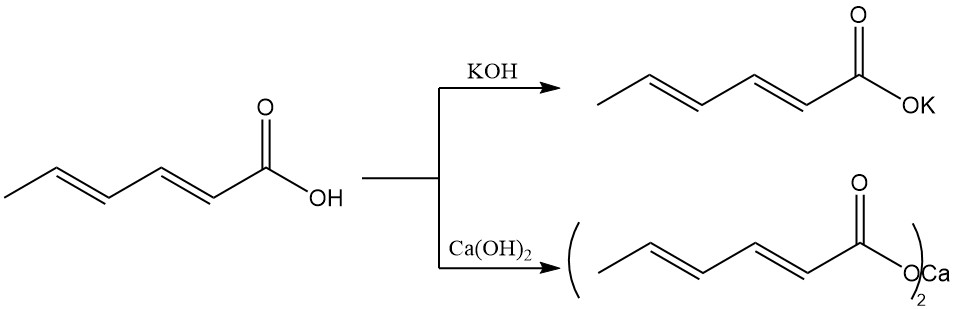
Les esters de sorbate d’alkyle inférieur possèdent des propriétés antimicrobiennes et sont actifs dans des environnements neutres et faiblement alcalins, contrairement à l’acide sorbique.
Les réactions impliquant le système de double liaison produisent souvent des mélanges de produits complexes en raison des réactivités variables des doubles liaisons et des isomérisations, réarrangements, migrations et polymérisations potentielles.
Les réactions d’addition et d’hydrogénation partielle ciblent préférentiellement la double liaison 4,5.
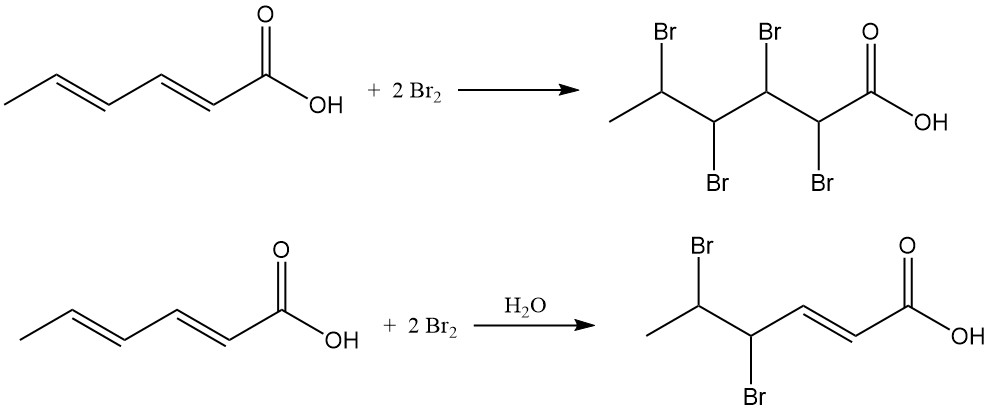
L’ajout de chlore produit des mélanges d’acide chlorohexénoïque avec une teneur moyenne en chlore de 38 à 48 % en poids. La réaction du brome avec l’acide sorbique dans des solvants organiques produit de l’acide 2,3,4,5-tétrabromohexanoïque, tandis que la bromation aqueuse produit principalement de l’acide 4,5-dibromo-2-hexénoïque.
Malgré sa double insaturation, l’acide sorbique cristallin pur présente une grande résistance à l’oxydation à l’air et reste stable pendant des années à température ambiante. Cependant, les impuretés telles que les solvants, les métaux lourds ou les acides hexadiénoïques isomères réduisent considérablement sa stabilité.
Des considérations similaires s’appliquent au sorbate de potassium, tandis que le sorbate de sodium est instable sous forme solide et n’est pas produit commercialement. Le sorbate de sodium se transforme rapidement en sel de sodium de l’acide 4,5-époxy-2-hexénoïque en présence d’air.
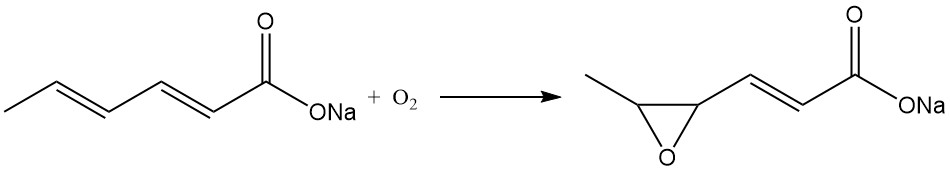
L’oxydation des sorbates aqueux ou de l’acide sorbique dans des solvants organiques génère de nombreux composés carbonylés, bien que cette réaction dépende de la présence d’une grande quantité d’oxygène et soit fortement augmentée par l’exposition au soleil.
Les solutions sans oxygène restent stables même sous l’exposition à la lumière. L’acide sorbique dans les aliments à humidité intermédiaire subit une dégradation progressive sur plusieurs mois en présence d’air.
L’oxydation de solutions aqueuses acides d’acide sorbique avec du dichromate de potassium produit du malonaldéhyde. La réaction du malonaldéhyde avec l’acide 2-thiobarbiturique produit un adduit rouge fluorescent 1:2 (malonaldéhyde:acide 2-thiobarbiturique), utilisé comme indicateur de couleur dans l’analyse de l’acide sorbique.
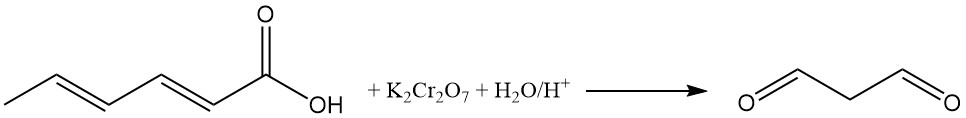
Lorsqu’il est incorporé dans les aliments, la stabilité de l’acide sorbique correspond généralement à celle des composants alimentaires essentiels comme les vitamines, les saveurs et les arômes. Par conséquent, le potentiel d’auto-oxydation théorique de l’acide sorbique pose des défis pratiques minimes en matière de conservation.
3. Production d’acide sorbique
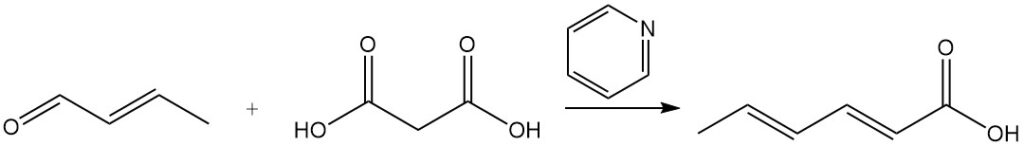
L’acide sorbique a été initialement synthétisé par le procédé Doebner, qui impliquait une réaction de condensation entre le crotonaldéhyde et l’acide malonique dans la pyridine. Bien que de nombreuses autres synthèses utilisent des principes similaires, la plupart sont commercialement peu pratiques en raison de faibles rendements, de matières premières coûteuses ou de coûts de production élevés.
Cela s’applique également à un procédé Union Carbide des années 1950-1960 qui oxydait le 2,4-hexadiénoïque en acide sorbique avec des catalyseurs. Le procédé a été abandonné en raison de la formation d’acides hexadiénoïques isomères jusqu’à 20 %, qui sont moins stables que l’acide sorbique et nécessitent une purification complexe. Les micro-organismes peuvent également oxyder le 2,4-hexadiénoïque en acide sorbique.
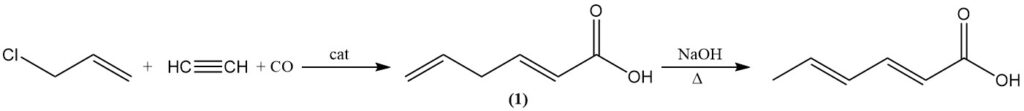
L’acide sorbique peut également être produit en isomérisant l’acide 2,5-hexadiénoïque (1) par ébullition avec une solution alcaline aqueuse. L’acide 2,5-hexadiénoïque est formé par la réaction du chlorure d’allyle avec de l’acétylène, du monoxyde de carbone et de l’eau à l’aide d’un catalyseur au tétracarbonylnickel.
Le clivage acide de la 5-vinyl-γ-butyrolactone, obtenue à partir de 1,3-butadiène et d’acide acétique avec des catalyseurs redox, n’a pas d’importance industrielle. L’addition de dioxyde de carbone au 1,3-pentadiène en présence de complexes de nickel est une autre synthèse possible.
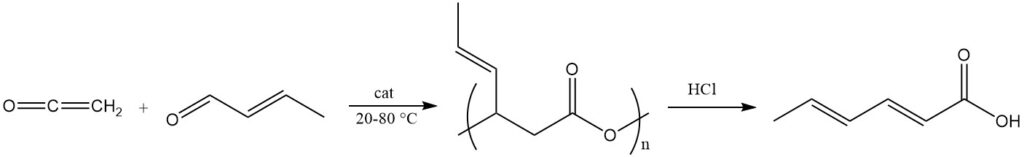
Un procédé courant utilise du cétène et du crotonaldéhyde en présence de sels de métaux de transition divalents comme catalyseurs à une température de 20 à 80 °C pour produire un ester polymère de l’acide 3-hydroxy-4-hexénoïque avec une masse moléculaire approximative de 2000.
Ce polyester est clivé pour produire de l’acide sorbique en utilisant un traitement basique ou acide (par exemple, l’acide chlorhydrique) ou des catalyseurs à complexe métallique. Ce polyester est également utilisé comme précurseur pour la synthèse d’esters de sorbate par des réactions avec des alcools en présence de catalyseurs d’estérification acides.
L’acide sorbique brut est purifié par recristallisation à partir d’une solution aqueuse, de mélanges eau-alcool ou acétone, ou de solvants organiques non miscibles à l’eau comme l’acétate de méthyle. Le traitement par solvant organique et la distillation à la vapeur ont également été signalés.
4. Utilisations de l’acide sorbique
L’acide sorbique et ses sels (principalement les sorbates de potassium et de calcium) sont principalement utilisés comme conservateurs en raison de leur faible profil de toxicité. Il est actif contre les moisissures et les levures. Les principaux domaines d’application comprennent :
- Aliments : fromages (divers types), produits de boulangerie, produits à base de fruits (pruneaux, pulpes, marmelades, confitures, jus, gelées et bonbons), vin, légumes fermentés, margarine, beurre et saucisses
- Aliments pour animaux
- Tabac
- Cosmétiques
- Produits pharmaceutiques
- Matériaux d’emballage pour aliments, aliments pour animaux, cosmétiques et produits pharmaceutiques
- Autres produits qui entrent en contact avec la peau humaine ou animale
Il convient de noter que si les utilisations potentielles de l’acide sorbique dans les réactions chimiques et les polymérisations ont été explorées dans la littérature sur les brevets, ces applications restent commercialement insignifiantes en raison de son coût relativement élevé.
L’acide sorbique peut également être utilisé comme additif dans la production de caoutchouc à froid et comme intermédiaire dans le processus de fabrication de certains plastifiants et lubrifiants.
5. Toxicologie de l’acide sorbique
L’acide sorbique présente une faible toxicité aiguë, avec une DL50 d’environ 10 g/kg de poids corporel chez le rat. Des études rapportent des valeurs similaires allant de 7,4 à 8,7 g/kg. Bien que l’acide sorbique puisse irriter les muqueuses en raison de sa nature acide, l’irritation cutanée est rare.
Des recherches toxicologiques approfondies ont été menées sur l’acide sorbique en raison de son introduction précoce comme conservateur alimentaire et des exigences de tests obligatoires. Les études aiguës, subaiguës, subchroniques et chroniques démontrent systématiquement un profil de sécurité élevé.
L’acide sorbique a un faible potentiel allergène en raison de sa petite taille moléculaire, empêchant la formation d’anticorps et la liaison covalente aux protéines, qui sont généralement associées à une hypersensibilité immédiate. Les cas de réactions pseudo-allergiques à l’acide sorbique en tant qu’additif alimentaire sont rares.
Des études subchroniques sur des rats montrent une augmentation de la croissance et du poids du foie à des doses élevées d’acide sorbique (10 % dans l’alimentation), ce qui a été interprété comme une hypertrophie due à une charge de travail métabolique accrue plutôt qu’à une toxicité.
Des études d’alimentation à long terme (deux ans) sur des rats et des souris ne démontrent aucun effet cancérigène à de faibles concentrations d’acide sorbique (1,5 à 10 % dans l’alimentation). Des doses plus élevées (10 %) entraînent une réduction de la prise de poids et une hypertrophie de la thyroïde, du foie et des reins.
L’acide sorbique n’est ni tératogène, ni mutagène, ni génotoxique, et il n’est pas cancérigène.
Du point de vue métabolique, l’acide sorbique subit une β-oxydation similaire à d’autres acides gras.
L’acide sorbique et le sorbate de potassium présentent tous deux un faible potentiel allergène et phototoxique. Un seul cas de réaction allergique de type 4 a été signalé malgré une utilisation généralisée depuis plus de 40 ans. Le groupe d’experts du Cosmetic Ingredient Review (CIR) classe les deux substances comme « sûres » pour les cosmétiques.
Le sorbate de sodium, peu utilisé dans les aliments en raison de sa sensibilité à l’oxydation, présente une faible toxicité génétique in vitro, contrairement à l’acide sorbique et au sorbate de potassium.
Références
- Sorbic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_507.pub2
- https://pubmed.ncbi.nlm.nih.gov/2079232/
