Carbazol: Propiedades, Producción y Usos

El carbazol es un hidrocarburo aromático heterocíclico con la fórmula química C12H9N. Fue aislado por primera vez del alquitrán de hulla en 1872 por Graebe y Glaser. Su estructura presenta un dibenzopirrol que consta de un anillo de cinco miembros que contiene nitrógeno fusionado a dos anillos de benceno.
Tabla de contenido
1. Propiedades físicas del carbazol
El carbazol es un sólido cristalino de color blanco a amarillo pálido con un olor distintivo. Sus propiedades físicas clave incluyen:
- Masa molar: 167,21 g/mol
- Punto de fusión: 246 °C
- Punto de ebullición: 354,8 °C a 101,3 kPa
- Densidad: 1,1035 g/cm³ a 18 °C
- Morfología cristalina: placas o tablas; sublimable
- Solubilidad:
- Altamente soluble: acetona, piridina
- Moderadamente soluble: éter dietílico, etanol
- Ligeramente soluble: cloroformo, ácido acético, tetracloruro de carbono y disulfuro de carbono
- Muy soluble: ácido sulfúrico concentrado
- Prácticamente insoluble: agua (≈ 1 mg/L a 25 °C)
- Propiedades termodinámicas:
- Calor de fusión: 176,3 kJ/kg
- Calor de combustión: 3,719 × 10⁴ kJ/kg a 25 °C
2. Reactividad química del carbazol
El carbazol exhibe reactividad diversa debido a su naturaleza aromática y al par solitario en su átomo de nitrógeno. A continuación se muestra un desglose de sus principales reacciones químicas:
1. N-Sustitución y Alquilación
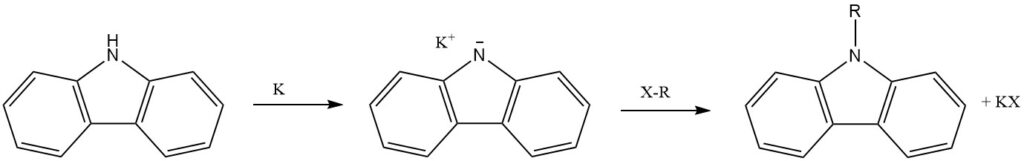
El N-hidrógeno del carbazol, que actúa como amina secundaria, se sustituye fácilmente con metales alcalinos (Li, Na y K). Esto conduce a la introducción de otros grupos funcionales a través de reacciones adicionales.
El átomo de N de carbazol se puede alquilar, introduciendo sustituyentes N-alquilo con propiedades variables.
2. Halogenación, nitración y sulfonación

Las reacciones de sustitución electrófila como la halogenación, nitración y sulfonación se dirigen preferentemente a las posiciones 3 y 6 del anillo de carbazol debido a su mayor densidad electrónica. Se necesitan condiciones duras para una mayor sustitución en las posiciones 1, 8 y otras, lo que lleva a las derivadas 1,3,6 y 1,3,6,8.
También puede sufrir reacciones de alquilación y acilación en el anillo aromático.
3. Hidrogenación
El carbazol se hidrogena fácilmente, produciendo derivados parcial o totalmente saturados. Dependiendo de las condiciones de reacción se puede formar 1,2,3,4-tetrahidro-, hexahidro- o incluso dodecahidrocarbazol.
4. Oxidación
La oxidación con agentes oxidantes fuertes como cromatos o permanganatos escinde el anillo aromático, formando diferentes productos de dicarbazilo según el sitio de escisión. El 3,3′-dicarbazilo se forma por oxidación con cromato, mientras que el 9,9′-dicarbazilo se obtiene por oxidación con permanganato.
5. Carboxilación

El tratamiento con carbonatos de metales alcalinos y dióxido de carbono puede introducir grupos de ácido carboxílico en el anillo de carbazol. La posición del grupo carboxilo (3- o 1-) depende de la temperatura de reacción.
3. Producción de carbazol
Puntos clave:
- El carbazol está fácilmente disponible en el alquitrán de hulla y se puede separar del antraceno mediante varios métodos.
- Existen rutas sintéticas, pero actualmente son menos competitivas que la extracción de alquitrán de hulla.
- La cristalización moderna en estado fundido a alta temperatura ofrece un enfoque prometedor para la producción sostenible de carbazol
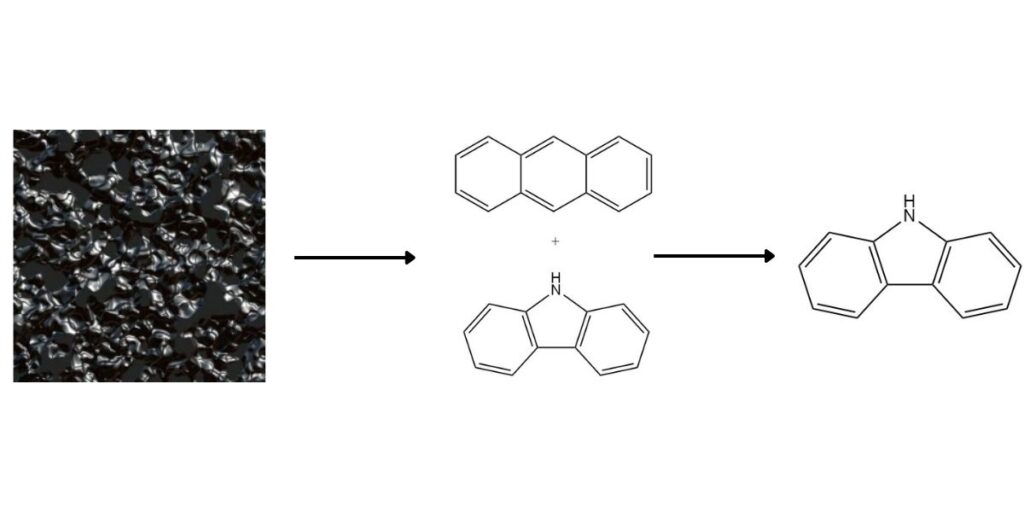
El carbazol, como valioso compuesto aromático heterocíclico, está presente en el alquitrán de hulla a alta temperatura en una concentración promedio del 0,9%. Aunque tradicionalmente se obtiene como coproducto durante la producción de antraceno, varios métodos ofrecen recuperación específica de carbazol.
1. Separación del antraceno:
El punto de ebullición más alto y la solubilidad diferencial del carbazol facilitan su separación del antraceno. Los métodos comunes incluyen:
- Extracción o complejación: utilizando disolventes como piridina, cetonas, benceno/metanol mezclas, o agentes específicos como N-metilpirrolidona, dimetilacetamida, dialquil sulfóxidos o dialquilformamidas.
- Destilación azeotrópica: se emplea etilenglicol para aprovechar la formación de un azeótropo con carbazol, lo que permite la separación mediante destilación fraccionada.
- Hidrogenación selectiva: convertir el antraceno en derivados hidrogenados sin afectar al carbazol.
2. Separación química:
Históricamente, para la separación de carbazol se utilizaban métodos como el hidróxido de potasio o la fusión con ácido sulfúrico concentrado. Sin embargo, su viabilidad económica ha disminuido.
3. Purificación a partir de licores madre de piridina:
Las aguas madre de piridina generadas durante la purificación del antraceno se pueden concentrar y recristalizar en clorobenceno para producir carbazol puro.
4. Rutas sintéticas del carbazol
Existen varios métodos sintéticos para la producción de carbazol, pero su importancia industrial es limitada en comparación con la extracción de alquitrán de hulla:
- Conversión de ciclohexanona azina en octahidrocarbazol seguida de deshidrogenación.
- Ciclación reductora de 2-nitrobifenilo.
- Deshidrogenación y ciclación de varios precursores como difenilamina, o-aminobifenilo o N-ciclohexilidenoanilina.
Un método moderno y eficiente para la recuperación de carbazol a partir de alquitrán de hulla es la cristalización en estado fundido a alta temperatura y sin disolventes. Este proceso ofrece ventajas en términos de impacto ambiental y rentabilidad.
4. Usos del carbazol
A pesar de que se extrae principalmente del alquitrán de hulla (más de 3500 toneladas al año), el carbazol se utiliza en diversas industrias, entre ellas: tintes y pigmentos, pesticidas y polímeros, materiales ópticos y productos de iluminación. -diodos emisores y en construcción y adhesivos.
Tintes y pigmentos:
- Azul Hidrón: la condensación de carbazol con p-nitrosofenol y la posterior sulfuración producen este tinte de azufre azul de importancia comercial.
- Naftol AS y Tintes de antraquinona: El carbazol sirve como precursor de varios colorantes azoicos y antraquinonas utilizados en aplicaciones textiles e industriales.
- Tintes de estirilo: el N-etilcarbazol permite la síntesis de tintes de estirilo vibrantes utilizados en diversos materiales y productos.
- Tintes y pigmentos de dioxazina: El N-etil-3-aminocarbazol juega un papel clave en la creación de estos valiosos colorantes para pigmentos orgánicos y tintes de azina.
- El carbazol contribuye a la producción de tintes reactivos, conocidos por su fuerte unión a las fibras sintéticas.
Pesticidas y Polímeros:
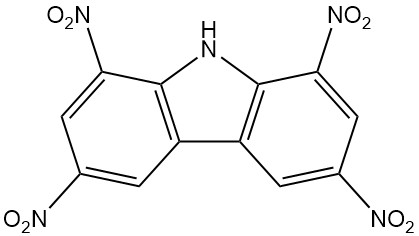
- Nirosan: 1,3,6,8-tetranitrocarbazol, un insecticida eficaz, está disponible comercialmente desde 1939.
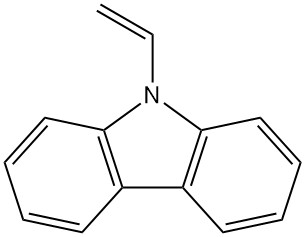
- Poli(vinilcarbazol): la polimerización de N-vinilcarbazol produce este polímero térmica y químicamente estable (Luvican, Polectron) utilizado para aplicaciones eléctricas debido a su baja pérdida dieléctrica y fotoconductividad.
Materiales ópticos y diodos emisores de luz:
- Materiales fotorrefractivos: los polímeros de metacrilato carbazol combinan fotoconductividad y propiedades electroópticas, lo que los hace ideales para almacenamiento de datos de alta densidad, procesamiento de imágenes, e informática.
- Emisores tripletes: los compuestos de carbazol se utilizan como materiales anfitriones para emisores tripletes en diodos emisores de luz orgánicos (OLED), lo que mejora su eficiencia y brillo.
Construcción y Adhesivos:
- Resinas Novolak: el carbazol reacciona con fenoles y formaldehído para formar estos polímeros resistentes al calor, valiosos para adhesivos y revestimientos.
- Plastificantes para hormigón: La cocondensación de carbazol con fenoles y formaldehído, seguida de sulfonación, produce plastificantes eficaces para el hormigón.
Polímeros de alto rendimiento:
- Poliamidas: La condensación térmica de 3,6-diaminocarbazol con ácidos dicarboxílicos produce poliamidas elásticas y térmicamente estables con diversas aplicaciones.
5. Derivados del carbazol

| Derivado | Número CAS | Fórmula | Masa molar (g/mol) | Punto de fusión (°C) | Síntesis |
|---|---|---|---|---|---|
| N-etilcarbazol | 86-28-2 | C14H13N | 195,27 | 68 | Etilación de carbazol con sulfato de dietilo |
| 1,3,6,8-Tetranitrocarbazol | 4543-33-3 | C12H5O8N5 | 347,20 | 312 | Nitración de carbazol con ácido nítrico y sulfúrico |
| N-Vinilcarbazol | 1484-13-5 | C14H11N | 193,25 | 65 | De carbazol-potasio con óxido de etileno o cloruro de vinilo, o de carbazol y acetileno |
6. Toxicología del carbazol
El carbazol presenta una toxicidad oral aguda baja, con valores de LD50 superiores a 5000 mg/kg en ratas. Sin embargo, la administración intraperitoneal en ratones revela una LD50 significativamente menor de 200 mg/kg, lo que sugiere toxicidad dependiente de la ruta.
La exposición ocupacional al carbazol se ha asociado con foliculitis y comedones, aunque los estudios en animales demuestran un potencial mínimo de irritación de la piel y los ojos, incluso bajo fotoactivación.
El carbazol sufre glucuronidación y posterior excreción urinaria en ratas y conejos.
La alimentación con altas dosis de carbazol (270-1050 mg/kg pc/día) durante 96 semanas indujo carcinomas de hígado y estómago en ratones B6C3F1, pero no se observó actividad tumorigénica en ratones recién nacidos después de las inyecciones intraperitoneales.
Según evidencia limitada, la Agencia Internacional para la Investigación del Cáncer (IARC) clasifica el carbazol en el Grupo 3 (no clasificable en cuanto a carcinogenicidad en humanos). No tuvo actividad mutagénica en varios ensayos bacterianos.
El 9-etilcarbazol, un derivado, mostró un efecto mutagénico débil en una cepa bacteriana pero fue inactivo en otra, lo que sugiere un potencial mutagénico limitado.
La aplicación dérmica de carbazol en dosis de hasta 250 mg/kg de peso corporal/día durante el embarazo no indujo anomalías en el desarrollo fetal de ratas.
Referencias
- Carbazole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a05_059.pub2
- Carbazole; – https://www.sigmaaldrich.com/US/en/product/sigma/c5132
- https://en.wikipedia.org/wiki/Carbazole
