Etanol: propiedades, reacciones, producción y usos
¿Qué es el etanol?
El etanol, también conocido como alcohol etílico, es uno de los alcoholes más importantes, con la fórmula química CH3CH2OH. Es un líquido incoloro, volátil con un olor característico y se utiliza ampliamente en una amplia gama de aplicaciones. Otros nombres del etanol incluyen aguardiente de alcohol, aguardiente de vino, alcohol de grano, alcohol absoluto e hidrato de etilo.
El término «alcohol» tiene su origen en las palabras árabes «al» y «kohl», que hacen referencia a un polvo de antimonio finamente molido que se utiliza con fines cosméticos. Con el tiempo, el significado evolucionó para denotar un alto grado de finura o pureza, y finalmente se convirtió en específico para el etanol, «aguardiente de vino rectificado al más alto grado».
El alcohol etílico es un componente bien conocido de las bebidas alcohólicas, que se producen a través de la fermentación de carbohidratos fermentables. El caldo de fermentación puede consumirse como bebida, como en el caso de la cerveza o el vino, o el alcohol puede concentrarse para producir bebidas espirituosas con mayor contenido de alcohol.
La cerveza normalmente tiene entre un 4 y un 6 % en volumen de etanol, el vino contiene entre un 12 y un 14 % y las bebidas espirituosas pueden tener entre un 30 y un 50 % en volumen. Otras bebidas alcohólicas tienen diferentes cantidades de etanol.
Para usos industriales y comerciales distintos de las bebidas alcohólicas, el etanol se desnaturaliza añadiendo sustancias como metanol, piridina, formaldehído o sublimado. El etanol desnaturalizado se utiliza como disolvente, materia prima para la fabricación de productos químicos y combustible.
La historia del etanol se remonta a la antigüedad. La cerveza fermentada se consumía en Babilonia, mientras que la producción de vino se remonta a alrededor del año 3000 a. C. en el antiguo Egipto, donde lo preparaban y consumían los faraones.
El proceso de destilación probablemente se originó entre los siglos X y XIV. Durante esta época se reconocieron los efectos «espirituales» del etanol, lo que dio lugar al término «spiritus» para las bebidas alcohólicas. Los primeros destilados de vino se utilizaban principalmente con fines medicinales.
Hasta el siglo XVII, la fermentación alcohólica se consideraba un proceso de descomposición. La naturaleza de la fermentación se aclaró inicialmente en el siglo XIX con el descubrimiento del microscopio, que reveló que las células de levadura eran organismos vivos. Sin embargo, se necesitaron aproximadamente 150 años para reconocer el papel de estos organismos en el proceso de fermentación.
Tabla de contenido
1. Propiedades físicas del etanol
El etanol puro (alcohol absoluto) es un líquido volátil, inflamable, transparente e incoloro con un olor agradable. Es miscible con agua, éter, acetona, benceno y otros disolventes orgánicos. El etanol anhidro es higroscópico.
El etanol forma una mezcla azeotrópica con el agua, que contiene 95,57 % en peso de etanol y 4,43 % en peso de agua. Por lo tanto, la concentración más alta de etanol que se puede obtener mediante la destilación de una mezcla de etanol y agua es del 95,57 % en peso. Para producir etanol absoluto (anhidro), se debe introducir una destilación azeotrópica con la ayuda de un disolvente terciario (por ejemplo, benceno).
Las propiedades físicas importantes del etanol anhidro se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Número CAS | [64-17-5] |
| Fórmula química | C2H5OH |
| Peso molecular | 46,7 g/mol |
| Punto de congelación | -114,1 °C |
| Punto de ebullición | 78,32 °C |
| Temperatura crítica | 243,1 °C |
| Presión crítica | 6383,48 kPa |
| Volumen crítico | 0,167 L/mol |
| Densidad | 0,7893 g/mL |
| Índice de refracción | 1,36143 |
| Tensión superficial (a 25 °C) | 23,1 mN/m |
| Viscosidad (a 20 °C) | 1,17 mPa·s |
| Solubilidad en agua (a 20 °C) | Miscible |
| Calor de vaporización (a punto de ebullición normal) | 839,31 J/g |
| Calor de combustión (a 25 °C) | 29676,69 J/g |
| Calor de fusión | 104,6 J/g |
| Límites de inflamabilidad en Aire | Inferior: 4,3 % vol. Superior: 19,0 % vol. |
| Temperatura de autoignición | 423 °C |
| Punto de inflamación | 14 °C (vaso cerrado) |
| Calor específico (a 20 °C) | 2,42 J/(g·°C) |
| Conductividad térmica (a 20 °C) | 0,170 W/(m·K) |
| Momento dipolar (líquido a 25 °C) | 5,67 × 10-30 |
| Susceptibilidad magnética (a 20 °C) | 0,734 × 10-6 |
| Constante dieléctrica (a 20 °C) | 25,7 |
2. Reacciones químicas del etanol
La reactividad química del etanol está influenciada principalmente por su grupo hidroxilo (-OH), que participa en numerosas reacciones de importancia industrial, como la deshidratación, la halogenación, la formación de ésteres y la oxidación.
El átomo de hidrógeno del grupo hidroxilo se puede reemplazar por un metal activo, como sodio, potasio o calcio, para formar etóxidos metálicos (etilatos) con la evolución de gas hidrógeno.
CH3CH2OH + M → CH3CH2OM + 1/2 H2
El etóxido de sodio, un etóxido metálico de uso común, se puede preparar mediante la reacción de alcohol etílico absoluto con sodio o mediante el reflujo de alcohol etílico absoluto con hidróxido de sodio anhidro. En el ámbito comercial, el agua se elimina de la mezcla de reacción mediante destilación azeotrópica con benceno.
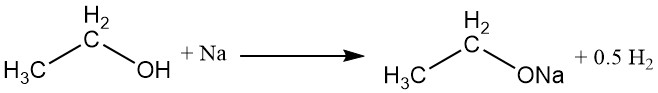
El etóxido de sodio se hidroliza fácilmente para producir alcohol etílico, iones de sodio e iones de hidróxido.
El etóxido de sodio se utiliza como agente de condensación y reducción en la síntesis orgánica. Reacciona con el monocloruro de azufre para producir tiosulfito de dietilo. Además, el etóxido de sodio es un reactivo para la producción comercial de barbitúricos, ortoformiato de etilo y otros productos químicos.
El aluminio y el magnesio también pueden reaccionar con el etanol para formar etóxidos, pero esta reacción requiere catálisis mediante la amalgama del metal.
Las limaduras de aluminio bien limpias reaccionan con el etanol a temperatura ambiente en presencia de cloruro de mercurio. Esta reacción se puede llevar a cabo en un autoclave a temperaturas elevadas sin un catalizador o con la adición de etóxido de sodio.
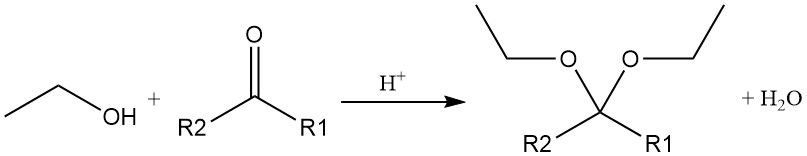
El grupo hidroxilo del etanol también puede participar en otras reacciones, como la apertura del anillo de epóxidos para formar éteres hidroxi y la adición al acetileno para formar éter etilvinílico. Estas reacciones son catalizadas tanto por condiciones ácidas como básicas.
La adición de etanol al acetileno o al éter vinílico catalizada por ácido produce acetales, que también se producen por la reacción catalizada por ácido del alcohol etílico con un aldehído o una cetona.
El grupo hidroxilo puede ser reemplazado por halógenos de haluros de ácidos inorgánicos o haluros de fósforo, lo que conduce a la formación de ésteres etílicos del ácido y un haluro de etilo. El tricloruro de fósforo y el cloruro de tionilo se utilizan comúnmente para producir cloruro de etilo, con fosfito de trietilo y sulfito de dietilo como subproductos.
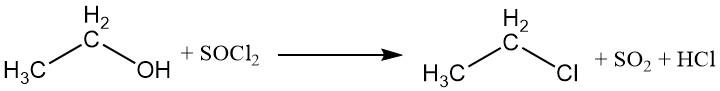
Los ácidos halogenados también pueden reaccionar con el etanol para producir haluros de alquilo. La reactividad de los ácidos halogenados varía, siendo el ácido yodhídrico el más reactivo. El cloruro de etilo se puede preparar mediante la reacción entre el etanol y el cloruro de hidrógeno.
CH3CH2OH + HX → CH3CH2X + H2O
La reacción del etanol con bromuro de hidrógeno produce bromuro de etilo, que es un precursor del reactivo de Grignard etílico y de varias aminas etílicos.
2.1. Esterificación
El etanol reacciona con ácidos inorgánicos y orgánicos, anhídridos de ácido y haluros de ácido para producir ésteres. Si un ácido inorgánico que contiene oxígeno, como el ácido sulfúrico o el ácido nítrico, se hace reaccionar con alcohol etílico, el éster resultante contiene un enlace carbono-oxígeno que puede hidrolizarse.
Los ésteres orgánicos se forman mediante una reacción de deshidratación entre el etanol y un ácido orgánico. Esta reacción es reversible y alcanza el equilibrio lentamente. Los catalizadores ácidos como el ácido sulfúrico, el ácido clorhídrico, el trifluoruro de boro y el ácido p-toluenosulfónico se emplean comúnmente para acelerar el proceso de esterificación.
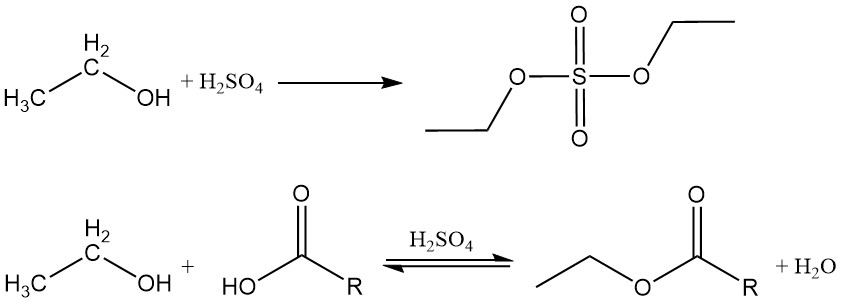
El etanol también reacciona con anhídridos de ácido o haluros de ácido para formar los ésteres correspondientes.
Se cree que la conversión directa de etanol en acetato de etilo se produce a través del acetaldehído y su posterior condensación (reacción de Tishchenko). Se puede lograr un rendimiento de acetato de etilo de aproximadamente el 24 % utilizando un catalizador de óxido de cobre que contenga entre un 0,1 y un 0,2 % de torio a 350 °C.
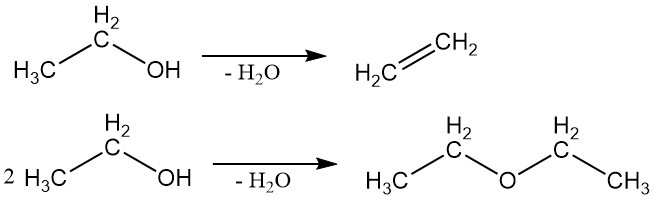
2.2. Deshidratación
El etanol puede sufrir deshidratación para producir etileno o éter etílico. El producto específico formado depende de las condiciones de reacción.
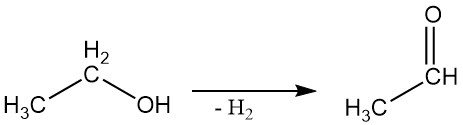
2.3. Deshidrogenación
El alcohol etílico se puede deshidrogenar para obtener acetaldehído en una reacción en fase de vapor utilizando catalizadores adecuados.
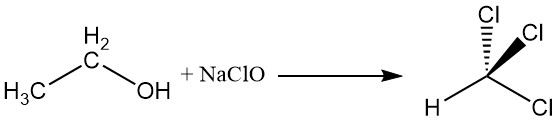
2.4. Reacción del haloformo
El alcohol etílico reacciona con el hipoclorito de sodio para producir cloroformo, una reacción conocida como reacción del haloformo.
3. Producción industrial de etanol
El etanol se produce mediante procesos tanto sintéticos como de fermentación. Una de las primeras rutas sintéticas implicaba la reacción del etileno con ácido sulfúrico, un proceso descubierto hace más de un siglo.
Sin embargo, la producción a escala industrial de etanol sintético no se volvió económicamente viable hasta la década de 1930, cuando la Carbide and Chemical Corporation desarrolló el proceso de hidratación indirecta.
Este proceso, que implicaba la absorción de etileno en ácido sulfúrico seguida de hidrólisis, ha sido reemplazado en gran medida por la hidratación catalítica directa de etileno, introducida por Shell Chemical Company en 1948.
En las últimas décadas, han surgido métodos alternativos para la síntesis de etanol, utilizando materiales de partida a base de carbón, como metanol o gas de síntesis. Estos procesos incluyen la homologación, la carbonilación y la conversión directa del gas de síntesis en etanol.
Sin embargo, la fermentación de azúcar, almidón o celulosa sigue siendo el método predominante para la producción de etanol, y representa hasta el 90% de la producción mundial.
3.1. Producción de etanol mediante hidratación catalítica directa de etileno
La hidratación de etileno a etanol es una reacción reversible. La constante de equilibrio de esta reacción está influenciada por la temperatura y la presión. Las temperaturas más altas favorecen una mayor conversión de etileno, pero también aumentan la velocidad de las reacciones secundarias, como la formación de éter dietílico.
Se han realizado estudios cinéticos en varios catalizadores, incluidos el gel de sílice con ácido fosfórico y el gel de sílice con óxido de tungsteno azul. Estos estudios han proporcionado información sobre la energía de activación y la velocidad de reacción en diferentes condiciones.
Varias variables del proceso, incluidas la presión, la temperatura y la relación molar de agua a etileno, afectan la conversión de etileno. En condiciones típicas del reactor (alimentación de etileno-agua aproximadamente equimolar, 250–300 °C, 5–8 MPa), la conversión de equilibrio de etileno varía de 7 a 22 %.
Además de la reacción de hidratación deseada, pueden ocurrir reacciones secundarias que conducen a la formación de subproductos. A temperaturas más bajas, se puede producir éter dietílico, mientras que a presiones más altas, puede tener lugar la polimerización del etileno a butenos y olefinas superiores.
El mecanismo propuesto para la hidratación del etileno implica cuatro pasos:
- Se añade un protón a la molécula de etileno para formar un complejo π.
- El complejo π se convierte en un carbocatión.
- Se añade una molécula de agua al carbocatión.
- Se elimina un protón del etanol protonado para producir etanol.
Catalizadores
La hidratación del etileno a etanol se cataliza generalmente mediante catalizadores ácidos. El ácido fosfórico soportado en varios materiales, incluida la tierra de diatomeas (kieselguhr, celite), la montmorillonita, la bentonita, el gel de sílice y la opoka, se encuentra entre los catalizadores más utilizados para esta reacción.
Además de los catalizadores basados en ácido fosfórico, se han investigado otros catalizadores, como óxidos ácidos, heteropoliácidos, zeolitas y sales. Estos materiales ofrecen ventajas potenciales en términos de actividad, selectividad y estabilidad.
En condiciones de reacción, el soporte debe ser resistente al ácido fosfórico pero capaz de retenerlo en grandes cantidades; también debe tener una resistencia mecánica adecuada y una vida útil suficientemente larga; y, en última instancia, debe proporcionar un catalizador activo y selectivo para la hidratación.
Para optimizar el rendimiento del catalizador, el soporte se trata previamente con ácidos minerales, como ácido clorhídrico o sulfúrico, para eliminar impurezas como hierro y aluminio, y se impregna con ácido fosfórico entre un 50 y un 77 %.
El tratamiento térmico a temperaturas elevadas (700–1100 °C) se utiliza a menudo para mejorar la unión del ácido fosfórico al soporte. Si bien este tratamiento puede reducir ligeramente la actividad y la selectividad iniciales del catalizador, puede mejorar significativamente su estabilidad y durabilidad a largo plazo.
Proceso de producción
La hidratación catalítica del etileno para obtener etanol implica una serie de pasos, como se ilustra en la Figura 1.
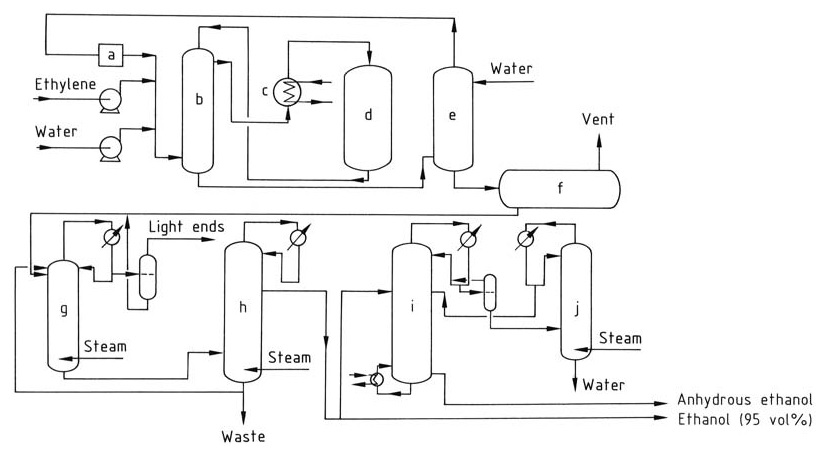
a) Compresor de circulación; b) Intercambiador de calor; c) Sobrecalentador; d) Reactor; e) Lavador; f) Tanque de etanol crudo; g) Columna de destilación extractiva; h) Columna de concentración; i) Deshidratación; j) Columna de concentración
El etileno y el agua desionizada, en una proporción molar que varía de 1:0,3 a 1:0,8, se calientan a 250–300 °C a 6–8 MPa al pasar a través de un intercambiador de calor y un sobrecalentador. La reacción es exotérmica, liberando calor que se puede recuperar y utilizar para precalentar la corriente de alimentación.
La corriente de gas se lava con agua para eliminar cualquier etanol residual. A continuación, el gas purificado se vuelve a comprimir y se recicla de nuevo al reactor para mantener la concentración de etileno deseada.
Los productos de reacción se enfrían y se condensan para separar las fases líquida y gaseosa. El producto de etanol crudo recogido en el sumidero de lavado contiene aproximadamente entre un 10 y un 25 % de etanol en peso y se purifica aún más mediante destilación para obtener un azeótropo de etanol y agua al 95 %.
Para producir etanol anhidro, el etanol al 95 % se puede deshidratar mediante destilación azeotrópica.
Durante la hidratación catalítica del etileno, una parte del catalizador de ácido fosfórico puede ser arrastrada por la corriente de gas. Para evitar la acumulación de ácido en el equipo posterior, se inyecta una solución diluida de hidróxido de sodio para neutralizarlo.
El ácido fosfórico perdido debido al arrastre y la evaporación se repone rociándolo periódicamente sobre el lecho del catalizador para garantizar una concentración constante del catalizador durante todo el proceso de reacción.
El éter dietílico, aproximadamente al 2 %, es un subproducto común de la reacción y se puede recuperar y purificar para su uso por separado o reciclarlo de nuevo al reactor. El acetaldehído, una impureza potencial, se convierte en etanol por hidrogenación para evitar la formación de compuestos indeseables como el crotonaldehido.
El equipo de proceso consta de reactores, intercambiadores de calor, columnas de destilación y tuberías asociadas. Los reactores suelen estar hechos de acero con un revestimiento de cobre o carbono para protegerlos contra la corrosión por ácido fosfórico. Los intercambiadores de calor y las tuberías expuestas al ácido fosfórico también están construidas de cobre o aleaciones de cobre.
El proceso genera un mínimo de residuos. El etileno ventilado, que representa menos del 15% de la alimentación total, se puede devolver a la planta de etileno o incinerar. Las aguas residuales de la destilación tienen un bajo contenido de compuestos orgánicos y fosfato (aproximadamente 0,3 kg de Na2HPO4 por metro cúbico) y se pueden eliminar fácilmente.
3.2. Producción de etanol por hidratación indirecta de etileno
La hidratación indirecta de etileno utilizando ácido sulfúrico implica dos pasos principales: la absorción de etileno y la hidrólisis del sulfato producido.
El etileno reacciona con ácido sulfúrico concentrado para formar sulfato de hidrógeno de etilo y sulfato de dietilo, que luego se hidrolizan con agua para producir etanol y éter dietílico.
Los estudios cinéticos han demostrado que los pasos de absorción e hidrólisis siguen un mecanismo de reacción similar al del proceso de hidratación directa, pero están influenciados por la solubilidad del etileno en ácido sulfúrico.
Los productos finales del proceso de hidratación indirecta son etanol y éter dietílico (5-10%). El rendimiento de éter dietílico se puede controlar ajustando las condiciones de reacción, como la relación de etileno a ácido sulfúrico y las condiciones de hidrólisis.
Los sulfatos de etilo se pueden transesterificar con ácido acético a 104 °C para producir acetato de etilo. Luego, el acetato de etilo se recupera por destilación y se hidroliza a etanol y ácido acético. Este proceso ofrece una ventaja sobre el método de hidrólisis tradicional al evitar la necesidad de reconcentrar el ácido sulfúrico.
Proceso de producción
La Figura 2 muestra el esquema de flujo para la producción de etanol por hidratación indirecta de etileno.
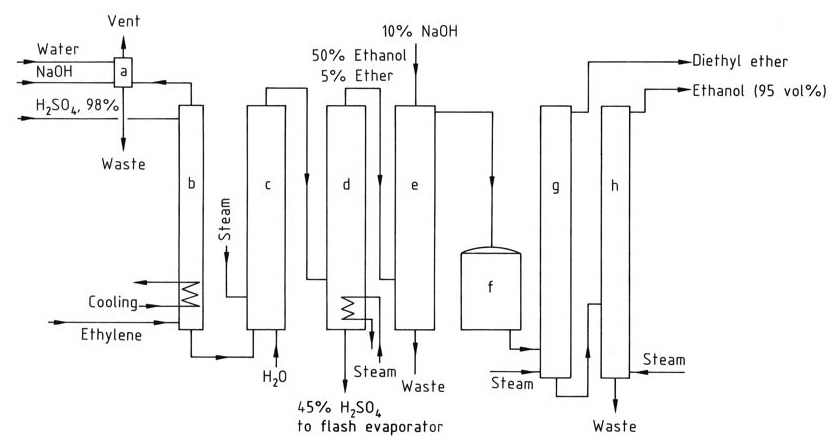
a) Columna de lavado para gas residual; b) Absorbedor; c) Hidrolizador; d) Columna de destilación; e) Columna de lavado para etanol crudo; f) Tanque de producto crudo; g) Columna de destilación de éter dietílico; h) Columna de destilación de etanol
El gas de alimentación para el proceso de hidratación indirecta debe contener un mínimo de 35% de etileno y debe estar libre de homólogos superiores que puedan causar la formación de resina. Se pueden añadir gases inertes como el metano y el etano.
La absorción de etileno aumenta con la presión, que generalmente está entre 1 y 3,5 MPa. Cada mol de ácido sulfúrico puede absorber hasta 1,4 moles de etileno. La absorción se lleva a cabo en torres de lavado a 65–85 °C, y se deben evitar temperaturas superiores a 90 °C para prevenir la formación de resina.
El etileno absorbido reacciona con el ácido sulfúrico para formar sulfatos de etilo después de agitarlo durante varias horas. La hidrólisis de estos sulfatos se lleva a cabo en dos etapas: una hidrólisis a baja temperatura (70 °C) para convertir el sulfato de dietilo y una hidrólisis posterior a alta temperatura (100 °C) durante aproximadamente 1 hora para completar la reacción.
El ácido sulfúrico se diluye al 40-55 % en peso, y el etanol y el éter dietílico se recuperan de la mezcla de reacción a través de una columna de destilación. Luego, la mezcla de productos se neutraliza con hidróxido de sodio y el éter dietílico se elimina en una columna de destilación separada.
El etanol se purifica aún más mediante destilación para obtener un azeótropo de etanol y agua al 95 %.
La reconcentración del ácido sulfúrico diluido es un paso costoso del proceso de hidratación indirecta, que se caracteriza por un alto consumo de energía, problemas de corrosión y oxidación de compuestos orgánicos (formación de alquitrán).
Para superar estos desafíos, operar a presiones más bajas por debajo de 0,5 MPa y agregar sulfato de plata hasta un 7 % al ácido sulfúrico puede mejorar la eficiencia del proceso y reducir los requisitos de reconcentración.
La elección de los materiales de construcción depende de los pasos específicos del proceso. El acero se utiliza comúnmente para equipos de absorción y destilación. El plomo y los materiales resistentes a los ácidos son adecuados para la hidrólisis, mientras que la siluminio, el tantalio, el hierro fundido y el plomo se utilizan para la reconcentración de ácido sulfúrico.
3.3. Otros métodos
Se han desarrollado otros métodos para sintetizar etanol a partir de metanol y gas de síntesis. Es probable que estos procesos tengan importancia industrial en el futuro porque utilizan materias primas que se obtienen a partir del carbón y no del petróleo.
3.3.1. Homologación del metanol
La homologación, un proceso que extiende la cadena de carbono de un alcohol en un átomo de carbono, se ha explorado como una ruta alternativa para la síntesis de etanol. El metanol puede reaccionar con gas de síntesis (CO + H2) en presencia de un catalizador de carbonilo de cobalto para producir etanol.
Los primeros intentos de homologación del metanol dieron como resultado rendimientos bajos de etanol y mezclas de productos complejas. Sin embargo, los avances en el diseño de catalizadores y las condiciones de reacción han mejorado la selectividad para el etanol.
Los estudios han demostrado que el uso de tetrahidrofurano como disolvente o la adición de yodo o yoduro con fosfinas orgánicas puede mejorar la selectividad del etanol.
3.3.2. Carbonilación de metanol y acetato de metilo
Otro enfoque para producir etanol es la carbonilación de metanol a ácido acético, seguida de hidrogenación. Este método se basa en el proceso Monsanto para la síntesis de ácido acético, que utiliza un catalizador de rodio carbonil-yodo.
Si bien es posible la hidrogenación directa de ácido acético a etanol, requiere equipo de alta presión y puede ser corrosiva. Un método más práctico es la esterificación de ácido acético con etanol para formar acetato de etilo, seguida de hidrogenólisis de acetato de etilo a etanol.
Se han desarrollado varias variaciones del proceso de carbonilación, incluido el uso de acetato de metilo como material de partida. El acetato de metilo se puede carbonilar para formar anhídrido acético, que luego se hace reaccionar con etanol y metanol para producir acetatos de etilo y metilo. El acetato de etilo se puede hidrogenar posteriormente para formar etanol.
3.3.3. Conversión de gas de síntesis en etanol
Síntesis mediante catálisis heterogénea
Los esfuerzos para convertir el gas de síntesis (CO + H2) en etanol se han centrado en modificar los catalizadores existentes que se utilizan para la síntesis de metanol. Los estudios han demostrado que la incorporación de metales alcalinos, cobalto u otros elementos puede mejorar la producción de etanol.
Las instituciones de investigación como el Institut Français du Pétrole han desarrollado catalizadores complejos que contienen múltiples elementos, incluidos cobre, cobalto, cromo, potasio, lantano y otros. Estos catalizadores pueden producir mezclas de alcoholes que contienen una cantidad significativa de etanol, metanol y alcoholes superiores.
Los catalizadores de metales del grupo del platino, como el rodio y el trióxido de lantano, también han demostrado ser prometedores en la conversión de gas de síntesis en etanol. Estos catalizadores pueden lograr altas selectividades de etanol a 200–240 °C y condiciones de presión atmosférica.
Síntesis por catálisis homogénea
Se ha explorado la catálisis homogénea mediante complejos de rutenio para la conversión de gas de síntesis en etanol. Los catalizadores de rutenio, en combinación con compuestos de fósforo orgánico, pueden lograr selectividades de etanol superiores al 50 %.
Se han investigado diversos disolventes y aditivos, como óxido de tripropilfosfina, bromuro de tetrabutilfosfonio y bromuros de alquiltrifenilfosfonio, para optimizar la producción de etanol.
3.4. Producción de etanol por fermentación
La fermentación, un proceso de biosíntesis, se ha empleado durante siglos para producir diversos productos, incluido el etanol. Si bien el maíz ha sido la materia prima principal en las últimas décadas, también se pueden utilizar otros materiales agrícolas, como melaza, granos, caña de azúcar, remolacha, fruta, suero y licor residual de sulfito.
Se están realizando investigaciones para explorar la viabilidad de la fermentación de materiales de desecho como la basura.
La idoneidad de diferentes materias primas para la producción de etanol depende de factores como la disponibilidad, el costo, el contenido de azúcar y el rendimiento de etanol. Algunos productos agrícolas, como las papas, pueden ser económicamente menos atractivos debido al bajo rendimiento de etanol y los altos costos de transporte.
Los materiales fermentables se pueden clasificar en tres tipos:
- Azúcares: es posible la fermentación directa de azúcares obtenidos de la caña de azúcar, la remolacha azucarera, la melaza o las frutas.
- Almidones: los almidones de cereales, patatas o tubérculos requieren hidrólisis para convertirse en azúcares fermentables mediante enzimas de malta o mohos.
- Celulosa: los materiales ricos en celulosa, como la madera, los residuos agrícolas y los licores residuales de sulfito, deben convertirse en azúcares mediante ácidos minerales antes de la fermentación.
La fermentación es la conversión de azúcares en etanol y dióxido de carbono en condiciones anaeróbicas. Aunque varios microorganismos pueden fermentar azúcares, las levaduras, en particular la Saccharomyces cerevisiae, se utilizan comúnmente debido a su alta tolerancia y eficiencia al etanol.
La fermentación de la glucosa se lleva a cabo a través de la vía de la glucólisis, que consiste en una serie de reacciones enzimáticas que descomponen la glucosa en piruvato, produciendo ATP (trifosfato de adenosina) como fuente de energía. En condiciones anaeróbicas, el piruvato se convierte en acetaldehído, que luego es reducido a etanol por la alcohol deshidrogenasa.
Las condiciones óptimas de fermentación varían según la cepa de levadura, la materia prima y las especificaciones del producto deseado. Los factores clave que influyen en la fermentación son:
- Temperatura: la mayoría de las levaduras prefieren un rango de temperatura de 25 a 30 °C para un crecimiento óptimo y la producción de etanol.
- pH: el pH debe mantenerse dentro de un rango específico, normalmente entre 4,5 y 5,5, para garantizar una actividad óptima de la levadura y evitar la contaminación bacteriana.
- Disponibilidad de nutrientes: las levaduras requieren un suministro equilibrado de nutrientes, incluidos nitrógeno, fósforo y micronutrientes, para el crecimiento y una fermentación eficiente.
- Concentración de azúcar: la concentración de azúcar debe mantenerse dentro de un rango adecuado para evitar la inhibición del crecimiento de la levadura y la producción de etanol. Las concentraciones excesivas de azúcar pueden provocar estrés osmótico y reducir la eficiencia de la fermentación.
La fermentación se puede realizar en procesos continuos o por lotes. En la fermentación por lotes, se inocula un volumen definido de medio que contiene azúcar y nutrientes con levadura y se deja fermentar hasta que se alcanza la concentración de etanol deseada.
En la fermentación continua, se introduce un flujo constante de medio en un fermentador mientras se retira continuamente el caldo fermentado, lo que permite una producción de etanol más eficiente y constante.
Pueden surgir varios desafíos durante la fermentación, incluida la contaminación bacteriana o fúngica y la inhibición de la actividad de la levadura por altas concentraciones de etanol, la acumulación de subproductos y la limitación de nutrientes.
4. Usos del etanol
Desde la antigüedad, el etanol se ha utilizado para una amplia gama de aplicaciones. Se utiliza como componente de bebidas alcohólicas, disolvente, materia prima para síntesis química y combustible.
Históricamente, el etanol derivado de la fermentación se ha utilizado principalmente para bebidas y productos químicos especiales, mientras que el etanol sintetizado químicamente se ha utilizado para la industria. Sin embargo, ciertos países, como Brasil e India, utilizan etanol de fermentación para aplicaciones industriales.
Para facilitar el uso de etanol en procesos industriales a un menor costo, muchos países han implementado políticas libres de impuestos para el etanol industrial y desnaturalizado. Estas políticas a menudo incluyen controles financieros, administrativos y químicos para evitar el uso indebido del etanol libre de impuestos para bebidas.
Según estas regulaciones, el etanol industrial se clasifica en cuatro tipos: alcohol completamente desnaturalizado, solventes patentados y solventes industriales especiales, alcohol especialmente desnaturalizado y etanol puro (absoluto).
El etanol se agrega con frecuencia a la gasolina como aditivo de combustible, generalmente en proporciones que varían del 5 % al 85 % de etanol (conocido como E5 a E85) o como extensor de gasolina. Debido a su capacidad para producirse a partir de una serie de recursos, como maíz, caña de azúcar y materiales celulósicos, el etanol se está volviendo cada vez más popular como fuente de combustible.
Además de su uso en bebidas alcohólicas tradicionales, el etanol también se utiliza en la producción de diversos licores aromatizados y como base para muchos cócteles.
El etanol es un disolvente ampliamente utilizado, después del agua, principalmente en la producción de artículos de tocador, cosméticos, detergentes, desinfectantes, productos farmacéuticos, revestimientos de superficies y productos alimenticios y farmacéuticos.
Si bien tanto el etanol sintético como el de fermentación se pueden utilizar como disolventes, el etanol de fermentación es generalmente preferido, especialmente en Europa, para aplicaciones que involucran el consumo humano o el uso corporal.
El etanol es un desinfectante poderoso que se usa comúnmente en hospitales, laboratorios y otros entornos de atención médica para matar bacterias, virus y otros microorganismos dañinos. También se utiliza en la producción de desinfectantes para manos y aerosoles desinfectantes.
El etanol se utiliza como materia prima para la producción de diversos productos químicos, entre ellos el acetaldehído, el butadieno, el éter dietílico, el acetato de etilo, las etilaminas, el etileno, los éteres de glicol y otros productos formados por reacciones con óxido de etileno o epóxidos y vinagre.
Algunos países, como Brasil, han establecido industrias químicas basadas en el etanol para producir productos químicos como el acetaldehído que tradicionalmente se derivan de los productos petroquímicos en países con abundantes recursos de petróleo crudo.
Brasil fue el mayor productor mundial de etanol a partir del azúcar, con más del 95% de la producción total en 1985-1986. La mayor parte del etanol producido en Brasil se utiliza como combustible, mientras que una fracción más pequeña se emplea como materia prima química.
En 1978, la India utilizó más del 50% de su producción total de etanol para la fabricación química de productos como acetaldehído, ácido acético, anhídrido acético, DDT, acetatos orgánicos, acetona, butanol, polietileno, cloruro de polivinilo y estireno.
5. Toxicología del etanol
El etanol presenta toxicidad oral aguda en ratas, con valores de LD50 que oscilan entre 11,5 y 13,7 g/kg. Se han informado valores de LD50 similares de 9,5, 9,6, 9,9 y 6 g/kg en ratones, cobayas, conejos y perros, respectivamente.
El etanol puede causar irritación leve a grave en el ojo del conejo, según la concentración y la cantidad utilizada. Sin embargo, no es significativamente irritante para la piel intacta.
La inhalación de etanol puede producir irritación de las mucosas, excitación, ataxia, somnolencia, narcosis y, en última instancia, la muerte por insuficiencia respiratoria. Las concentraciones letales para ratones, cobayas y ratas oscilan entre 20.000 y 40.000 ppm tras varias horas de exposición. En general, se pueden tolerar concentraciones inferiores a 6.000 ppm sin que se produzcan síntomas de intoxicación.
La administración oral repetida de etanol a ratas jóvenes en una dosis de 10 g/kg/día durante 12 semanas provocó un bajo aumento de peso y una degeneración del hígado graso. En monos alimentados con una dieta que contenía el 40% de las calorías totales en forma de etanol, se observaron alteraciones del metabolismo de los triglicéridos, el colesterol y los fosfolípidos, junto con una degeneración grasa en el hígado y el miocardio.
La administración de etanol a ratas preñadas en niveles de 5 ml/kg aumentó la embrioletalidad y retrasó el desarrollo fetal. Sin embargo, no se indujeron malformaciones importantes en el feto.
Las dosis de etanol de 1 a 1,5 g/kg provocaron mutaciones letales dominantes en ratones machos, pero no en ratones hembras. En la prueba de Ames, el etanol no mostró actividad mutagénica. Sin embargo, se observó un aumento de la rotura de cromátidas en cultivos de fibroblastos humanos, lo que probablemente sea un efecto citotóxico más que un signo de mutagenicidad.
El etanol se metaboliza principalmente en el hígado a través de tres sistemas enzimáticos:
- Alcohol deshidrogenasa
- Catalasa que actúa como peroxidasa y se acopla a un sistema que suministra agua oxigenada
- Un sistema microsomal de oxidación del etanol que requiere NADPH como coenzima
Aproximadamente el 80% del etanol absorbido se metaboliza inicialmente a acetaldehído, seguido de una mayor oxidación a ácido acético. El ácido acético se degrada luego a dióxido de carbono y agua. La oxidación del acetaldehído a ácido acético es generalmente más rápida que la oxidación del etanol a acetaldehído.
La ingesta de etanol en humanos puede producir diversos síntomas según la concentración, como se indica en la Tabla 2. Sin embargo, las respuestas individuales al etanol pueden variar significativamente.
| Síntoma | Concentración de etanol en sangre, % |
|---|---|
| Inicio de incertidumbre | 0,06 - 0,08 |
| Comprensión lenta | 0,10 |
| Estupor | 0,11 - 0,15 |
| Embriaguez | 0,16 |
| Intoxicación grave | 0,2 - 0,4 |
| Muerte | 0,4 - 0,5 |
En las personas que padecen alcoholismo, la degeneración del hígado graso suele atribuirse a un aumento de la síntesis de ácidos grasos a partir del acetato, un mayor transporte de lípidos desde los depósitos de grasa periféricos al hígado y una menor oxidación de los ácidos grasos.
También se ha informado de infiltración grasa del miocardio y leptomeningitis crónica en el alcoholismo crónico, que se asocian a síntomas específicos.
Los límites de exposición al etanol establecidos por la ACGIH, la OSHA y la MAK están fijados en 1000 ppm (1900 mg/m³).
Referencias
- Ethanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a09_587.pub2
- Ethanol; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0520080112150719.a01.pub2
