Reacciones Químicas en Procesos Industriales

Las reacciones químicas son un aspecto fundamental de muchos procesos industriales. Estas reacciones implican la transformación de una o más sustancias en nuevos productos y pueden usarse para producir una amplia variedad de materiales, incluidos combustibles, plásticos, productos farmacéuticos y muchos otros.
Comprender los principios detrás de las reacciones químicas es crucial para los ingenieros y químicos que diseñan y optimizan procesos industriales.
Hay varios tipos de reacciones químicas que ocurren en los procesos industriales, incluida la combustión, reacciones de oxidación-reducción, polimerización, hidrogenación, carbonilación, acilación, alquilación, nitración, deshidrogenación, esterificación y sulfonación.
Tabla de contenido
1. Reacciones de combustión
Las reacciones de combustión se pueden clasificar en dos categorías: combustión completa y combustión incompleta. En la combustión completa, el combustible se quema por completo, produciendo sólo dióxido de carbono y agua como productos finales.
Por el contrario, la combustión incompleta ocurre cuando el combustible no se quema completamente, produciendo una mezcla de monóxido de carbono, hollín y otros contaminantes.

En los procesos industriales, la combustión completa es deseable porque produce la máxima cantidad de energía y la menor cantidad de contaminación. Sin embargo, lograr una combustión completa puede ser un desafío, especialmente cuando se queman combustibles que son difíciles de encender o tienen una baja eficiencia de combustión.
Para optimizar las reacciones de combustión, se deben considerar varios factores, incluida la estequiometría de la reacción, la temperatura de combustión y la mezcla del combustible y el agente oxidante.
La estequiometría de la reacción se refiere a la proporción de reactivos necesarios para lograr una combustión completa. La temperatura de combustión también es crítica porque afecta la velocidad de la reacción y la calidad de los productos finales.
La mezcla del combustible y el agente oxidante también es esencial porque afecta la eficiencia de la reacción y la calidad de los productos finales.
Además de en los procesos industriales, las reacciones de combustión también intervienen en muchos fenómenos naturales, como incendios forestales y erupciones volcánicas. Estas reacciones pueden tener importantes impactos ambientales, como la contaminación del aire y el calentamiento global.
Para reducir el impacto ambiental de las reacciones de combustión, se están realizando muchos esfuerzos para mejorar la eficiencia de la combustión y desarrollar tecnologías más limpias que produzcan menos contaminantes.
2. Reacciones de oxidación-reducción
Las reacciones de oxidación-reducción, también conocidas como reacciones redox, implican la transferencia de electrones entre dos especies. En una reacción de oxidación, una especie pierde electrones, mientras que en una reacción de reducción, una especie gana electrones.

Estas reacciones son esenciales en muchos procesos industriales, como la producción de metales, la galvanoplastia y la producción de productos químicos y combustibles. Los usos industriales importantes de las reacciones electroquímicas son la producción de hidróxido de sodio mediante electrólisis de NaCl, la producción de otros hidróxidos de metales alcalinos y la producción de lejía.
Las reacciones redox se pueden clasificar como espontáneas o no espontáneas, dependiendo de si ocurren de forma natural o requieren un aporte de energía para desarrollarse. Las reacciones redox espontáneas son aquellas que ocurren sin ningún aporte de energía externa y, a menudo, se utilizan en baterías y otros dispositivos de almacenamiento de energía.
Por otro lado, las reacciones redox no espontáneas requieren una fuente externa de energía para realizarse y se utilizan en la electrólisis y otros procesos químicos.
Un ejemplo común de reacción redox es la oxidación del hierro, que se mencionó anteriormente. En esta reacción, el hierro reacciona con el oxígeno para producir óxido de hierro, que es la conocida sustancia de color marrón rojizo que llamamos óxido.
La oxidación es un ejemplo de reacción de oxidación, donde el hierro pierde electrones en oxígeno. Esta reacción es importante porque es la causa principal de la corrosión de los metales, cuya reparación o reemplazo puede resultar costosa.
Otro ejemplo de reacción redox es la producción de cloro gaseoso, que se utiliza en la producción de plásticos y otros materiales. El cloro gaseoso se produce mediante la electrólisis del agua salada, que es una reacción redox no espontánea que requiere una fuente externa de energía para continuar.
En esta reacción, los iones cloruro del agua salada se oxidan para producir cloro gaseoso e hidrógeno gaseoso. El cloro gaseoso es un potente agente oxidante y se utiliza en muchos procesos industriales, incluida la producción de pesticidas, productos farmacéuticos y plásticos.
3. Reacciones de polimerización
Las reacciones de polimerización son un tipo de reacción química en la que las moléculas de monómero se unen químicamente para formar una cadena de polímero. El polímero resultante puede tener una amplia gama de propiedades y aplicaciones, desde plásticos y fibras sintéticas hasta adhesivos y revestimientos.

Hay dos tipos principales de reacciones de polimerización: polimerización por adición y polimerización por condensación. Además de la polimerización, los monómeros con un doble enlace reaccionan entre sí para formar una cadena polimérica.
La reacción normalmente se inicia mediante un catalizador o calor, y el polímero resultante es una cadena larga con unidades repetidas del monómero original. La polimerización por condensación, por otro lado, implica la reacción de dos monómeros diferentes con un grupo funcional que reacciona para formar un enlace covalente. En este tipo de reacción, normalmente se produce como subproducto una molécula pequeña, como agua.
Las reacciones de polimerización se utilizan en una amplia gama de aplicaciones industriales, desde la producción de plásticos y fibras sintéticas hasta el desarrollo de nuevos materiales para implantes médicos y administración de fármacos.
Un ejemplo de reacción de polimerización es la producción de polietileno, que es el plástico más utilizado en el mundo. El polietileno se produce mediante la polimerización por adición de monómeros de etileno, lo que da como resultado un polímero de cadena larga que puede usarse en una amplia gama de aplicaciones, desde embalajes hasta materiales de construcción.
Otro ejemplo de reacción de polimerización es la producción de nailon, que es una fibra sintética utilizada en textiles y otras aplicaciones. El nailon se produce mediante la polimerización por condensación de dos monómeros, hexametilendiamina y ácido adípico, que reaccionan para formar una cadena polimérica. El nailon es conocido por su resistencia y durabilidad y se utiliza en una amplia gama de aplicaciones, desde ropa hasta piezas de automóviles.
4. Reacciones de oxidación
Una reacción de oxidación es aquella en la que una molécula pierde electrones. Esto suele ir de la mano de la ganancia de átomos de oxígeno, pero no siempre. Aquí hay un desglose de los aspectos clave:
- Transferencia de electrones: El principio central de la oxidación es la pérdida de electrones de una molécula. Piense en ello como si se eliminaran cargas negativas, lo que haría que la molécula tuviera una carga más «positiva».
- Conexión de oxígeno: aunque a menudo se asocia con la obtención de átomos de oxígeno, una reacción de oxidación no la requiere estrictamente. Sin embargo, el oxígeno es un oxidante común debido a su fuerte electronegatividad, lo que significa que tiene una alta afinidad por atraer electrones.
Diferentes oxidantes utilizados en la industria química, como el oxígeno molecular (O2), el peróxido de hidrógeno (H2O2) y el cloro (Cl2), aceptan electrones de la molécula objetivo. La elección del oxidante depende de factores como el costo, la selectividad y las condiciones de reacción.
Los catalizadores industriales aceleran la reacción sin consumirse ellos mismos. Con frecuencia se utilizan metales de transición como cobre, manganeso y vanadio. Pueden mejorar la selectividad, reducir el consumo de energía y mejorar la eficiencia del proceso.
Las reacciones de oxidación se utilizan en diferentes industrias:
1. Producción de productos químicos a granel:
- El ácido acrílico es importante para las fibras acrílicas y las pinturas. y adhesivos. Se produce por oxidación de propileno con aire sobre catalizadores de óxido metálico.
- El acido tereftálico es el componente básico de los plásticos PET; se fabrica mediante oxidación en fase líquida de p-xileno utilizando aire u oxígeno.
- El ácido nítrico se utiliza en fertilizantes, explosivos y producción de nailon. Se sintetiza mediante el proceso de Ostwald, que implica la oxidación de amoníaco con aire sobre catalizadores de platino y rodio.
2. Química fina y farmacéutica:
- Oxidaciones selectivas: alterar con precisión grupos funcionales específicos en moléculas complejas es crucial para sintetizar productos farmacéuticos. Las enzimas o los catalizadores de metales de transición permiten oxidaciones específicas con reacciones secundarias mínimas.
- Hidroxilaciones: la introducción de grupos hidroxilo es vital para muchos productos farmacéuticos. Métodos como la dihidroxilación asimétrica de Sharpless utilizan catalizadores quirales para un alto estereocontrol.
3. Remediación ambiental:
- Tratamiento de aguas residuales: la oxidación con ozono o peróxidos desinfecta eficazmente el agua y degrada los contaminantes orgánicos.
- Desulfuración de gases de combustión: la eliminación de óxidos de azufre de las emisiones de las centrales eléctricas implica una limpieza húmeda con oxidantes como el hidróxido de calcio.
5. Reacción de hidrogenación
Una reacción de hidrogenación es un tipo específico de reacción de reducción en la que una molécula gana átomos de hidrógeno. Esto ocurre a menudo en presencia de un catalizador y da como resultado la saturación de enlaces insaturados, típicamente enlaces dobles o triples, en la molécula que reacciona.
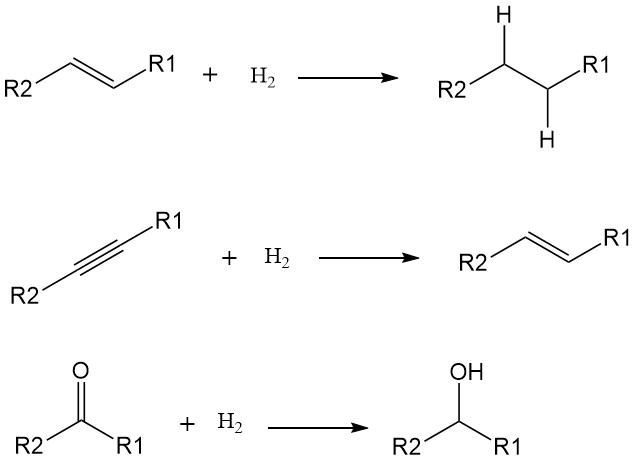
La adición de átomos de hidrógeno (H) a una molécula aumenta su saturación y reduce su reactividad. Si bien algunas hidrogenaciones pueden ocurrir a altas temperaturas sin catalizadores, su uso reduce significativamente la energía de activación y acelera la reacción en condiciones más suaves. Los metales de transición como el níquel, el paladio y el platino son catalizadores comunes para la hidrogenación.
Las hidrogenaciones suelen apuntar a enlaces dobles y triples, convirtiéndolos en enlaces simples. Ejemplos incluyen:
- Alquenos a alcanos: Transformación de hidrocarburos insaturados como el etileno (C2H4) en hidrocarburos saturados como el etano (C2H6).
- Alquinos a alquenos: conversión de hidrocarburos con triple enlace como acetileno (C2H2) en alquenos con doble enlace como el etileno.
- Grupos carbonilo a alcoholes: cetonas y aldehídos reductores con grupos carbonilo (C=O) a alcoholes con grupos hidroxilo (OH).
Las reacciones de hidrogenación se utilizan en diversas industrias, entre ellas:
- Procesamiento de aceites vegetales: endurecimiento de aceites líquidos mediante la conversión de grasas insaturadas en grasas saturadas para la producción de margarina.
- Refinado de combustible: desulfurización y mejora de la calidad de los combustibles gasolina y diésel.
- Producción farmacéutica: sintetizar diversos productos farmacéuticos y productos químicos finos.
La hidrogenación también se utiliza en:
- Industria de alimentos y bebidas: procesamiento de grasas y aceites para productos alimenticios.
- Polimerización: creación de polímeros con propiedades específicas.
- Pilas de combustible de hidrógeno: que convierten hidrógeno y oxígeno en electricidad.
6. Reacción de carbonilación
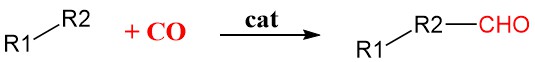
La carbonilación es un método general en síntesis orgánica que agrega monóxido de carbono (CO) a moléculas orgánicas utilizando catalizadores de metales de transición como rodio, iridio, paladio o níquel. Estos catalizadores unen y activan la molécula de CO, haciéndola más reactiva y permitiendo su incorporación al sustrato orgánico.
Es una reacción altamente selectiva, lo que significa que puede agregar con precisión la molécula de CO a la posición deseada en la molécula con reacciones secundarias mínimas.
Esto lo hace valioso para producir una amplia gama de sustancias químicas importantes, que incluyen:
- Ácido acético: más del 70 % del ácido acético sintético del mundo se produce mediante carbonilación de metanol catalizada por rodio o iridio.
- Derivados de aminoácidos: la amidocarbonilación es un área de interés creciente para crear derivados de aminoácidos valiosos utilizados en la industria farmacéutica y otras industrias.
- Intermedios farmacéuticos: la carbonilación de haluros aromáticos se está convirtiendo en un procedimiento estándar para crear importantes componentes básicos para fármacos y otras moléculas bioactivas.
7. Reacción de acilación
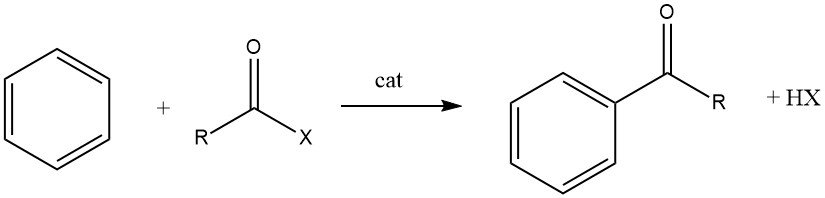
La acilación de Friedel-Crafts implica la producción de una cetona aromática mediante la reacción entre un compuesto aromático y un agente acilante, que podría ser un haluro de acilo, un anhídrido de ácido, un ácido o un éster. Esta reacción tiene lugar en presencia de un catalizador ácido.
La acilación de sustratos aromáticos tiene una importancia industrial significativa, ya que se utiliza para la síntesis de intermedios aromáticos ampliamente empleados en la fabricación de productos farmacéuticos, insecticidas, plastificantes, tintes, perfumes y otros productos comerciales. Estos compuestos especiales suelen producirse a menor escala en comparación con los productos alquilados.
| Agente acilante | Compuesto aromático | Producto | Uso final |
|---|---|---|---|
| Anhídrido acético | benceno | acetofenona | perfumes, productos farmacéuticos, disolventes, plastificantes |
| Anhídrido acético | tolueno | 4-metilacetofenona | perfumes |
| Anhídrido acético | anisol | 4-metoxiacetofenona | perfumes |
| Anhídrido acético | isobutilbenceno | 4-isobutilactofenona | productos farmacéuticos |
| Cloruro de dicloroacetilo | 1,2-diclorobenceno | α,α,2,4-tetracloroacetofenona | insecticidas |
| Cloruro de clorobutiroilo | fluorobenceno | cloropropil 4-fluorofenilcetona | productos farmacéuticos |
| Tetraclorometano | benceno | benzofenona | productos farmacéuticos, insecticidas, perfumes |
| Cloruro de benzoilo | benceno | benzofenona | |
| Fosgeno | N,N-dimetilanilina | 4,4'-bis-dimetilaminobenzofenona | tintes |
| Anhídrido ftálico | benceno | ácido 2-benzoilbenzoico | antraquinona |
8. Reacción de alquilación
La alquilación de Friedel-Crafts de compuestos aromáticos implica una sustitución electrófila catalizada por ácido, en la que un grupo alquilo reemplaza un hidrógeno aromático. Para este fin se emplea habitualmente una amplia gama de agentes alquilantes, tales como olefinas, haluros de alquilo y alcoholes.
Esta reacción se puede aplicar a varios sustratos aromáticos, incluidos compuestos heteroaromáticos e incluso compuestos como el ferroceno. Estas reacciones suelen ser rápidas y exotérmicas y, a menudo, se llevan a cabo en condiciones suaves en la fase líquida.
Sin embargo, en algunos casos, para ciertos sustratos se utilizan procesos en fase de vapor con condiciones más estrictas. Cuando se utilizan olefinas, haluros de alquilo y alcoholes como agentes alquilantes, las reacciones generales se desarrollan de la siguiente manera:
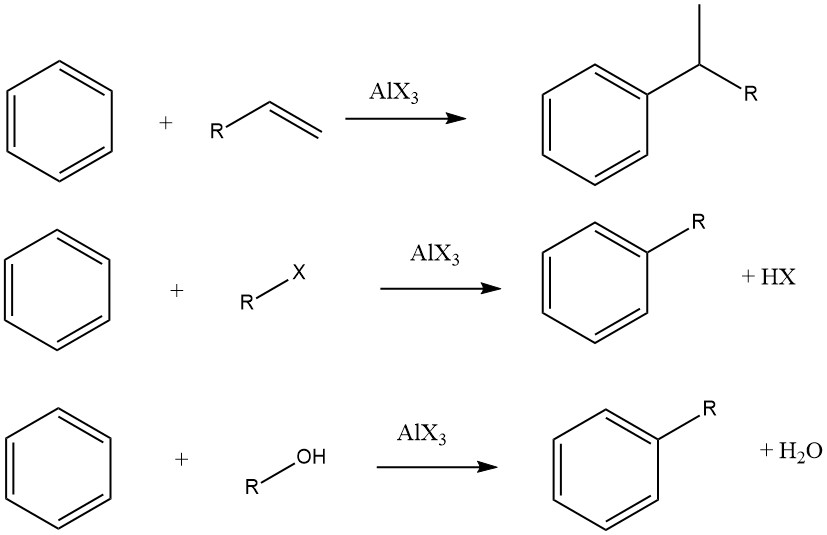
El grado de isomerización del resto alquilo y el cumplimiento de la regla de Markovnikov durante el proceso de adición varían dependiendo de la acidez del catalizador.
Ejemplos de usos de reacciones de alquilación son la producción de etilbenceno, cumeno y alquilbencenos a partir de benceno, la alquilación de tolueno con propeno para producir cimeno; la alquilación de fenoles para producir alquilfenoles; y la alquilación de diversos compuestos aromáticos heterocíclicos, incluidos furanos, tiofenos y N-heterociclos.
9. Reacción de nitración
La reacción de nitración es la introducción irreversible de uno o más grupos nitro (NO2) en un núcleo aromático, reemplazando un átomo de hidrógeno.
La nitración es una reacción de sustitución electrófila, representada por la siguiente ecuación:
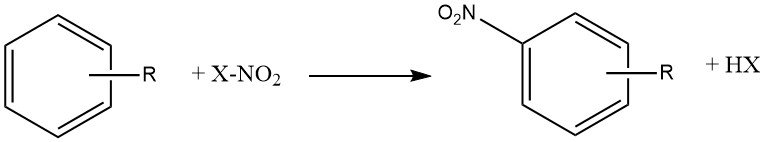
La introducción del grupo nitro desactiva el anillo hacia una mayor sustitución electrófila, lo que hace que la dinitración sea poco común en las condiciones utilizadas para la mononitración.
Generalmente se requieren condiciones más vigorosas para la diniración, lo que requiere exceso, ácido más fuerte y temperatura más alta. Estas condiciones se aplican a menudo a compuestos mononitro aislados, en lugar de llevar a cabo reacciones graduales in situ.
La reacción de nitración es altamente exotérmica, como lo demuestra la mononitración de benceno (ΔH = -117 kJ/mol) y naftaleno (ΔH = -209 kJ/mol). En consecuencia, es uno de los procesos unitarios operados industrialmente más potencialmente peligrosos.
Los productos principales de la nitración son compuestos nitroaromáticos monosustituidos, que se forman cuando se introduce un grupo nitro en el núcleo aromático. Los productos industriales importantes de la nitración pueden incluir:
- Nitrobenceno (C6H5NO2)
- Nitrotoluenos (p. ej., ortonitrotolueno, metanitrotolueno y paranitrotolueno)
- Nitronaftalenos (p. ej., alfa-nitronaftaleno y beta-nitronaftaleno)
- Nitrofenoles (p. ej., ortonitrofenol, metanitrofenol y paranitrofenol)
- Nitroanilinas (p. ej., ortonitroanilina, metanitroanilina y paranitroanilina)
10. Reacción de deshidrogenación
La deshidrogenación, lo opuesto a la hidrogenación, se refiere a una reacción química en la que se elimina hidrógeno (H) de una molécula, generalmente orgánica. Este proceso aparentemente simple juega un papel crucial en varios aspectos de la química, desde reacciones fundamentales de laboratorio hasta procesos industriales a gran escala.
Esta reacción implica romper un enlace C-H, liberar gas H2 y, a menudo, es endotérmica y requiere calor o catalizadores específicos para superar la barrera de energía de activación.
La deshidrogenación es una reacción importante en la industria química utilizada para:
1. Producción de sustancias químicas valiosas: La deshidrogenación es esencial para fabricar numerosos productos, como:
- Estireno: monómero para plásticos de poliestireno, producido a partir de la deshidrogenación de etilbenceno.
- Alquenos: hidrocarburos insaturados utilizados para reacciones posteriores en la producción de polímeros, combustibles y lubricantes.
- Productos químicos finos: los productos farmacéuticos, agroquímicos y otras moléculas especializadas a menudo implican pasos de deshidrogenación.
2. En el sector energético, la deshidrogenación catalítica de hidrocarburos ligeros ofrece potencial para una producción de combustible más limpia en comparación con los métodos tradicionales.
3. Deshidratación: eliminar el agua (H2O) de los alcoholes es un caso especial de deshidrogenación, formando alquenos eliminando una molécula de agua.
11. Reacción de esterificación
La esterificación es la reacción reversible entre ácidos carboxílicos y alcoholes para producir un éster y agua en presencia de un catalizador.
La reacción de esterificación se produce mediante un mecanismo de tres pasos:
- Protonación: un catalizador ácido de Brønsted protona el oxígeno carbonílico del ácido carboxílico, mejorando su carácter electrofílico.
- Ataque nucleófilo: El átomo de oxígeno del alcohol, actuando como nucleófilo, ataca el carbono carbonilo electrófilo, formando un intermedio tetraédrico.
- Desprotonación y pérdida de agua: el intermedio sufre desprotonación, a menudo por el catalizador, seguida de eliminación de agua, lo que conduce a la formación del éster. y agua como subproducto.
La esterificación es una reacción de equilibrio y el principio de Le Chatelier dicta estrategias para mejorar el rendimiento de éster. Emplear el exceso de alcohol, eliminar el agua (por ejemplo, mediante destilación) y optimizar la temperatura pueden cambiar el equilibrio hacia la formación de ésteres.
La reacción de esterificación tiene aplicaciones generalizadas:
- Fragancias y cosméticos: Los ésteres contribuyen significativamente a los agradables aromas de frutas, flores y perfumes.
- Productos farmacéuticos: Numerosos medicamentos, incluidos la aspirina y la penicilina, incorporan funcionalidades de éster.
- Polímeros: Los poliésteres, una clase de polímeros, se forman mediante reacciones de esterificación y encuentran uso en diversos plásticos y fibras sintéticas.
- Biocombustibles: la esterificación se emplea en la producción de biocombustibles como el biodiesel.
- Aditivos alimentarios: los ésteres contribuyen a la textura y el sabor de ciertos productos alimenticios.
12. Reacción de sulfonación
La sulfonación es una reacción orgánica versátil que introduce el grupo ácido sulfónico (-SO2OH) en compuestos aromáticos. Esta transformación tiene una importancia significativa en varios campos, incluida la síntesis de detergentes, colorantes y productos farmacéuticos.
La sulfonación normalmente se produce mediante un mecanismo de sustitución aromática electrófila (EAS). Los pasos clave implican:
- Formación del electrófilo: Trióxido de azufre (SO3) o ácido sulfúrico fumante (H2SO4 + SO3) actúa como agente sulfonante, generando la molécula electrófila SO3.
- Sustitución electrófila aromática: el electrófilo SO3 ataca la nube π rica en electrones del anillo aromático, formando un intermedio complejo σ.
- Protonación y desulfonación: el intermedio pierde un protón, lo que lleva a la formación del producto ácido arilsulfónico.
Sin embargo, la sulfonación suele ser reversible. En condiciones ácidas y temperaturas elevadas, el grupo ácido sulfónico puede sufrir desulfonación, liberando el compuesto aromático original y dióxido de azufre.
La sulfonación encuentra numerosas aplicaciones en la síntesis de diversas moléculas de importancia industrial y biológica:
- Detergentes: el dodecilbencenosulfonato de sodio (SDS), un tensioactivo aniónico ampliamente utilizado, se produce sulfonando el dodecilbenceno.
- Tintes: los colorantes azoicos sulfonados exhiben colores vibrantes y se emplean en diversas aplicaciones textiles.
- Productos farmacéuticos: las sulfonamidas, una clase de antibióticos, dependen de la presencia de un grupo de ácido sulfónico para su actividad antibacteriana.
Más allá de estos ejemplos, la sulfonación desempeña un papel importante en la síntesis de muchos otros compuestos, incluidas resinas de intercambio iónico, aditivos alimentarios y agroquímicos.
Referencias
- Callister, W. D., & Rethwisch, D. G. (2018). Materials Science and Engineering: An Introduction. Wiley.
- Chang, R. (2010). Chemistry (10th ed.). McGraw-Hill.
- Emsley, J. (2011). Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press.
- Green, J. (2018). An Introduction to the Chemical Process Industry. CRC Press.
- Kiehl, J. T. (2013). Industrial Chemical Processes: An Introduction. John Wiley & Sons.
- Meyers, R. A. (Ed.). (2001). Encyclopedia of Analytical Chemistry. Wiley.
- Seader, J. D., & Henley, E. J. (2011). Separation Process Principles. Wiley.
- Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2005). Introduction to Chemical Engineering Thermodynamics (7th ed.). McGraw-Hill.
- Sperling, L. H. (Ed.). (2018). Introduction to Physical Polymer Science (4th ed.). Wiley.
- Turton, R., Bailie, R. C., Whiting, W. B., & Shaeiwitz, J. A. (2018). Analysis, Synthesis, and Design of Chemical Processes (5th ed.). Pearson.
