Résines urée-formaldéhyde
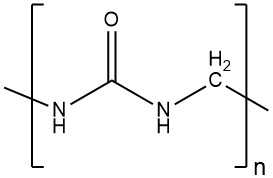
Tous les condensats urée-formaldéhyde contenant l’unité récurrente urée-méthyle, des produits monomoléculaires aux produits de poids moléculaire élevé. Au cours des années 1970, de multiples révélations ont émergé concernant la composition des résines urée-formaldéhyde.
Les progrès des applications industrielles reposent sur des approches empiriques. Grâce à l’application de diverses méthodes analytiques, telles que la spectroscopie RMN 1H et RMN 13C, des analyses élémentaires comprenant C, H, N et O, la quantification des groupes hydroxyméthyle, ainsi que la détermination de la teneur totale en formaldéhyde ont été possibles.
Cependant, la relation entre les caractéristiques techniques des résines aminiques, ou des matériaux dérivés de ces résines, et la répartition des unités structurelles, reste dans la plupart des cas largement difficile.
Table des matières
1. Résines pures urée-formaldéhyde
Le rapport molaire formaldéhyde/urée, la viscosité et le temps de gélification sont des paramètres macroscopiques importants des résines urée-formaldéhyde pures. Les résines avec un rapport molaire de 1 donnent généralement des polyméthylèneurées insolubles qui ne possèdent aucune propriété adhésive.
Cependant, si le rapport molaire est réduit progressivement ou par étapes à partir d’une valeur relativement élevée au cours de la réaction, la résine résultante possède des propriétés adhésives. Ces propriétés s’améliorent à mesure que le rapport molaire augmente, mais le dégagement indésirable de formaldéhyde augmente simultanément.
Les solutions de résines très visqueuses pouvant être obtenues par condensation industrielle prolongée de l’urée et du formaldéhyde sont des produits de faible masse moléculaire. Ils contiennent environ six à huit unités d’urée. Ceci s’applique également aux condensats pulvérulents ou vitreux totalement insolubles.
Lors du stockage, la concentration en groupements méthylène augmente au détriment des groupements hydroxyméthyle. La viscosité augmente également, d’abord lentement et pratiquement linéairement, puis, après un temps critique, de manière plutôt abrupte.
Certains ou tous les groupes hydroxyméthyle peuvent être bloqués par éthérification, et la durée de conservation de la résine aminée est ainsi prolongée. En principe, les mêmes réactions ont lieu lorsque la résine est durcie par l’utilisateur, mais elles sont nettement plus rapides. Cependant, une quantité résiduelle de groupes hydroxyméthyle subsiste après durcissement.
Parce qu’elles sont sensibles à l’hydrolyse, même les résines d’urée durcies sont plus sensibles à l’eau que les résines de mélamine ou de phénol.
Le temps de gélification ou réactivité de la résine est un paramètre important pour l’utilisateur. Ce temps peut être déterminé de manière relativement précise et correspond au temps pendant lequel la résine passe d’un fluide à un solide pratiquement immobile après l’ajout d’une certaine quantité de durcisseur à une température particulière.
La réactivité augmente avec l’augmentation du rapport molaire, de la teneur en groupes hydroxyméthyle et de la teneur en formaldéhyde libre.
2. Condensats mélangés
Les résines aminées industrielles sont des mélanges de divers condensats et co-condensats. Les solutions de résines aminés sont toujours des mélanges polymères avec différents degrés de condensation et répartitions de groupes fonctionnels.
Le terme « condensats mélangés » est appliqué de manière vague aux résines qui se forment lors de la condensation de l’urée et du formaldéhyde lorsque la réaction est effectuée à l’aide de substances qui forment également des résines avec le formaldéhyde. Ces substances comprennent la mélamine, le phénol, les amides d’acides organiques, les sulfamides et les carbamates.
Par exemple, en présence de mélamine ou de phénol, il est possible de préparer des résines d’urée présentant des propriétés de résistance et de gonflement améliorées pour la fabrication de panneaux de particules, tels que des panneaux de particules résistants aux intempéries.
La modification avec de la mélamine donne des colles de résine qui peuvent être utilisées pour produire des panneaux de particules de bonne qualité même lorsque le rapport molaire formaldéhyde/urée est faible.
Les résines mélangées avec d’autres agents formateurs de résine, tels que l’acide acrylique, les acrylates et l’acrylamide, sont également parfois avantageuses. Il s’agit également de mélanges de polymères, de co-condensats, ou de polymères et co-condensats homologues.
3. Condensation de l’urée avec d’autres aldéhydes
L’urée peut être condensée avec d’autres aldéhydes en plus du formaldéhyde. Par exemple, il peut être condensé avec de l’isobutyraldéhyde, de l’acétaldéhyde ou du crotonaldéhyde pour produire des engrais azotés peu solubles. Ces engrais sont également appelés engrais à libération contrôlée car ils libèrent de l’azote lentement au fil du temps.
L’urée peut également être condensée avec du glyoxal pour produire des produits pouvant être utilisés comme auxiliaires textiles. Les auxiliaires textiles sont des substances utilisées pour améliorer les propriétés des textiles, telles que leur résistance, leur couleur ou leur éclat.
Les produits obtenus par condensation ultérieure de résines urée-formaldéhyde avec du glyoxal sont également utilisés pour le finissage textile. Le finissage textile est le processus d’application de produits chimiques sur les textiles pour améliorer leurs propriétés.
4. Résines issues de dérivés de l’urée
La condensation avec des dérivés de l’urée ou leur substitution est une technique bien connue. Cependant, ces réactions ont une importance industrielle principalement dans la création d’agents auxiliaires pour les textiles et le papier.
Les réactions impliquant des aldéhydes dépendent de l’existence d’atomes d’hydrogène restants sur les sites d’azote. Cependant, la tendance à la condensation diminue considérablement à mesure que le nombre et la taille des substituants augmentent.
La réaction d’un dérivé d’urée symétriquement disubstitué, tel que la N,N’-diméthylurée ou l’éther diméthylique de dihydroxyméthylurée, en conjonction avec du formaldéhyde dans un milieu acide, donne des dérivés d’urée cycliques d’urones.
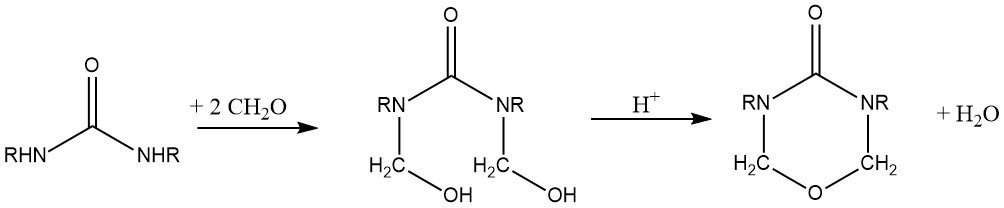
L’éther diméthylique de dihydroxyméthylurone, en particulier la bis (méthoxyméthyl) urone, est d’une utilité industrielle, qui rend les tissus cellulosiques infroissables. Sa réactivité et sa résilience à l’hydrolyse sont vraiment bonnes.
Les urones réagissent avec la cellulose, mais génèrent des quantités minimes de résines auto-réticulées, similaires aux composés urée-formaldéhyde.
Lorsque le soufre (S) remplace l’oxygène (O) dans l’urée, le résultat est la thiourée. Cette thiourée présente toutes les principales réactions de condensation attribuées à l’urée. Dans un milieu légèrement alcalin, des composés N-hydroxyméthyle ainsi que des composés S-hydroxyméthyle se forment.
Pour ce dernier, la postulation initiale adopte la structure tautomère NH2 – C(SH)=NH. Les condensats de thiourée-formaldéhyde surpassent leurs homologues d’urée en termes de résistance à l’eau. On suppose que plusieurs condensats de thiourée forment un arrangement moléculaire cyclique.
5. Résines d’urée modifiées
Les résines aminés peuvent être modifiées de nombreuses manières avec différents groupes fonctionnels.
5.1. Réactions avec les alcools
Les résines aminés peuvent être modifiées par éthérification des groupements hydroxyméthyle avec des alcools en milieu acide.
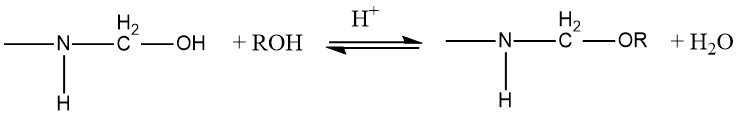
La constante d’équilibre pour l’éthérification de la monohydroxyméthylurée et de la dihydroxyméthylurée avec du méthanol et de l’éthanol a été mesurée. L’enthalpie de réaction est ΔH= -6 à -8 kJ/mol. Les constantes d’équilibre (K) diffèrent selon la substitution :
À mesure que le nombre d’atomes de carbone dans l’alcool augmente, l’équilibre se déplace vers la gauche et la vitesse de réaction diminue, de sorte que l’éthérification devient plus difficile.
Les éthers des alcools à bas point d’ébullition peuvent être transéthérifiés avec des alcools à point d’ébullition plus élevé en chauffant le mélange dans une solution faiblement acide et en distillant les alcools les plus volatils.
Fréquemment, seuls certains des groupes hydroxyméthyle des colles résineuses et des résines d’imprégnation subissent une éthérification avec des alcools monohydriques ou polyhydriques contenant moins de cinq atomes de carbone. En conséquence, certains groupes hydroxyméthyle sont protégés contre la condensation et les résines ont une durée de conservation plus longue.
Dans les matières premières destinées aux revêtements de surface, selon le type, 20 à 100 % des groupes hydroxyméthyle subissent une éthérification. Les résines aminés éthérifiées avec des groupes butyle sont les plus importantes pour les revêtements de bois, par exemple pour le revêtement de parquet.
Lorsqu’une éthérification complète a lieu, la réaction est réalisée à l’aide d’un agent entraîneur – l’alcool lui-même, le toluène ou le xylène – et l’eau est distillée de manière azéotropique.
Les éthers d’alcools à un à trois carbones avec des composés hydroxyméthyliques de faible masse moléculaire d’urée, d’éthylèneurée (imidazolidinone), de propylèneurée (1,3-bis(hydroxyméthyl)tétrahydro-2-(1H)-pyrimidinone) et de mélamine ont obtenu une certaine importance dans le domaine des auxiliaires textiles.
Ces composés sont des précondensats ayant des masses moléculaires relativement faibles, d’environ 600.
Les résines d’urée éthérifiées avec des groupes butyle peuvent être utilisées comme matières premières pour fabriquer des revêtements de surface. Cependant, cuits seuls, ils donnent des films cassants et sensibles à l’eau.
Ils ne peuvent donc pas être utilisés seuls comme liants. En combinaison avec de la nitrocellulose ou avec des résines alkyde, époxy ou acrylate, elles donnent d’excellentes finitions cuites.
5.2. Réactions à l’ammoniac et aux amines
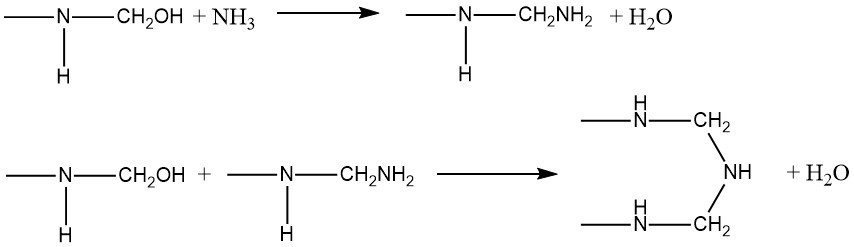
Les amines présentent une réactivité élevée lorsqu’elles réagissent avec les composés hydroxyméthylés de l’urée et du formaldéhyde. L’ammoniac, en particulier, réagit avec le groupe hydroxyméthyle, entraînant la formation soit d’un groupe amino, soit d’un groupe imino, accompagné de l’élimination de l’eau :
-NH-CH2OH + NH3 → -NH-CH2NH2 + H2O
La réaction entre l’ammoniac et le formaldéhyde est exothermique (ΔH = -57 kJ/mol), générant de l’hexaméthylènetétramine. Ce procédé a trouvé une application industrielle pour capturer le formaldéhyde présent dans les gaz résiduaires, tels que ceux provenant de la production de panneaux de particules.
Lorsque l’urée et les aldéhydes sont combinés avec des amines primaires, ils donnent des composés cycliques, appelés triazines de type (1), où R’ peut être un hydroxyméthyle, ses éthers méthyliques ou éthyliques.
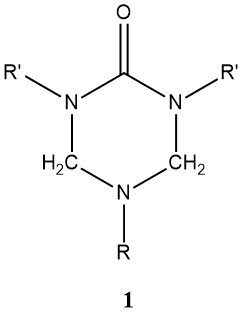
L’ammoniac, les amines primaires ou secondaires, ou les polyamines ayant deux ou plusieurs groupes amino primaires, sont utilisés dans la production de résines amino-modifiées. Ces résines modifiées présentent une plus grande stabilité en présence d’eau que les résines inchangées produites par des procédés similaires.
L’ammoniac et les amines peuvent réagir avec les groupes hydroxyméthyle de l’urée, dans des conditions faiblement acides ou alcalines, pour donner des groupes N-aminométhyle. Dans les solutions fortement acides, ces groupes éliminent les substituants amine pour produire des condensats.
Même les résines d’urée hautement condensées conservent la capacité de lier des quantités importantes d’ammoniac et d’amines car une partie du formaldéhyde persiste sous forme de groupes hydroxyméthyle. Cette application industrielle est utilisée dans la désodorisation des résines ou des panneaux de particules.
La condensation de la molécule de résine avec une amine donne une résine à caractère cationique. Cette caractéristique augmente l’affinité de la résine pour les fibres de cellulose, ce qui la rend précieuse comme agent auxiliaire dans la production textile ou papetière. Ces résines d’urée basiques améliorent la résistance à la traction humide du papier.
5.3. Réaction avec les sulfites
Les groupes hydroxyméthyle des résines aminées peuvent réagir avec l’hydrogène ou d’autres sulfites pour former un aminométhanesulfonate, qui confère un caractère anionique aux résines. Le pH de la solution contrôle la teneur en sulfites.
R-NH-CH2OH + [HSO3]– → [R-NH-CH2SO3]– + H2O
Pour produire des résines de ce type, la réaction de l’urée et du formaldéhyde est initiée en milieu neutre ou alcalin pour réaliser l’hydroxyméthylation. Une fois le degré de conversion souhaité atteint, la condensation est réalisée au moyen de sulfite ou d’hydrogène sulfite dans une solution légèrement acide.
La résine peut réagir avec le sulfite d’hydrogène car de nombreux groupes hydroxyméthyle sont encore présents. Même les résines insolubles dans l’eau peuvent être rendues solubles en les traitant avec du sulfite d’hydrogène une fois la réaction terminée.
Les résines aminés anioniques revêtent une importance industrielle particulière dans le domaine des adhésifs hydrosolubles ou hydrodispersables. D’autres utilisations comprennent les auxiliaires textiles, les auxiliaires en papier, les auxiliaires en cuir et les déodorants.
En plus de la modification avec du sulfite, les brevets mentionnent de nombreux autres modificateurs, tels que les aldéhydes et les triazines. L’affinité des résines anioniques pour la cellulose est inférieure à celle des résines cationiques, les fibres doivent donc être post-traitées avec du sulfate d’aluminium pour fixer les résines.
La modification des colles résines urée-formaldéhyde par de l’acide ligninsulfonique a également été évoquée. Les produits sont des solutions de résine foncée qui ont été utilisées de temps en temps dans l’industrie du bois.
La lignine contient des groupes phénoliques et l’incorporation de composants de lignine confère une résistance à l’eau relativement élevée. Cependant, les lignines sont d’origines et de compositions différentes, le processus de production doit donc être adapté empiriquement aux différentes variétés de lignines. Ce fait et la coloration sombre ont empêché une utilisation plus étendue des déchets de lignine issus de la production de pâte de bois.
Référence
- Amino Resins; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_115.pub2
