Benzaldehyde: Eigenschappen, Reacties, Productie en Toepassingen

Wat is Benzaldehyde?
Benzaldehyde is de belangrijkste aromatische aldehyde, zowel in de natuur als in de industrie, met de formule C7H6O. Het is een kleurloze vloeistof met een kenmerkende geur die lijkt op bittere amandel.
Benzaldehyde wordt in veel planten aangetroffen, zowel gebonden als ongebonden. Een belangrijke natuurlijke bron van benzaldehyde is amygdaline, een glycoside dat in bittere amandelen voorkomt.
De kenmerkende amandelgeur is te danken aan kleine hoeveelheden vrije benzaldehyde, die worden geproduceerd wanneer amygdaline wordt gehydrolyseerd. Benzaldehyde is ook het hoofdbestanddeel van de essentiële oliën die worden gewonnen uit de pitten van perziken, kersen en abrikozen.
In 1818 en 1819 rapporteerden VOGEL en MATRÈS onafhankelijk van elkaar de extractie van een vluchtige olie uit bittere amandelen, samen met blauwzuur. In 1832 voerden WÖHLER en LIEBIG een uitgebreide studie uit naar deze olie en bepaalden de chemische samenstelling en de relatie ervan met benzoëzuur en benzoylchloride.
Inhoudsopgave
1. Fysieke eigenschappen van benzaldehyde
Benzaldehyde is een kleurloze, zeer refractieve vloeistof die vluchtig is in aanwezigheid van stoom. Het is mengbaar met talrijke organische oplosmiddelen en kan worden gemengd met geconcentreerd zwavelzuur, vloeibare koolstofdioxide, vloeibare ammoniak, methylamine en diethylamine bij 25 °C.
Hier is een samenvatting van de fysieke eigenschappen van benzaldehyde:
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 106,13 g/mol |
| Kleur | Kleurloos |
| Geur | Bittere amandelen |
| Fysische toestand | Vloeibaar |
| Kookpunt | 179 °C bij 101,3 kPa |
| Smeltpunt | -56 °C |
| Breukindex | 1,5450 |
| Dichtheid | 1,063 g/cm³ bij 0 °C, 1,046 g/cm³ bij 20 °C, 1,018 g/cm³ bij 50 °C |
| Soortelijke warmtecapaciteit | 1,676 J g⁻¹ K⁻¹ bij 25 °C |
| Warmte van verdamping | 371,0 J/g bij 179 °C |
| Standaardverbrandingswarmte | 33,19 kJ/g |
| Vlampunt | 64,5 °C |
| Zelfontbrandingstemperatuur | 190 °C |
| Onderste explosiegrens | 1,4 vol% |
| Dynamische viscositeit (η) | 1,40 x 10⁻³ Pa · s bij 25 °C
1,11 x 10⁻³ Pa · s bij 40 °C |
| Oppervlaktespanning (s) | 40,04 x 10⁻³ N/m bij 20 °C |
| Dipoolmoment (m) | 2,92 D (9,74 x 10⁻³⁰ C m) in vloeibare benzeen |
| Diëlektrische constante (εr) | 17,7 bij 25 °C |
2. Chemische reacties van benzaldehyde
Benzaldehyde en zijn derivaten hebben een soortgelijk chemisch gedrag als alifatische aldehyden, maar hun reactiviteit is verminderd door de resonantie van de p-elektronen van de carbonylgroep met de aromatische ring.
Deze unieke eigenschap zorgt ervoor dat benzaldehyde verschillende verbindingen kan vormen, zoals Schiff-basen met aminen, oximen met hydroxylamine, hydrazonen met fenylhydrazine en acetalen met alcoholen. Het reageert ook met waterstofcyanide, natriumbisulfiet en Grignard-verbindingen.
Een opmerkelijke synthese van benzaldehyde is de Strecker-reactie, waarbij ammoniak en waterstofcyanide worden gebruikt om een aminonitril-tussenproduct te vormen dat kan worden verzeept om DL-2-fenylglycine te produceren.
Benzaldehyde kan ook auto-oxideren in de lucht om benzoëzuur te vormen. Dit proces wordt beïnvloed door licht en kan worden versneld door peroxiden of zouten van zware metalen, maar worden vertraagd door antioxidanten zoals fenolische verbindingen en difenylamine. Benzaldehyde kan ook worden geoxideerd tot benzoëzuur door middelen zoals salpeterzuur en chroom(VI)oxide.
Het reduceren of hydrogeneren van benzaldehyde onder verschillende omstandigheden resulteert in verschillende producten, waaronder benzylalcohol, dibenzylether, benzoïne, 1,2-difenylethaan-1,2-diol, stilbeen, tolueen en methylcyclohexaan. Katalytische hydrogenering, die industrieel wordt gebruikt, produceert benzylalcohol.
Reductie met aluminiumalcoholaten (Meerwein-Ponndorf-Verley-reductie) is een andere methode om benzylalcohol te verkrijgen, en dit proces kan ook onverzadigde aldehyden, zoals cinnamaldehyde, reduceren terwijl olefinische dubbele bindingen behouden blijven.
Benzaldehyde reageert met ammoniak en waterstof in aanwezigheid van hydrogeneringskatalysatoren om benzylamine te produceren, dat belangrijke industriële toepassingen heeft. Zijketenchlorering van benzaldehyde resulteert in de vorming van benzoylchloride.
Net als alifatische aldehyden neemt benzaldehyde ook deel aan condensatiereacties met verschillende organische verbindingen die actieve waterstofatomen bevatten. Sommige van deze reacties worden in de industrie gebruikt. Bijvoorbeeld, de Claisen-Schmidt condensatie met aceetaldehyde en waterige alkali produceert cinnamaldehyde.

De Perkin-condensatie met azijnzuuranhydride in aanwezigheid van specifieke condensatiemiddelen leidt tot de industriële productie van kaneelzuur.

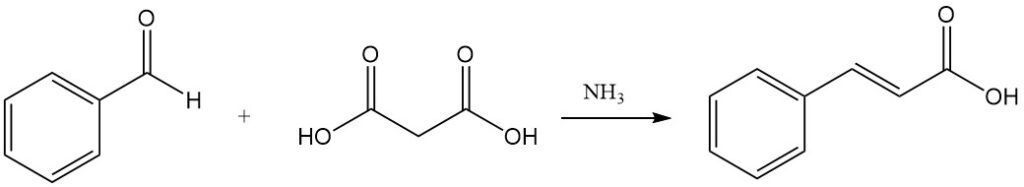
Knoevenagelcondensatie met malonzuur, gekatalyseerd door zwak basische stoffen zoals ammoniak en aminen, is een andere route naar kaneelzuur.
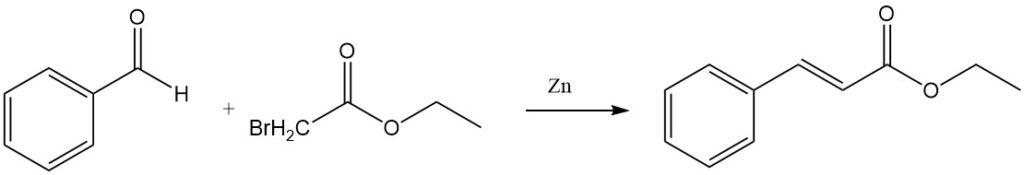
De Reformatsky-reactie van benzaldehyde en ethylbroomacetaat in aanwezigheid van geactiveerd zink levert ethylcinnamaat op.
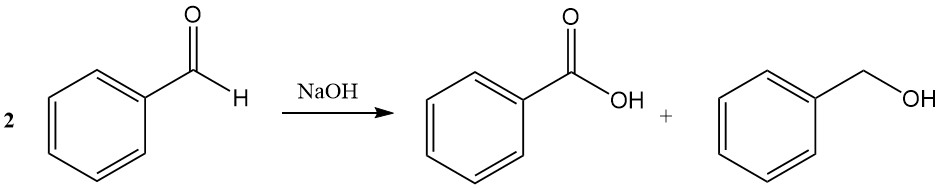
De Cannizzaro-reactie van benzaldehyde leidt tot de vorming van benzoëzuur en benzylalcohol in aanwezigheid van geconcentreerd natriumhydroxide of kaliumhydroxide.
De Claisen-Tishchenko condensatie van benzaldehyde wordt gekatalyseerd door natrium en aluminium benzylaat om benzylbenzoaat te vormen.
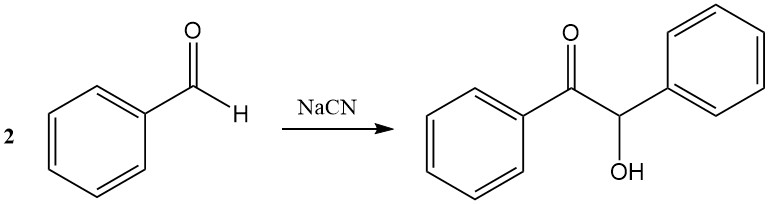
In de benzoïne condensatie combineren twee benzaldehyde moleculen in de aanwezigheid van cyanide om benzoïne te vormen. Thiazoliumzouten kunnen cyanide vervangen als katalysatoren.
Benzaldehyde reageert anders met ammoniak dan alifatische aldehyden; de reactie gaat door tot de vorming van 1-fenyl-N,N’-bis(fenylmethyleen)-methaandiamine (hydrobenzamide).

Benzaldehyde behandeld met Fehling’s oplossing vormt benzylalcohol en benzoëzuur, maar geen koper(I)oxide. Aromatische aldehyden polymeriseren niet en vormen geen cyclische verbindingen zoals alifatische aldehyden.
Benzaldehyde condenseert met fenolen, aromatische aminen en benzeen om trifenylmethaanderivaten te vormen. Deze reactie wordt industrieel gebruikt om Malachietgroene kleurstoffen te maken.
De elektrofiele substitutie van de aromatische kern in benzaldehyde en andere aromatische aldehyden, zoals chlorering, nitrering en sulfonering, vindt voornamelijk plaats in de metapositie.
3. Productie van benzaldehyde
Benzaldehyde wordt voornamelijk geproduceerd door hydrolysering van benzalchloride of gedeeltelijke oxidatie van tolueen. Er bestaan andere productieprocessen, maar deze zijn momenteel niet industrieel belangrijk.
3.1. Productie van Benzaldehyde door Hydrolyse van Benzalchloride
Benzaldehyde wordt geproduceerd door hydrolyse van benzalchloride, een verbinding die gemakkelijk verkregen wordt door chlorering van tolueen. Deze hydrolyse kan worden uitgevoerd in alkalische of zure omstandigheden.

Alkalische hydrolyse:
Benzalchloride kan worden verzeept met verschillende alkalische middelen, zoals calciumhydroxide, calciumcarbonaat, natriumwaterstofcarbonaat of natriumcarbonaat. Natriumcarbonaat is het voorkeursmiddel omdat het nevenreacties minimaliseert.
In een ouder proces wordt benzalchloride verzeept met een lichte overmaat van 15% natriumcarbonaatoplossing bij 138 °C. De reactor is gemaakt van specifieke materialen, zoals een koolstofstalen roervat bekleed met Heresite (een fenolhars) en een koper-siliciumlegering roerder.
Dit proces minimaliseert het chloorgehalte van het gedestilleerde product tot minder dan 0,01%. Een mengsel van benzalchloride en benzotrichloride, dat gewoonlijk wordt verkregen bij de zijketenchlorering van tolueen, kan ook worden gehydrolyseerd. In dit proces wordt benzotrichloride omgezet in natriumbenzoaat en vervolgens in benzoëzuur.
In een recenter continu proces worden benzalchloride en het alkalische verzepingsmiddel in een stromingsreactor omgezet met behulp van een niet-reactief organisch oplosmiddel. Het geëxtraheerde benzaldehyde wordt vervolgens gescheiden van de waterige alkalische fase door een niet-reactief organisch oplosmiddel in de tegenovergestelde richting te laten stromen. Dit continue proces integreert de reactor, extractiezone en waszone in één apparaat.
Als alternatief kan benzalchloride worden omgezet in benzaldehyde door het te koken met een waterige oplossing van hexamethyleentetramine. De Sommelet-reactie kan ook worden gebruikt om benzaldehyde te produceren uit industriële mengsels van benzylchloride en benzalchloride.
Zure hydrolyse:
Benzalchloride kan ook worden gehydrolyseerd in zure omstandigheden, met behulp van zuren en metaalzouten als katalysatoren. Dit levert hoge opbrengsten op van benzaldehyde (meer dan 90%) en waterstofchloride, dat kan worden gewonnen als geconcentreerd zoutzuur.
Vroeger werd deze hydrolyse vaak uitgevoerd in aanwezigheid van geconcentreerd zwavelzuur, wat resulteerde in de vorming van grote hoeveelheden verdund zwavelzuur als afval. Deze methode is geschikt voor de hydrolyse van bepaalde gesubstitueerde benzaldehyden die moeilijk op andere manieren te verzepen zijn.
Metaalzouten, met name ijzer- of zinkzouten, kunnen ook de hydrolyse van benzalchloride katalyseren. Het is belangrijk om de ophoping van water in het reactiemengsel te voorkomen, omdat dit de activiteit van de katalysator kan verminderen.
Het proces kan worden uitgevoerd met behulp van verschillende katalysatoren, zoals zinkfosfaat, zinklauraat, tinchloriden, koper(II)chloride en meer. De reactie kan batchgewijs of continu worden uitgevoerd in een cascade van reactoren.
Hydrolyse in de dampfase:
Een innovatief continu proces omvat de hydrolyse in de dampfase van benzalchloride bij verhoogde temperaturen, gekatalyseerd door actieve kool die is behandeld met zuur of geïmpregneerd met metaalchloride of sulfaat. Dit proces levert een hoge benzaldehyde-opbrengst van 97% op.
Deze methode is met name geschikt voor het hydrolyseren van trifluoromethyl-gesubstitueerde benzalchloriden, die anders lastig om te zetten zijn in de overeenkomstige benzaldehyden. Een soortgelijk dampfaseproces omvat het hydrolyseren van benzalchloride tot benzaldehyde bij 300 °C met behulp van een katalysator zoals siliciumdioxide of aluminiumoxide.
3.2. Productie van benzaldehyde door oxidatie van tolueen
Benzaldehyde kan uit tolueen worden geproduceerd door gedeeltelijke oxidatie, wat kan worden gedaan in de gasfase of de vloeibare fase. De omstandigheden moeten zorgvuldig worden gecontroleerd om gedeeltelijke oxidatie te bevorderen, aangezien benzaldehyde verder kan worden geoxideerd tot benzoëzuur en andere producten.

Gasfase-oxidatie
In het gasfaseproces worden tolueendamp en zuurstof door een katalysatorbed geleid bij hoge temperaturen (250-650 °C). De reactie is erg heet, dus het is belangrijk om deze effectief te koelen.
Om de opbrengst van benzaldehyde te verbeteren, is het nuttig om de tolueendamp en zuurstof te verdunnen met een inert gas, zoals waterdamp, stikstof of koolstofdioxide.
De beste omstandigheden zijn lage conversiepercentages (10-20% per doorgang), korte verblijftijden (0,1-1,0 seconden) en nauwkeurige controle van de hoeveelheid zuurstof. Zelfs onder deze omstandigheden bedraagt de opbrengst doorgaans slechts 40-60% van de theoretische opbrengst op basis van tolueen.
Deze gasfase-oxidatie van tolueen produceert ook andere verbindingen, zoals maleïnezuuranhydride, citraconzuuranhydride, ftaalzuuranhydride, antrachinon, cresol, azijnzuur en aanzienlijke hoeveelheden benzoëzuur, koolmonoxide en kooldioxide. Het toevoegen van kaliumsulfaat of natriumfluoride aan de katalysator of het gebruiken van hoge druk kan de volledige verbranding verminderen.
Verschillende oxidekatalysatoren, die doorgaans molybdeen en andere elementen zoals ijzer, nikkel, kobalt, antimoon, bismut, vanadium, fosfor, samarium, tantaal, tin en chroom bevatten, worden vaak gebruikt voor oxidatie in de gasfase.
Sommige katalysatoren combineren palladium en fosforzuur op actieve kool, terwijl andere bestaan uit gemengde oxiden van zilver en overgangsmetalen. Een ander proces gebruikt een gemengde-oxidekatalysator met uranium, koper, ijzer, fosfor, tellurium en lood naast molybdeen.
Oxidatie in vloeibare fase
Oxidatie in vloeibare fase van tolueen met zuurstof is ook een veelgebruikte methode. Dit wordt meestal gedaan in aanwezigheid van katalysatoren zoals kobalt-, nikkel-, mangaan-, ijzer- of chroomverbindingen. Loodverbindingen, rutheniumverbindingen, thalliumzouten van organische zuren en verschillende promotoren zijn ook gebruikt, maar deze kunnen leiden tot corrosie.
Benzaldehydevorming in de vloeibare fase kan ook oxidatie met andere middelen omvatten, zoals methanol, acetaldehyde, benzoëzuur, azijnzuur of de toevoeging van water.
Destillatie wordt vaak gebruikt om de ruwe benzaldehyde die uit deze processen wordt verkregen te zuiveren, met verdere zuiveringsstappen indien nodig om onzuiverheden te verwijderen die het product verkleuren.
Bijproduct benzaldehyde
In grootschalige processen voor fenol en caprolactamproductie, worden er vaak aanzienlijke hoeveelheden benzaldehyde geproduceerd als bijproducten. Als gevolg hiervan worden speciale oxidatieprocessen voor exclusieve benzaldehydeproductie minder vaak gebruikt in industriële omgevingen.
Deze bijproductstromen van benzaldehyde worden doorgaans verwerkt om zuivere benzaldehyde te verkrijgen. Het is belangrijk om op te merken dat zelfs bij de productie van benzaldehyde als primair product door katalytische oxidatie in de vloeistoffase, aanzienlijke hoeveelheden benzoëzuur en andere bijproducten kunnen worden gevormd.
De ruwe benzaldehyde wordt gewoonlijk geraffineerd door destillatie bij verlaagde druk in een roestvrijstalen kolom.
Andere oxidatieprocessen
Processen waarbij tolueen wordt geoxideerd met middelen zoals mangaandioxide in zwavelzuur, natriumpersulfaat, chroom(VI)oxide in azijnzuuranhydride of chromylchloride zijn over het algemeen niet van industrieel belang vanwege problemen met de afvoer van afvalwater.
3.3. Andere productieprocessen
Er zijn andere manieren om benzaldehyde te maken, maar deze worden niet zo veel gebruikt als de meer gangbare methoden.
- Benzeen en koolmonoxide reactie: Benzaldehyde kan worden gemaakt door benzeen te laten reageren met koolmonoxide. Deze methode wordt echter niet veel gebruikt in de industrie.
- Benzylalcohol oxidatie of dehydrogenering: Benzaldehyde kan ook worden gemaakt door benzylalcohol te oxideren of dehydrogeneren. Deze methode is mogelijk, maar het is niet de belangrijkste manier om benzaldehyde op grote schaal te maken.
- Ruthenium-gekatalyseerde oxidatie van styreen met periodaat of hypochloriet: Benzaldehyde kan worden gemaakt door ruthenium te gebruiken om de oxidatie van styreen met periodaat of hypochloriet te katalyseren. Deze methode wordt niet vaak gebruikt in de industrie om benzaldehyde te maken.
- Hydrolyse van benzylchloride en benzalchloridemengsels: Benzaldehyde kan worden gemaakt door mengsels van benzylchloride en benzalchloride te hydrolyseren in verdund salpeterzuur, met vanadiumpentoxide als katalysator. Dit is echter niet de belangrijkste manier om benzaldehyde te maken in de industrie.
- Reductie van benzoylchloride of methylbenzoaat: Benzaldehyde kan ook worden gemaakt door benzoylchloride of methylbenzoaat te reduceren. Deze methoden zijn over het algemeen niet van industrieel belang voor de productie van benzaldehyde en worden eerder gebruikt bij de synthese van specifieke nucleair gesubstitueerde derivaten.
Samenvattend, deze andere methoden voor de productie van benzaldehyde worden niet vaak gebruikt in de industrie. De eerder beschreven methoden zijn de primaire benaderingen voor grootschalige productie.
4. Toepassingen van Benzaldehyde
Benzaldehyde is een veelzijdige en belangrijke chemische stof met een breed scala aan toepassingen. Het wordt gebruikt om een verscheidenheid aan geurstoffen en smaken te produceren, waaronder die gevonden in natuurlijke bittere amandelolie, parfums, zeep, voedingsmiddelen en dranken.
Benzaldehyde wordt gebruikt om derivaten te produceren die worden gebruikt in de parfum- en smaakstoffenindustrie, zoals cinnamaldehyde, cinnamylalcohol, kaneelzuur en benzylbenzoaat.
Benzaldehyde wordt ook gebruikt om trifenylmethaankleurstoffen te produceren, zoals de leucobase van Malachietgroen en de acridinekleurstof benzoflavine.
In de farmaceutische industrie wordt benzaldehyde gebruikt als tussenproduct bij de productie van chlooramfenicol, efedrine, ampicilline, difenylhydantoïne en andere producten.
Andere belangrijke chemische tussenproducten verkregen uit benzaldehyde zijn benzoë, benzylamine, benzylalcohol, amandelzuur en 4-fenyl-3-buten-2-on (benzylideenaceton).
Benzaldehyde wordt ook gebruikt in de fotochemie, als corrosie-inhibitor en verfstofhulpstof, in de galvaniseerindustrie en bij de productie van landbouwchemicaliën.
5. Toxicologie van benzaldehyde
Benzaldehyde wordt gebruikt in voedsel, cosmetica, farmaceutica en zeep als smaak- en geurstof. Het is over het algemeen veilig voor deze toepassingen. Benzaldehyde heeft ook industriële en agrarische toepassingen.
Benzaldehyde heeft een matige acute toxiciteit. De orale LD50 (dosis die 50% van een testpopulatie doodt) is 1,3 g/kg bij ratten en 1 g/kg bij cavia’s. De geschatte waarschijnlijke dodelijke dosis voor een mens van 70 kg is 50 ml. Subchronische orale toediening aan knaagdieren vertoonde geen nadelige effecten bij dagelijkse doses van 400 mg/kg bij ratten en 300-600 mg/kg bij muizen.
Hogere doses veroorzaakten echter schade aan de hersenen, nieren en voormaag. Mutageniciteitstesten waren negatief. Er zijn geen gerapporteerde studies over de carcinogene, teratogene of reproductieve effecten van benzaldehyde.
Toxische effecten van benzaldehyde omvatten depressie, inactiviteit, tremoren, aanvallen en coma. Ademhalingsdepressie kan dodelijk zijn. Benzaldehyde heeft een zwak lokaal verdovend effect en is licht irriterend voor de ogen en de bovenste luchtwegen. Huidirritatie is matig en sommige personen kunnen een allergische reactie ontwikkelen.
Om risico’s te minimaliseren, vermijd contact met benzaldehyde. Als contact noodzakelijk is, draag dan handschoenen en beschermende kleding. Gebruik in slecht geventileerde ruimtes onafhankelijke ademhalingsapparatuur om blootstelling door inademing te voorkomen.
Referentie
- Benzaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_463.pub2
