Acylering van aromatische verbindingen
1. Friedel-Crafts-acylering
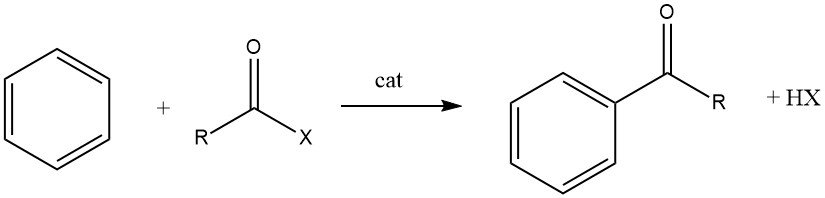
De Friedel-Crafts-acylering omvat de productie van een aromatisch keton door de reactie tussen een aromatische verbinding en een acylerend middel, dat een acylhalide, een zuuranhydride, een zuur of een ester kan zijn. Deze reactie vindt plaats in aanwezigheid van een zure katalysator.
Inhoudsopgave
De acylering van aromatische substraten is van groot industrieel belang omdat het wordt gebruikt voor de synthese van aromatische tussenproducten die veelvuldig worden gebruikt bij de productie van farmaceutische producten, insecticiden, weekmakers, kleurstoffen, parfums en diverse andere commerciële producten. Deze speciale verbindingen worden doorgaans op kleinere schaal geproduceerd in vergelijking met gealkyleerde producten.
| Acyleringsagent | Aromatische verbinding | Product | Eindgebruik |
|---|---|---|---|
| Azijnzuuranhydride | benzeen | acetofenon | parfums, farmaceutica, oplosmiddel, weekmaker |
| Azijnzuuranhydride | tolueen | 4-methylacetofenon | parfums |
| Azijnzuuranhydride | anisole | 4-methoxyacetofenon | parfums |
| Azijnzuuranhydride | isobutylbenzeen | 4-isobutylactofenon | farmaceutica |
| Dichlooracetylchloride | 1,2-dichloorbenzeen | α,α,2,4-tetrachlooracetofenon | insecticiden |
| Chloorbutyroylchloride | fluorbenzeen | chloorpropyl-4-fluorfenylketon | farmaceutica |
| Tetrachloormethaan | benzeen | benzofenon | farmaceutica, insecticiden, parfums |
| Benzoylchloride | benzeen | benzofenon | |
| Fosgeen | N,N-dimethylaniline | 4,4'-bis-dimethylaminobenzofenon | kleurstoffen |
| Ftaalzuuranhydride | benzeen | 2-benzoylbenzoëzuur | antrachinon |
Acylatie vertoont opmerkelijke veelzijdigheid, wat leidt tot diverse producten, waaronder aromatische aldehyden, alkylarylketonen, symmetrische en asymmetrische diarylketonen, evenals cyclisatieproducten.
Acylerende middelen vertonen over het algemeen een hogere reactiviteit dan alkylerende middelen, waardoor acyleringen onder relatief milde omstandigheden kunnen worden uitgevoerd. Aromatische substraten met elektronendonerende substituenten zoals alkyl-, hydroxyl- of alkoxygroepen vertonen een verhoogde reactiviteit.
Omgekeerd zijn aromatische verbindingen met elektronenonttrekkende substituenten zoals nitro-, acyl-, carboxyl- of nitrilgroepen aanzienlijk lastiger om te reageren, zelfs met zeer actieve acylerende middelen.
De introductie van de eerste acylgroep verhindert de toetreding van een tweede acylgroep, waardoor disubstitutie in dezelfde ring zeldzaam is. Er zijn echter enkele uitzonderingen, zoals de diacylering van mesityleen, dureen en anisool met behulp van een mengsel van ijsazijnzuur en fosforpentoxide.
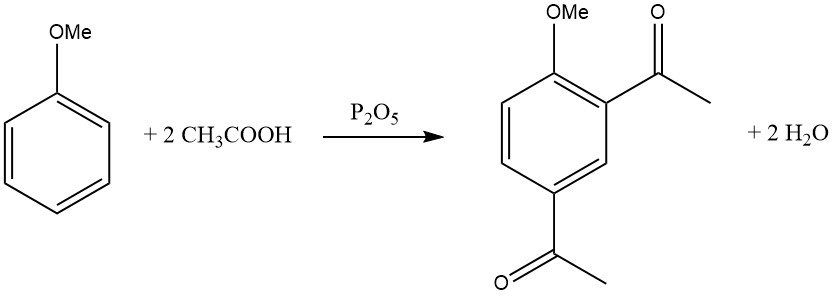
Elektronendonerende substituenten vergemakkelijken acylering en de reactiviteitsverbetering door polysubstitutie is opmerkelijk.
Naast benzeen en zijn derivaten, kunnen polynucleaire carbocyclische aromatische verbindingen zoals naftaleen, difenyl, antraceen, fenantreen en pyreen ook dienen als substraten in acyleringsreacties.
Elektronenrijke heterocyclische verbindingen zoals pyrrool, furaan en thiofeen, samen met hun polycyclische derivaten, vertonen een hoge reactiviteit.
Pyridine en chinoline reageren daarentegen niet tenzij ze worden geactiveerd door substituenten. Niet-benzenoïde aromatische substraten die actief zijn bij acylering omvatten azulenen, ferrocenen en indolizines.
Ondanks dat ze enige overeenkomsten vertonen met Friedel-Crafts-alkylering, vertoont acylering karakteristieke verschillen.
Zo is het verbruik van de zure katalysator doorgaans ten minste stoichiometrisch, hoewel er in de literatuur gevallen zijn waarin substoichiometrische hoeveelheden Lewis-zuren worden gebruikt. De reactie verloopt met een hogere regioselectiviteit en meer uniformiteit vergeleken met Friedel-Crafts-alkylering, wat resulteert in minder isomerisaties en nevenreacties.
1.1. Acyleringskatalysatoren
De katalysatoren die worden gebruikt bij Friedel-Crafts-alkylering kunnen ook worden gebruikt voor acyleringsreacties. De katalysator van keuze is in de meeste gevallen AlCl3. Onzuiverheden in AlCl3, zoals FeCl3 of sporen water, verhogen de reactieopbrengsten en de systeemreactiviteit, met name in gevallen waarin reacties anders traag zijn.
In bepaalde gevallen kan de hoge activiteit van AlCl3 echter leiden tot ongewenste nevenreacties, zoals de ontleding van reactieve heterocyclische verbindingen zoals benzofuraan, etherontleding of alkylgroepherschikkingen.
Om de activiteit van AlCl3 in dergelijke gevallen te matigen, kunnen complexerende oplosmiddelen zoals nitrobenzeen worden gebruikt om 1:1-adducten te vormen. Daarnaast zijn BF3 en SnCl4 geschikte acyleringskatalysatoren voor gevoelige heterocyclische verbindingen.
Wanneer acyleringsmiddelen zoals anhydriden, esters of carbonzuren worden gebruikt, kunnen ook sterke protonzuren zoals zwavelzuur, perchloorzuur, orthofosforzuur en polyfosforzuur worden toegepast.
Polyfosforzuur, dat aanvankelijk voornamelijk werd gebruikt voor intramoleculaire cyclisatiereacties, wordt nu steeds vaker gebruikt bij intermoleculaire acyleringen.
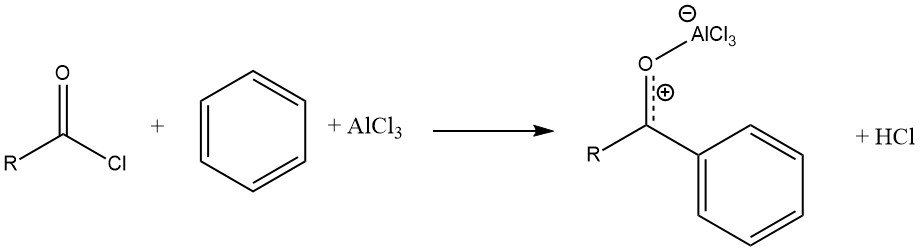
De reactie van een acylhalogenide met een aromatisch substraat, gekatalyseerd door AlCl3, resulteert in de vorming van een stabiel complex van het Lewiszuur met het aromatische keton. Het product wordt vervolgens vrijgemaakt door hydrolyse.
In tegenstelling tot Friedel-Crafts-alkyleringen moet de katalysator doorgaans worden toegepast in ten minste stoichiometrische hoeveelheden ten opzichte van het acylhalide. Er zijn echter enkele uitzonderingen waarbij “echt katalytische” (substoichiometrische) hoeveelheden Lewis-zuren worden gebruikt, zoals ijzerchloride, zink- of ijzeroxiden, kobaltchloride en zeldzame aardmetaaltriflaten.
Voor acyleringsmiddelen zoals carbonzuren of esters is ten minste twee keer de hoeveelheid katalysator vereist, en in het geval van anhydriden drie keer de hoeveelheid (maar 1,5 mol per mol product).
Waterstoffluoride, soms in combinatie met boorfluoride, is een industrieel belangrijke katalysator. Het biedt het voordeel van katalysatorwinning door destillatie, waardoor afvalvorming wordt verminderd.
Deze technologie wordt commercieel gebruikt voor de acylering van isobutylbenzeen tot 4-isobutyacetofenon, een tussenproduct bij de productie van ibuprofen, een veelgebruikt ontstekingsremmend medicijn.
1.1.1. Heterogene katalysatoren
Hoewel de klassieke Friedel-Crafts-synthese met homogene katalysatoren de primaire methode blijft voor het bereiden van aromatische ketonen, heeft het verschillende nadelen:
- Het vereist vaak stoichiometrische of zelfs overtollige hoeveelheden “katalysator” vanwege de vorming van stabiele complexen met de producten. Deze katalysatoren, zoals AlCl3, gedragen zich meer als reagentia dan als echte katalysatoren, wat aanzienlijk bijdraagt aan de productiekosten. Ze moeten uit het product worden gescheiden en gewassen en kunnen niet eenvoudig worden gerecycled.
- Het reactiesysteem is zeer corrosief, wat dure reactoren en apparatuur voor de zuivering van afvalgas vereist, die niet alleen HCl bevat, maar ook gechloreerde koolwaterstoffen.
- De katalysator moet worden geneutraliseerd en afgevoerd samen met een groot volume afvalwater, wat de impact op het milieu vergroot.
De afgelopen jaren zijn er pogingen gedaan om homogene katalysatoren te vervangen door heterogene katalysatoren. Heterogene katalysatoren bieden voordelen zoals het niet nodig hebben van stoichiometrische hoeveelheden, niet-corrosief zijn, eenvoudig te scheiden zijn zonder neutralisatie en de mogelijkheid om ze te recyclen of te gebruiken in continue vaste-bedprocessen.
Heterogene acyleringskatalysatoren moeten sterke Lewis- of Brønstedzuren zijn. Enkele belangrijke klassen van vaste zuren die deze reactie kunnen katalyseren zijn:
- Zeolieten: Microporeuze, kristallijne alumosilicaten met sterke Brønsted- of Lewis-centra. Middelgrote poriënsystemen zoals H-ZSM-5 of grote poriënsystemen zoals HY-zeoliet, bèta-zeoliet of mordeniet zijn succesvol gebruikt voor acyleringsreacties met elektronenrijke aromatische verbindingen.
- Gemodificeerde klei: Kleimineralen kunnen, wanneer ze gemodificeerd zijn, het aantal zure plaatsen vergroten. Met zuur behandelde kleisoorten (Brønsted-zuurkatalysatoren) en ionengewisselde kleisoorten (Lewis-zuurkatalysatoren) worden commercieel gebruikt voor verschillende zuurgekatalyseerde reacties.
- Vaste superzuren: Sterke zuren die sterker zijn dan 100% zwavelzuur, waaronder gesulfateerde oxiden zoals ZrO2, TiO2, HfO2, Fe2O3 en SnO2, zijn bestudeerd als vaste superzuren voor acyleringsreacties.
- Diversen: Andere katalysatoren zoals heteropolyzuren, oppervlaktegemonteerde zuren (proton- of Lewis-zuren op een drager) en Nafion zijn ook onderzocht voor acyleringsreacties, maar ze worden nog niet commercieel gebruikt.
Door heterogene katalysatoren te gebruiken, willen onderzoekers de beperkingen van homogene katalysatoren overwinnen en duurzamere en efficiëntere processen ontwikkelen voor aromatische ketonsynthese.
1.2. Oplosmiddelen in acyleringsreactie
Voor acyleringsreacties met een acylhalide – Lewiszuur katalysatorsysteem speelt de keuze van het oplosmiddel een cruciale rol. Niet-polaire oplosmiddelen zoals CCl4 of CS2, evenals oplosmiddelen met een gemiddelde polariteit zoals dichloormethaan of 1,2-dichloroethane, kunnen worden gebruikt als aromatisch substraat.
Met AlCl3 als katalysator worden heterogene systemen gevormd in deze oplosmiddelen. Echter, het gebruik van oplosmiddelen zoals nitromethaan of nitrobenzeen resulteert in homogene oplossingen en verminderde reactiviteit door complexvorming. De keuze van het oplosmiddel kan ook de regioselectiviteit van de acyleringsreactie beïnvloeden.
Eén gevaar om te overwegen is dat adducten van AlCl3 en nitrobenzeen explosief kunnen ontbinden bij verhoogde temperaturen.
Er zijn drie gebruikelijke procedures voor het uitvoeren van acylering met behulp van een acylhalide – Lewiszuur katalysatorsysteem:
- Het acyleringsmiddel wordt toegevoegd aan een gekoelde oplossing of suspensie van de katalysator in een oplosmiddel, gevolgd door de toevoeging van het aromatische substraat aan het voorgevormde acyleringscomplex (Perrier-methode).
- Alle reactanten worden gemengd en gekoeld, en de katalysator wordt langzaam toegevoegd (Elbs-methode).
- Het aromatische substraat fungeert als oplosmiddel voor de katalysator, en het acyleringsmiddel wordt vervolgens langzaam toegevoegd (Bouveault-methode).
De Perrier-methode heeft vaak de voorkeur omdat deze een constante verhouding van katalysator tot acyleringsmiddel gedurende de reactie handhaaft.
Als zwavelzuur als katalysator wordt gebruikt, is een grote overmaat van het zuur vereist en worden de reactanten hieraan toegevoegd. Om ringsulfonering of aldoliseringsreacties te voorkomen, moet de temperatuur onder de 100 °C worden gehouden.
1.3. Acylerende middelen
Friedel-Crafts-acylering vertoont opmerkelijke veelzijdigheid vanwege de systematische variatie die kan worden geïntroduceerd in zowel het acylerende middel als het aromatische substraat. De reactiviteit van acylerende middelen volgt een trend als volgt:
[RCO]+[BF4]− > [RCO]+[ClO4]− > RCOO-SO3H > RCOX (RCO)2O > RCO2R’ > RCONR’2
Ionische acylperchloraten en tetrafluoroboraten zijn krachtige middelen, terwijl zure esters en amiden vrijwel inactief zijn zonder katalysatoren. De reactiviteit van acylhalogeniden neemt af in de volgorde: RCOI > RCOBr > RCOCl > RCOF.
De reactiviteit van acylhalogeniden wordt ook beïnvloed door de substituent R, die alkyl of aryl kan zijn en halogeen-, alkyl-, alkoxy- of nitrogroepen kan bevatten. De reactiviteit wordt verder beïnvloed door het type aromatisch substraat en de gebruikte katalysator.
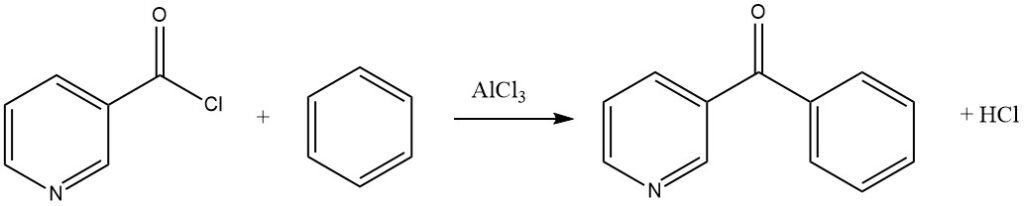
Aromatische acylhalogeniden kunnen nitrosubstituenten bevatten of van het pyridinetype zijn, zoals aangetoond in de synthese van 3-benzoylpyridine uit benzeen en nicotinylchloride.
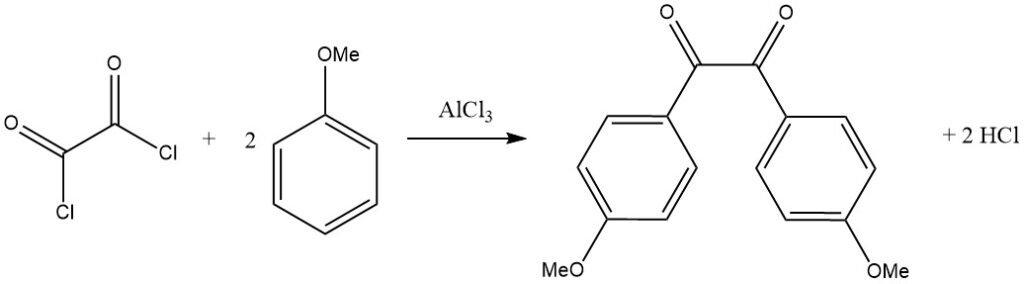
Bifunctionele acylhalogeniden kunnen ook als acyleringsmiddelen werken, zoals blijkt uit de reactie van oxalylchloride met een geactiveerd aromatisch substraat zoals anisool, wat leidt tot het overeenkomstige benzilderivaat.
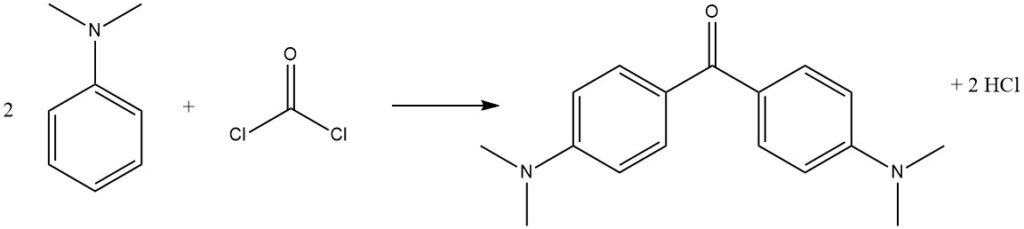
Fosgeen, een commercieel belangrijk reagens, kan reageren met N,N-dimethylaniline om 4,4′-bis(dimethylamino)benzofenon (Michler’s keton) te produceren, dat wordt gebruikt bij de productie van kleurstoffen.
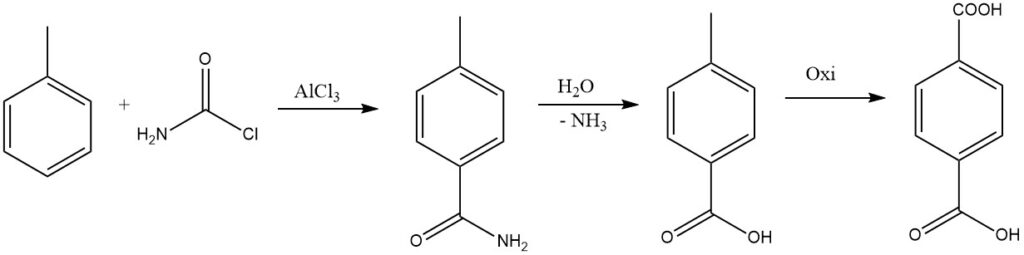
Door één halogeen van fosgeen te vervangen door een amidogroep, kan het resulterende amide worden gehydrolyseerd tot het zuur, dat in aanmerking komt voor de industriële synthese van tereftaalzuur.
Isocyanaten, isothiocyanaten en CO2 kunnen ook dienen als acyleringsmiddelen in aanwezigheid van AlCl3 om aromatische carbonzuren of hun derivaten te produceren.
Asymmetrische bifunctionele acyleringsmiddelen, zoals zuurchloriden die een estergroep bevatten, reageren selectief met de actievere acylgroep.
Op dezelfde manier kunnen zuuranhydriden, zoals barnsteenzuur-, glutaarzuur- of maleïnezuuranhydriden, in aanwezigheid van 2 mol AlCl3 per mol anhydride 4-aryl-4-oxobutaanzuren produceren, die tussenproducten zijn in de Haworth-synthese van polynucleaire aromaten.
De synthese van antrachinon uit ftaalzuuranhydride en benzeen is van commercieel belang. Onder sterk zure omstandigheden kan ook 3,3-difenylftalide worden gevormd.
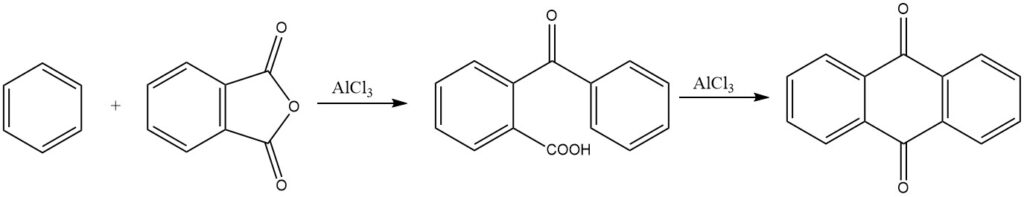
Met zeolietkatalysatoren kunnen niet-geactiveerde carbonzuren in de vloeibare fase worden gebruikt om te reageren met tolueen, wat p-acyltoluenen oplevert met hoge opbrengsten. Dit proces heeft veelbelovende resultaten opgeleverd, met opbrengsten tot 96%.
2. Acylering van benzeen en benzeenderivaten
2.1. Acylering van benzeen
De industriële acylering van benzeen met azijnzuuranhydride, met AlCl3 als katalysator en het handhaven van een temperatuur van 30 °C door koeling, resulteert in acetofenon met een opbrengst van 85%. Acetofenon wordt echter nu voornamelijk industrieel geproduceerd door de oxidatie van ethylbenzeen of cumeen.
Een andere methode omvat de gasfase-acylering van benzeen met benzoëzuur bij verhoogde temperaturen, wat benzofenon oplevert.
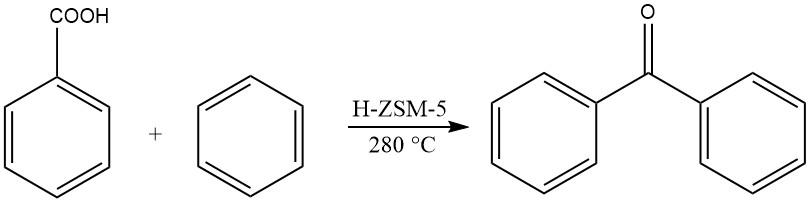
2.2. Acylering van tolueen
Acylering van tolueen, met behulp van acetylchloride en aluminiumchloride als katalysator, resulteert in de vorming van 4-methylacetofenon met een indrukwekkende selectiviteit van 97,6%. Deze verbinding vindt toepassing in de productie van parfums.
2.3. Acylering van gedeactiveerde substraten
Benzenoïde aromatische verbindingen die nitro-, carboxyl-, nitril- en acylsubstituenten bevatten, vertonen een belemmering voor elektrofiele substitutie. Acylering van deze verbindingen wordt echter alleen mogelijk in aanwezigheid van een activerende tweede substituent, zoals een hydroxy- of alkoxygroep.
Aan de andere kant kunnen gedeactiveerde substraten zoals chloorbenzeen worden onderworpen aan acylering om p-chloorbenzofenonen te vormen, met behulp van commerciële heterogene katalysatoren zoals zeolieten of gesulfateerd zirkonia, bekend om hun eigenschappen als vaste superzuren.
2.4. Acylering van geactiveerde substraten
De acylering van geactiveerde substraten, zoals fenol, kan worden bereikt met behulp van verschillende katalysatoren, waaronder carbonzuur – ZnCl2, carbonzuur – BF3 of carbonzuur – polyfosforzuur. De acylering van fenolen vertoont tot 25% selectiviteit voor ortho-substitutie, waarbij de ortho-paraverhouding sterk wordt beïnvloed door de keuze van katalysatoren en oplosmiddelen.
Lineaire alkylfenolen kunnen worden gesynthetiseerd door acylering gevolgd door reductie. Een illustratief voorbeeld is de productie van hexylresorcinol, dat veel wordt gebruikt als ontsmettingsmiddel:
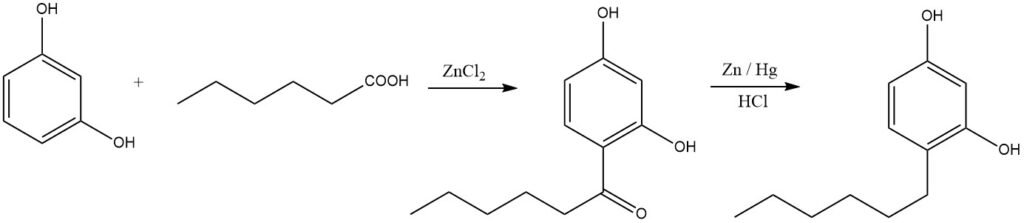
Zowel fenolen als fenylethers zijn zeer reactieve substraten en vertonen reactiviteit onder relatief milde omstandigheden. Anisool kan bijvoorbeeld gemakkelijk worden geacyleerd bij 40 – 50 °C in aanwezigheid van polyfosforzuur. Fenylethers ondergaan daarentegen acylering voornamelijk in de 4-positie.
Een milieuvriendelijk alternatief voor conventionele Friedel-Craft-acyleringssystemen vermijdt de vorming van afvalzouten en bijproducten. Deze aanpak omvat het gebruik van gemengde anhydriden van trifluorazijnzuur, die in situ worden gegenereerd door te reageren met carbonzuren. Lage concentraties H3PO4 dienen als katalysator en trifluorazijnzuur kan worden gerecycled na dehydratie.
2.5. Acylering van aromatische aminen
Na N-acylering vertonen aromatische aminen een reactiviteitspatroon dat lijkt op alkylaromatische verbindingen in acyleringsreacties. Tertiaire aromatische aminen, zoals N,N-dimethylaniline, kunnen acylering ondergaan op de 4-positie, waarbij P2O5 als katalysator wordt gebruikt. Dit is bekend bij de synthese van Michler’s keton.
2.6. Cyclisatiereacties
6-methoxy-1-tetralon wordt verkregen in een indrukwekkende opbrengst van 96% door 4-(3-methoxyfenyl)boterzuur te laten reageren.
Intermoleculaire cyclisaties worden prominent gedemonstreerd in reacties van ftaalzuuranhydride met benzeen en zijn derivaten, wat respectievelijk resulteert in antrachinon en gesubstitueerde antrachinonen.
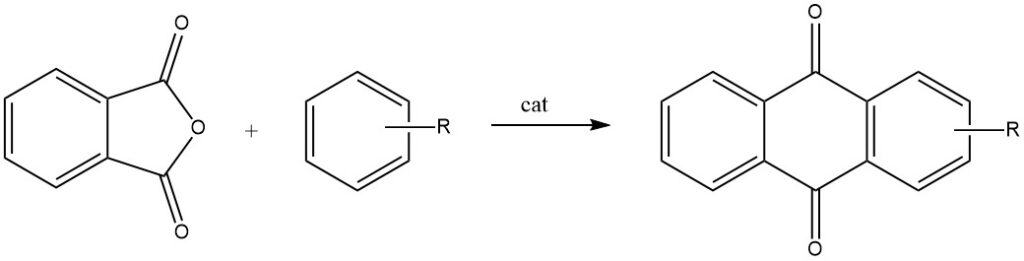
Wanneer ftaalzuuranhydride reageert met tolueen of chloorbenzeen, ondergaat het een proces in twee stappen, wat leidt tot de vorming van 2-gesubstitueerde antrachinonen.
Omgekeerd levert de reactie met 4-chloorfenol direct 1,4-dihydroxyantrachinon (chinizarine) op. Daaropvolgende oxidatie, nitratie, chlorering of aminering van deze producten genereert essentiële tussenproducten voor fijne chemicaliën.
Bovendien produceert de Friedel-Crafts-acylering van ethylbenzeen met ftaalzuuranhydride, via een proces in twee stappen, 2-ethylantrachinon, een belangrijk bestanddeel dat wordt gebruikt bij de synthese van H2O2.
3. Acylering van polynucleaire aromatische verbindingen
3.1. Acylering van naftaleen
Acylering van naftaleen resulteert doorgaans in mengsels van 1- en 2-acylderivaten, en de relatieve verhoudingen van deze derivaten worden voornamelijk beïnvloed door de keuze van het oplosmiddel. Wanneer niet-polaire oplosmiddelen zoals CS2 of CCl4 worden gebruikt, vindt acylering voornamelijk plaats in de 1-positie. Omgekeerd wordt in polaire oplosmiddelen zoals CH3NO2 of C6H5NO2 de vorming van 2-acetylnaftaleen bevorderd.
3.2. Acylering van gesubstitueerde naftaleen
De acylering van gesubstitueerde naftaleen levert vaak complexe mengsels van producten op. Meestal is de sterker geactiveerde ring gevoeliger voor acylering. De regioselectiviteit kan echter worden gecontroleerd door de vormselectiviteit van zeolieten.
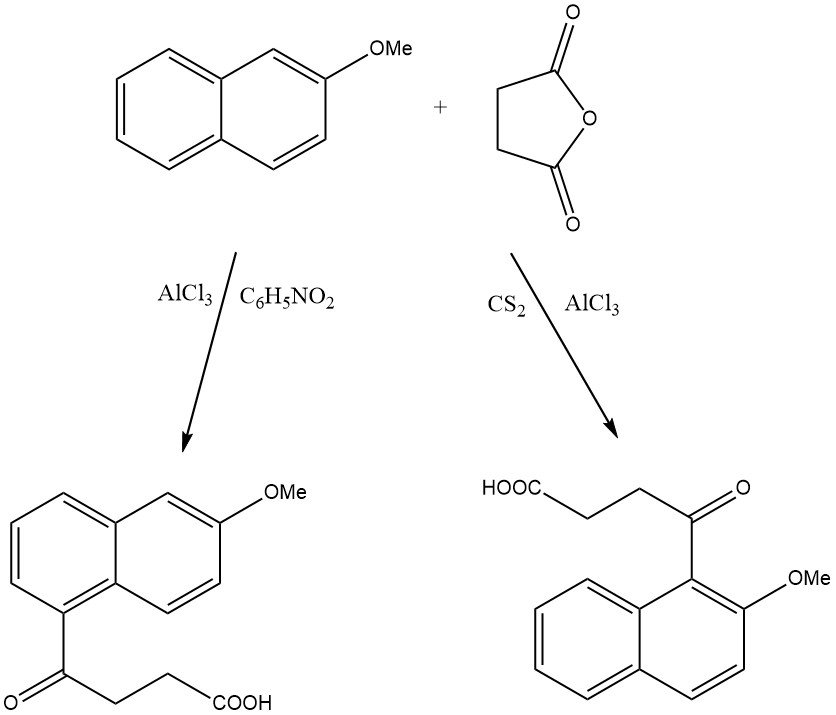
Wanneer bijvoorbeeld 2-methoxynaftaleen wordt geacyleerd op zeoliet HY, wordt alleen 1-acetyl-2-methoxynaftaleen geproduceerd, terwijl op bètazeoliet 2-acetyl-6-methoxynaftaleen wordt gevormd.
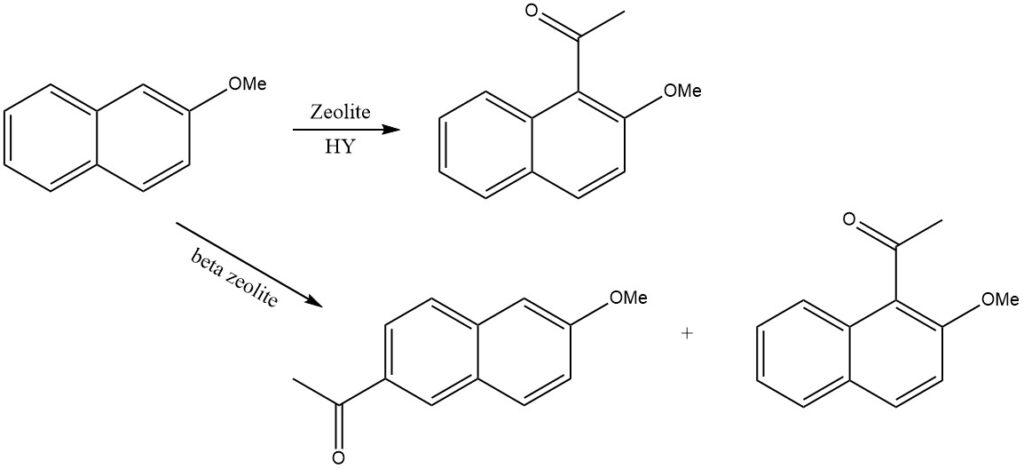
1,5-diacylatie vereist strengere voorwaarden, zoals gezien in de synthese van 1,5-dibenzoylnaftaleen. Deze verbinding kan verder worden gefuseerd in natriumaluminiumchloride om dibenzopyreenchinon te produceren, een kleurstof die op de markt wordt gebracht als Indanthren Goldgelb GK.
Wanneer naftaleen reageert met diacylverbindingen, worden de 1,8-diacyleerde producten vaak gevormd.
3.3. Acylering van bifenylen
Wanneer één ring van een bifenylmolecuul wordt gedeactiveerd door een elektronenonttrekkende substituent, wordt de andere ring reactiever en kan deze acylering ondergaan op de 4-positie. De deactivering van één ring verbetert de reactiviteit van de andere ring, waardoor deze gevoeliger wordt voor elektrofiele substitutie, en dus vindt acylering bij voorkeur plaats op de 4-positie.
3.4. Acylering van antraceen
In aanwezigheid van AlCl3 en onder milde omstandigheden in niet-polaire oplosmiddelen (0 °C, benzeen) ondergaat antraceen acylering op de meest reactieve 9-positie. Isomerisatie van het keton-AlCl3-complex wordt voorkomen door precipitatie.
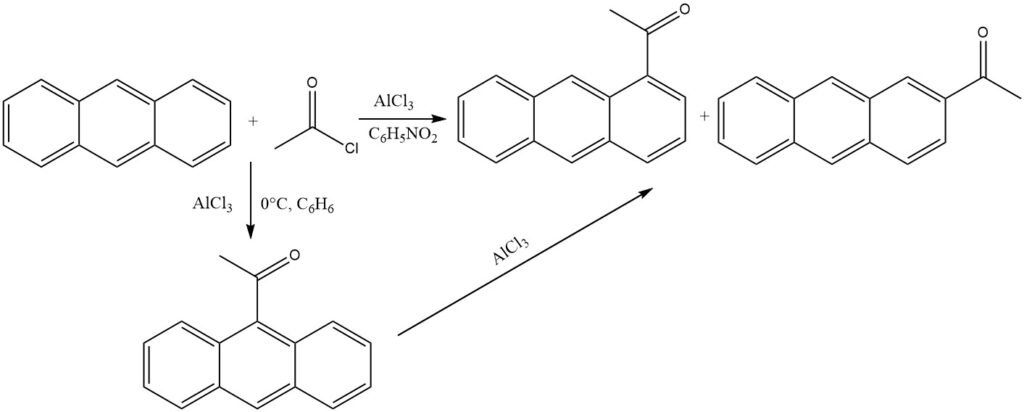
Wanneer echter polaire oplosmiddelen zoals nitrobenzeen worden gebruikt, wordt een mengsel gevormd dat voornamelijk bestaat uit 1-acylanthraceen en wat 2-acylanthraceen. Ook in dit scenario is 9-acylanthraceen waarschijnlijk het initiële product, dat vervolgens isomerisatie ondergaat.
3.5. Acylering van fenantreen
Op dezelfde manier zijn de belangrijkste verkregen producten, wanneer fenantreen wordt geacyleerd in nitrobenzeen, de 2- en 3-acylisomeren. Aan de andere kant leidt het gebruik van het minder polaire oplosmiddel dichloorethaan voornamelijk tot de vorming van het 9-acylisomeer als het primaire product. De keuze van het oplosmiddel speelt een cruciale rol bij het bepalen van de regioselectiviteit van de acyleringsreactie voor fenantreen.
4. Acylering van heteroaromatische verbindingen
Furaan, thiofeen en pyrrool bezitten een hoge elektronendichtheid, waardoor ze zeer geactiveerd zijn in elektrofiele substitutiereacties, waardoor ze onder milde reactieomstandigheden geacyleerd kunnen worden.
4.1. Acylering van furaan
Acylering van furaan resulteert in aanzienlijke opbrengsten van het 2-acylderivaat, met name wanneer anhydriden dienen als acyleringsmiddelen. De uitstekende reactiviteit van furaan maakt het gebruik van benzeen als oplosmiddel mogelijk. Geschikte katalysatoren voor deze reactie omvatten zinkchloride, boortrifluoride en fosforzuur. Bovendien kan acylering ook plaatsvinden op de 5-positie.
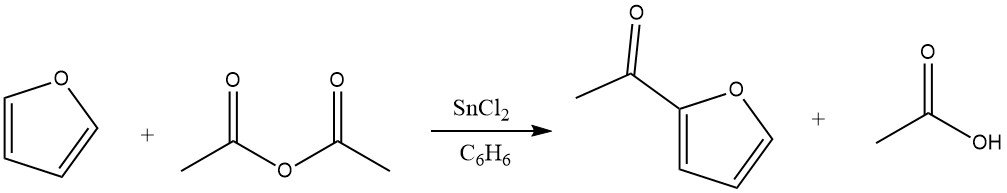
4.2. Acylering van thiofeen
De reactiviteit van thiofeen kan worden vergeleken met die van anisool. Thiofeen kan efficiënt worden geacyleerd, wat hoge opbrengsten van de gewenste producten oplevert, wanneer acylhalogeniden worden gebruikt in aanwezigheid van SnCl4 of anhydriden worden gebruikt met fosforzuur of ZnCl2 als acyleringsmiddel.
4.3. Acylering van pyrrool
Acylering van pyrrool kan zelfs plaatsvinden bij afwezigheid van katalysatoren, hoewel ZnCl2, BF3 en AlCl3 gewoonlijk worden gebruikt in combinatie met anhydriden als acyleringsmiddelen. Over het algemeen vindt acylering plaats op positie 2 van de pyrroolring, maar 2,5-diacylering is ook mogelijk. 3-acylering wordt echter alleen waargenomen wanneer zowel positie 2 als 5 op de pyrroolring geblokkeerd zijn.
4.4. Acylering van imidazolen
Heterocyclische verbindingen die sterk gedeactiveerd zijn en niet geacyleerd kunnen worden in homogene vloeibare fasen, zoals imidazool of pyrazolen, kunnen reageren op Na-Y-zeolieten bij verhoogde temperaturen van meer dan 500 °C.
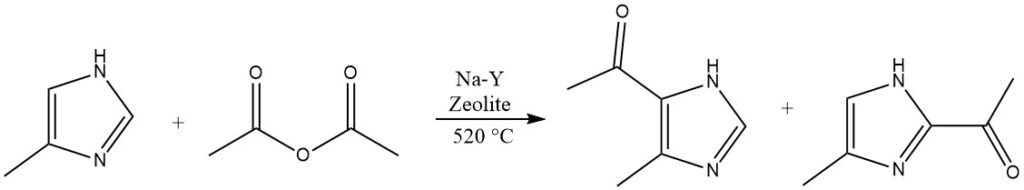
4.5. Acylering van benzofuranen
Zeer reactieve heterocyclische verbindingen kunnen acyleringen ondergaan met behulp van zeolieten in een continu vloeistoffaseproces. De acylering van 2-methylbenzofuran met azijnzuuranhydride is bijvoorbeeld een representatief voorbeeld:
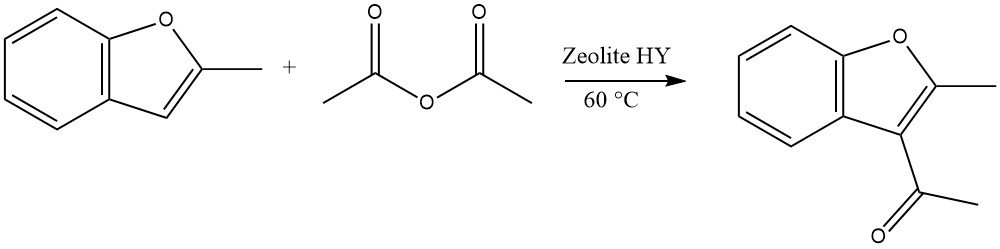
In het geval van dibenzofuraan en dibenzothiofeen kan acylering of diacylering plaatsvinden op de 2- of 8-positie. Voor carbazool vindt acylering of diacylering doorgaans plaats op de 3- of 6-positie.
4.6. Diversen
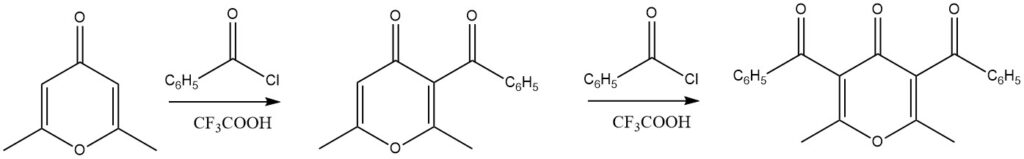
Gesubstitueerde 4H-pyronen hebben uitstekende opbrengsten aangetoond in acyleringsreacties wanneer trifluorazijnzuur als katalysator wordt gebruikt. Opmerkelijk is dat zelfs diacyleringsreacties haalbaar zijn.
Een breed scala aan andere heteroaromatische verbindingen, waaronder chroman, xanthenen, 1,3-benzodioxole en dibenzodioxines, zijn ook succesvol onderworpen aan acyleringsreacties.
5. Acylering van niet-benzenoïde aromatische verbindingen
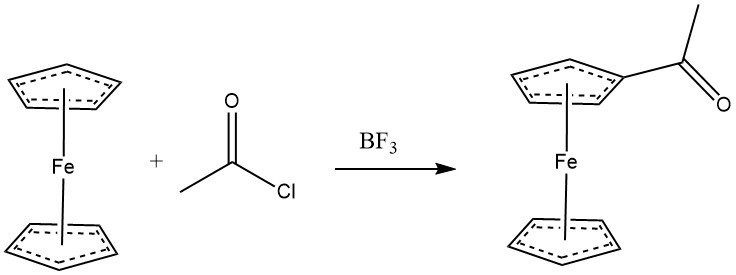
Ferroceen ondergaat gemakkelijk acylering met acylhalogeniden in aanwezigheid van aluminiumchloride, waarbij een vergelijkbare reactiviteit met fenolen wordt getoond. Anhydriden kunnen ook dienen als acyleringsmiddelen. Met BF3 als katalysator kan monoacylering van ferroceen worden bereikt. Wanneer een overmaat van zowel acyleringsmiddel als AlCl3 wordt gebruikt, wordt heteroannulaire diacetylering de overheersende reactie.
Verschillende cyclopentadienylderivaten zijn vatbaar voor acylering. De reactiviteit van sommige aromatische substraten volgt deze volgorde: C6H5OH•(C5H5)2Fe > C6H5OCH3 > CH3C5H4Mn(CO)3 > C5H5Mn(CO)3 > C6H6.
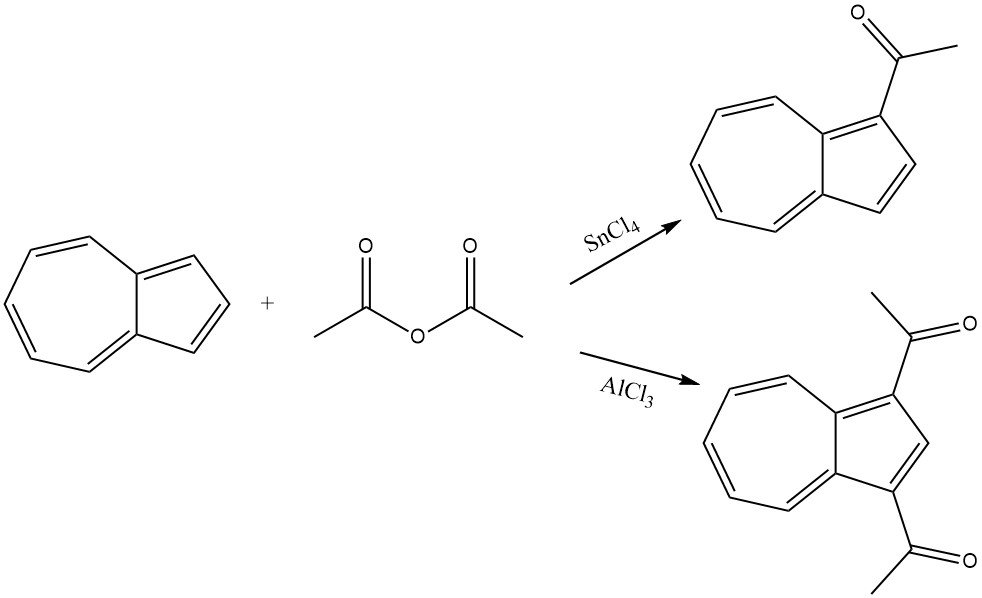
Azuleen reageert soepel met azijnzuuranhydride in aanwezigheid van SnCl4 als katalysator, wat leidt tot de acylering van het cyclopentadienylgedeelte en resulteert in 1-acetylazuleen. Onder strengere omstandigheden en in aanwezigheid van AlCl3 of SnCl4 wordt 1,3-diacetylazuleen gevormd door acetylchloride of azijnzuuranhydride als acyleringsmiddel te gebruiken.
6. Diverse acyleringsreacties
Van de talrijke reacties die leiden tot aromatische C-acyleringsproducten zijn de formyleringsreacties, de Houben-Hoesch-synthese en de Fries-omlegging bijzonder belangrijk.
6.1. Formylering
Formylering van aromatische verbindingen is een specifiek type acyleringsreactie die optreedt wanneer een formylhalogenide of mierenzuuranhydride reageert met een aromatische verbinding in aanwezigheid van een Friedel-Crafts-katalysator, zoals AlCl3. De toepassing van deze reactie is echter beperkt vanwege de instabiliteit van de meeste formyleringsmiddelen.
De Gattermann-Koch-synthese gebruikt een mengsel van waterstofchloride en koolmonoxide met AlCl3 en koper(I)chloride als formyleringsmiddel voor aromatische verbindingen. Benzeen, evenals gesubstitueerde benzenen of polycyclische aromaten, ondergaan formylering om aromatische aldehyden te verkrijgen, met een voorkeur voor de para-isomeren.
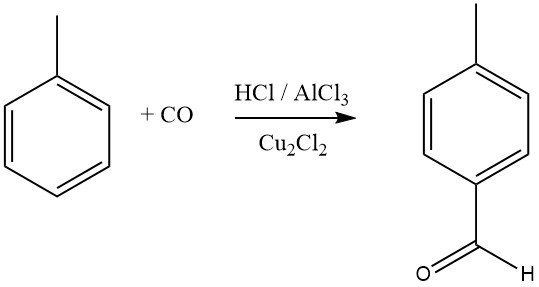
Aromatische verbindingen met meta-sturende substituenten reageren niet in dit formyleringsproces. Mitsubishi Gas Chemical onderzoekt een aangepaste Gattermann-Koch-synthese voor de industriële synthese van tereftaalzuur.
In dit proces reageert tolueen met CO en HF-BF3 om p-tolualdehyde in hoge opbrengst te produceren, dat vervolgens wordt geoxideerd tot tereftaalzuur. Recente studies suggereren dat het werkelijke acyleringsmiddel in deze reacties [CHO]+ is, gevormd door protonering van CO of zijn complexen.
Voor de Vilsmeier-aldehydesynthese worden aromatische en heterocyclische substraten geformyleerd door te reageren met dialkyl- of arylalkylformamiden in aanwezigheid van POCl3. Deze reactie maakt formylering van een verscheidenheid aan verbindingen mogelijk, waaronder reactieve polynucleaire aromatische verbindingen, fenolethers, dialkylaminen en N-heterocyclische verbindingen zoals pyrrool en indool.
De regioselectiviteit van formylering volgt de principes van Friedel-Crafts-reacties, wat doorgaans leidt tot de vorming van 4-gesubstitueerde aromatische verbindingen. Daarnaast kunnen aromatische substraten worden geformyleerd met behulp van dichloormethylmethylether of trialkylorthoformiaat in aanwezigheid van respectievelijk TiCl4 of AlCl3.
6.2. Houben-Hoesch-synthese
De Houben-Hoesch-synthese, nauw verwant aan de Gattermann-reactie, omvat de acylering van reactieve aromatische substraten zoals fenolen, fenylethers, pyrrolen, thiofenen en indolen met behulp van nitrilen. Deze reacties vinden plaats in aanwezigheid van waterstofchloride en zinkchloride.
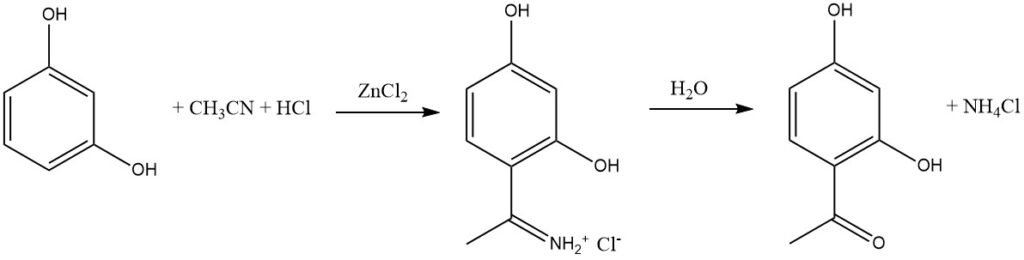
Bij deze synthese is het actieve elektrofiel het imminiumion, dat wordt gevormd door de toevoeging van HCl aan het nitril en vervolgens wordt gecomplexeerd door het Lewiszuur (ZnCl2). Dit omvangrijke tussenproduct leidt voornamelijk tot acylering op positie 4 van het aromatische substraat in plaats van op positie 2.
Vergeleken met Friedel-Crafts-acylering met acylhalogeniden of anhydriden is de Houben-Hoesch-synthese vaak een eenvoudigere methode voor het acyleren van geactiveerde fenolen.
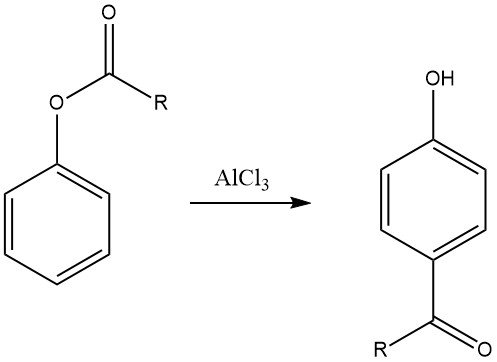
6.3. Fries-herrangschikking
De Fries-herrangschikking van arylesters, die kan worden bereid door de acylering van fenolen, is een waardevolle methode voor het synthetiseren van fenolische ketonen die worden gebruikt bij de productie van fijne chemicaliën. Deze reactie wordt veelvuldig gebruikt in de farmaceutische industrie voor de synthese van geneesmiddelen zoals adrenaline, synefrine, bufenine en acebutolol.
De regioselectiviteit van de Fries-herrangschikking kan worden gecontroleerd door de reactieomstandigheden aan te passen. Over het algemeen wordt para-substitutie bevoordeeld bij lage temperaturen, terwijl ortho-substitutie bevoordeeld wordt bij hoge temperaturen. De keuze van het oplosmiddel en het type en de hoeveelheid katalysatoren beïnvloeden echter ook de regioselectiviteit.
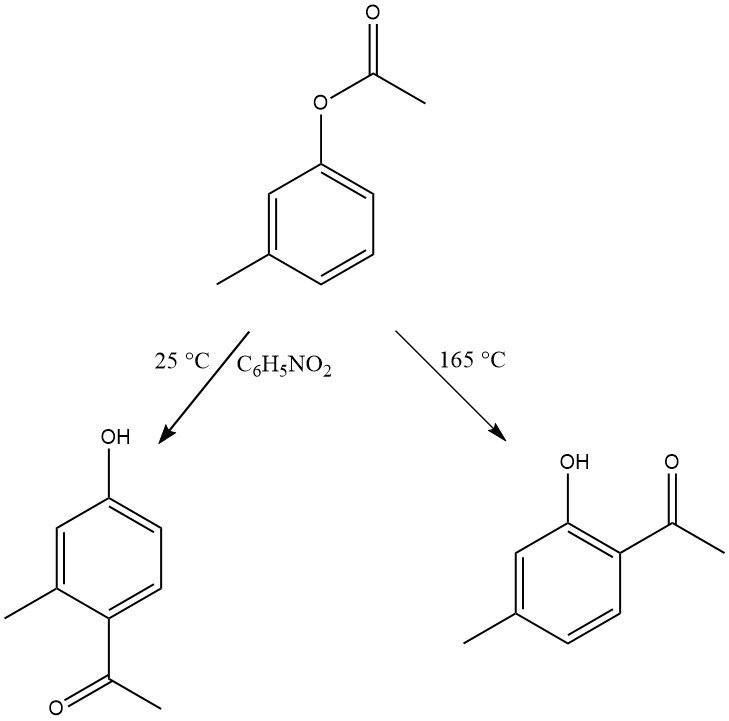
Een breed scala aan substraten met verschillende substituties in zowel de fenol- als de zuurgroepen kunnen deze herschikking ondergaan. Zelfs fenolderivaten met elektronenzuigende groepen, zoals de nitrogroep, evenals naftol- en hydroxy- of dihydroxyfenylesters, zijn reactief in deze transformatie.
N-acylanilinen kunnen ook worden herschikt om 4-acylanilinen te verkrijgen bij verhoogde temperaturen. Het zure deel van de esters kan worden gevarieerd, waardoor het gebruik van verschillende alkyl- of arylzuren mogelijk is, waaronder diaryldicarboxylesters en sulfonzuuresters, die leiden tot de vorming van 4-hydroxyfenylsulfonen.
AlCl3 is de meest gebruikte katalysator, hoewel SnCl4, TiCl4, FeCl3 en ZnCl2 ook effectief en soms handiger zijn. De herschikking wordt doorgaans uitgevoerd door een mengsel van fenolische esters en de katalysator te verhitten tot temperaturen variërend van 80 tot 180 °C.
Afhankelijk van de reactiviteit van het substraat kan de reactie binnen enkele minuten tot enkele uren worden voltooid. Het is mogelijk om de reactie uit te voeren bij lagere temperaturen in oplosmiddelen zoals C6H6NO2, (CH2Cl)2, CS2, C6H5Cl of petroleumether, maar dit vereist langere reactietijden.
Als alternatief kan de herschikking worden gestart in CS2, gevolgd door destillatie om het oplosmiddel te verwijderen en vervolgens worden voltooid bij hogere temperaturen.
Om het ortho-isomeer uit de productmengsels te isoleren, wordt vaak stoomdestillatie gebruikt. Aan de andere kant kunnen vluchtige producten worden gescheiden door fractionele destillatie en kan het para-isomeer worden verkregen uit niet-vluchtige productmengsels door kristallisatie.
Referentie
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
