Aceetaldehyde: Eigenschappen, Reacties en Toepassingen
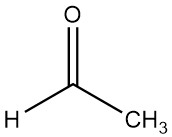
Wat is aceetaldehyde?
Aceetaldehyde, ook bekend als ethanal, is een organische chemische verbinding met de formule CH3CHO. Het is een vluchtige, laagkokende en zeer ontvlambare vloeistof die wordt gekenmerkt door zijn sterke geur.
Aceetaldehyde werd voor het eerst waargenomen door SCHEELE in 1774 toen zwart mangaandioxide en zwavelzuur reageerden met alcohol. De samenstelling ervan werd later uitgelegd door LIEBIG in 1835, die zuivere aceetaldehyde verkreeg door ethanol te oxideren met chroomzuur.
Vanwege zijn opmerkelijke chemische reactiviteit speelt aceetaldehyde een belangrijke rol als tussenproduct bij de productie van verschillende verbindingen, waaronder azijnzuur, azijnzuuranhydride, ethylacetaat, perazijnzuur, butanol, 2-ethylhexanol, pentaerythritol, gechloreerde aceetaldehyde (chloraal), glyoxal, alkylaminen, pyridinen en andere chemicaliën.
De eerste commerciële toepassing betrof de productie van aceton door middel van azijnzuursynthese, die plaatsvond tussen 1914 en 1918 in Duitsland (Wacker-Chemie en Hoechst) en in Canada (Shawinigan).
aceetaldehyde is ook aanwezig in de metabolische processen van planten en dieren, zij het in kleine hoeveelheden. Hogere niveaus van aceetaldehyde kunnen biologische processen verstoren.
Aceetaldehyde wordt van nature in sporen aangetroffen tijdens alcoholische fermentatie, en draagt bij aan de smaak van dranken zoals bier, wijn en sterke drank. Daarnaast is het aangetroffen in plantensappen, etherische oliën, geroosterde koffie en tabaksrook.
Er worden verschillende commerciële methoden gebruikt om aceetaldehyde te produceren. Deze omvatten dehydrogenering of oxidatie van ethanol, toevoeging van water aan acetyleen, gedeeltelijke oxidatie van koolwaterstoffen en directe oxidatie van ethyleen.
Inhoudsopgave
2. Fysieke eigenschappen van aceetaldehyde
aceetaldehyde (44,054 g/mol) is een transparante vloeistof die wordt gekenmerkt door een sterke en verstikkende geur. Wanneer verdund, geeft het een licht fruitige geur af.
Aceetaldehyde is volledig oplosbaar in water en de meeste organische oplosmiddelen. Het vormt geen azeotropen met water, methanol, ethanol, aceton, azijnzuur of benzeen.
Het vormt echter wel binaire azeotropen met butaan (kookpunt -7 °C, bevat 84% butaan per gewicht) en di-ethylether (kookpunt 18,9 °C, bevat 23,5% ether per gewicht).
Hieronder staan enkele fysische eigenschappen van aceetaldehyde:
- Kookpunt bij 101,3 kPa = 20,16 °C
- Smeltpunt = -123,5 °C
- Kritische temperatuur = 181,5 °C
- Relatieve dichtheid (t) = 0,8045-0,001325.t (t in °C)
- Breukindex (t) = 1,34240-0,0005635.t (t in °C)
- Viscositeit van vloeistof bij 20 °C = 0,21 mPa.s
3. Chemische reacties en toepassingen van aceetaldehyde
Aceetaldehyde is een opmerkelijk reactieve verbinding die alle karakteristieke reacties van aldehyden vertoont, evenals die geassocieerd met een alkylgroep waarin waterstofatomen worden geactiveerd door de aanwezigheid van een carbonylgroep in de α-positie.
Bij verhitting tot temperaturen boven 420 °C ondergaat aceetaldehyde ontleding, wat resulteert in de vorming van methaan en koolmonoxide.
3.1. Additiereacties
Aceetaldehyde reageert gemakkelijk met water, waarbij een onstabiel hydraat wordt gevormd. Vaste isoleerbare hydraten zijn echter alleen bekend bij gechloreerde acetaldehyden. Alcoholen kunnen zich aan aceetaldehyde toevoegen, waardoor hemiacetalen ontstaan, die, in aanwezigheid van zuren en daaropvolgende verwijdering van water, acetalen kunnen vormen wanneer ze worden gecombineerd met extra alcohol.
Diolen leiden tot de vorming van cyclische acetalen. Ethyleenglycol en aceetaldehyde leveren bijvoorbeeld 2-methyl-1,3-dioxolaan op, terwijl 1,3-propaanediol en aceetaldehyde 2-methyl-1,3-dioxaan opleveren.

De reactie tussen aceetaldehyde en waterige natriumbisulfietoplossing levert een kristallijn adduct op, waaruit aceetaldehyde kan worden vrijgemaakt.
Droge ammoniak reageert met aceetaldehyde, wat resulteert in de vorming van kristallijne aceetaldehyde-ammoniak.
aceetaldehyde en blauwzuur ondergaan een reactie om lactonitril (α-hydroxypropionitril) te produceren, wat een potentieel tussenproduct is in de productie van acrylonitril.
De reactie tussen aceetaldehyde en azijnzuuranhydride levert ethylideendiacetaat op, een tussenproduct in het vinylacetaatproces dat wordt uitgevoerd door Celanese Corp.
3.2. Derivaten van aldoladditie
Onder de aanwezigheid van alkalische katalysatoren of bij milde verhitting combineren twee moleculen aceetaldehyde om acetaldol te vormen. Bij hogere temperaturen wordt water gemakkelijk uit acetaldol verwijderd, wat resulteert in de vorming van crotonaldehyde. De industriële betekenis van verdere condensatie om aldehydeharsen te vormen, zoals synthetische schellak, is echter afgenomen.
Ureum en aceetaldehyde kunnen condenseren in de aanwezigheid van H2SO4, wat leidt tot de vorming van crotonylideendiurea (6-methyl-4-ureidohexahydropyrimidin-2-one), dat wordt gebruikt als een stikstofmeststof voor de lange termijn.

Aceetaldehyde dient als tussenproduct bij de synthese van butadieen. Het begint met acetyleen en gaat verder via acetaldol en het hydrogeneringsproduct, 1,3-butaandiol. Dit proces werd geïntroduceerd in het begin van de 20e eeuw en wordt nog steeds op commerciële schaal beoefend in bepaalde Oost-Europese landen.
Acroleïne wordt verkregen door de aldolcondensatie van aceetaldehyde en formaldehyde, gevolgd door watereliminatie, vergelijkbaar met de vorming van crotonaldehyde. Deze methode mist echter hedendaagse commerciële betekenis. Omgekeerd is de productie van pentaerythritol uit aceetaldehyde en een viervoudige hoeveelheid formaldehyde in aanwezigheid van Ca(OH)2 of NaOH van aanzienlijk industrieel belang.
3.3. Reactie met stikstofverbindingen
Primaire aminen reageren met aceetaldehyde om Schiff-basen te vormen, weergegeven als CH3CH=NR. Stikstofverbindingen zoals hydroxylamine, hydrazine, fenylhydrazine en semicarbazide kunnen reageren met aceetaldehyde , wat gemakkelijk kristalliseerbare verbindingen oplevert die worden gebruikt voor analytische bepaling en karakterisering van aldehyden. Voorbeelden zijn semicarbazon (smeltpunt: 162 – 163 °C), p-nitrofenylhydrazon (smeltpunt: 128,5 °C), 2,4-dinitrofenylhydrazon (smeltpunt: 168 °C) en oxime (smeltpunt: 47 °C).
Vergelijkbare methoden kunnen worden gebruikt voor de karakterisering van andere aldehyden en ketonen, aangezien hun analoge derivaten over het algemeen verschillende en goed gedefinieerde smeltpunten bezitten.
De synthese van pyridine en pyridinederivaten heeft steeds meer aan belang gewonnen. 5-Ethyl-2-methylpyridine kan worden verkregen door waterige ammoniak te laten reageren met aceetaldehyde in aanwezigheid van fluoride-ionen. Paraldehyde, dat geleidelijk het monomeer vrijgeeft, kan ook worden gebruikt. In aanwezigheid van formaldehyde of acroleïne ontstaat een mengsel van pyridine en alkylpyridines.

3.4. Oxidatie
Een aanzienlijk deel van de commercieel geproduceerde aceetaldehyde wordt gebruikt bij de productie van azijnzuur door oxidatie met zuurstof of lucht.
Aceetaldehyde monoperacetaat is een tussenproduct dat onder verhoogde temperaturen en de aanwezigheid van katalytische hoeveelheden ijzer- of kobaltzouten uiteenvalt in perazijnzuur en aceetaldehyde. In aanwezigheid van Mn2+ zouten kan azijnzuur worden verkregen uit aceetaldehyde monoperacetaat. Bovendien kan azijnzuuranhydride worden gevormd door Co2+ en Cu2+ zouten te gebruiken.

Oxidatie met salpeterzuur resulteert in de vorming van glyoxal, terwijl gehalogeneerde acetaldehyden kunnen worden bereid door halogenering.
Monochlooraceetaldehyde, di- en trichlooracetaldehyde, evenals tribroomacetaldehyde (bromal), vinden nut in de productie van insecticiden (bijv. DDT, DDD), farmaceutica en kleurstoffen.
3.5. Reductie
Aceetaldehyde kan gemakkelijk worden gehydrogeneerd om ethanol te produceren. Vóór 1939, toen petrochemisch geproduceerd ethyleen beschikbaar werd in Europa, werd deze reactie industrieel gebruikt om ethanol te produceren uit aceetaldehyde en, bijgevolg, uit acetyleen.
Monoethylamine, diethylamine en triethylamine kunnen worden gesynthetiseerd uit aceetaldehyde, ammoniak en waterstof in aanwezigheid van een hydrogeneringskatalysator. Raadpleeg voor meer informatie de productie van alifatische aminen.
3.6. Diverse reacties
De Tishchenko-reactie van aceetaldehyde , gekatalyseerd door aluminiumalcoholaat, resulteert in de productie van het commercieel belangrijke oplosmiddel ethylacetaat.
Aceetaldehyde dient als een “radicalenvangend middel” bij de polymerisatie van vinylverbindingen, waarbij de ketenlengte van de polymeren wordt gecontroleerd.
3.7. Polymeren van aceetaldehyde
3.7.1. Paraldehyde
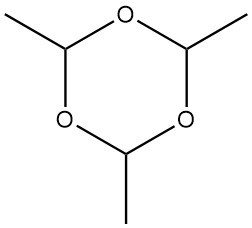
Paraldehyde, 2,4,6-trimethyl-1,3,5-trioxaan met een moleculair gewicht van 132,161, is een cyclisch trimeer van aceetaldehyde. Het heeft een kleurloos uiterlijk en verspreidt een etherische, doordringende geur.
Paraldehyde kan worden gesynthetiseerd uit aceetaldehyde in aanwezigheid van zure katalysatoren, zoals zwavelzuur, fosforzuur, zoutzuur of zure kationenwisselaars. In een homogene reactie wordt aceetaldehyde toegevoegd aan paraldehyde dat een kleine hoeveelheid zwavelzuur bevat, onder roeren en koelen.
Na voltooiing blijft roeren om evenwicht te bereiken en wordt het zwavelzuur nauwkeurig geneutraliseerd met behulp van een natriumzout zoals natriumacetaat, natriumcarbonaat of natriumbicarbonaat. Fractionele destillatie scheidt het reactiemengsel in aceetaldehyde, water en paraldehyde.
Voor continue productie wordt vloeibare aceetaldehyde bij temperaturen van 15 – 20 °C of aceetaldehydedamp bij temperaturen van 40 – 50 °C over een zure kationenwisselaar geleid, waardoor een conversiepercentage van meer dan 90% wordt bereikt. Vervolgens wordt distillatie toegepast om aceetaldehyde van paraldehyde te scheiden.
Depolymerisatie omvat langzame distillatie van aceetaldehyde in aanwezigheid van zure katalysatoren. Als alternatief kan paraldehyde in de gasfase worden afgebroken met behulp van katalysatoren zoals HCl, HBr, H3PO4 of kationenwisselaars. De depolymerisatiereactie volgt een eerste-orde-snelheid.
Paraldehyde vindt toepassingen in chemische synthese als bron van aceetaldehyde, waardoor harsvorming en andere secundaire reacties worden geëlimineerd. Deze synthese wordt gebruikt bij de productie van pyridines en de chlorering van chloraal.
Tussen 1939 en 1945 werd paraldehyde gebruikt als motorbrandstof.
3.7.2. Metaldehyde

Metaldehyde is het cyclische tetrameer van aceetaldehyde. Het vormt tetragonale prisma’s met een smeltpunt van 246,2 °C (gesloten capillair) en een sublimatietemperatuur van 115 °C. De verbrandingswarmte bij constant volume is 3370 kJ/mol.
Metaldehyde is onoplosbaar in water, aceton, azijnzuur en koolstofdisulfide.
De depolymerisatie van metaldehyde tot aceetaldehyde begint bij 80 °C en is voltooid boven 200 °C. Zure katalysatoren zoals verdund H2SO4 of H3PO4 worden gebruikt in het depolymerisatieproces.
Metaldehyde vertoont niet de typische reactiviteit van aceetaldehyde. Het wordt gestabiliseerd door ammoniumcarbonaat of andere zwak basische verbindingen die potentiële zure katalysatoren neutraliseren.
Metaldehyde wordt, samen met aanzienlijke hoeveelheden paraldehyde, verkregen tijdens de polymerisatie van aceetaldehyde in aanwezigheid van HBr en aardalkalimetaalbromiden zoals CaBr2 bij temperaturen onder 0 °C.
De opbrengsten liggen echter zelden boven de 8%. Hogere opbrengsten van 14 – 20% zijn gerapporteerd wanneer 7 – 15% van een alifatische of cyclische ether aanwezig is bij temperaturen variërend van 0 tot 20 °C. Onoplosbaar metaldehyde wordt vervolgens gefilterd.
Aceetaldehyde wordt vervolgens gedestilleerd uit het filtraat na depolymerisatie van de paraldehyde en kan worden gerecycled in het polymerisatieproces. Deze recycling van grote hoeveelheden aceetaldehyde leidt echter tot hogere proceskosten vanwege verliezen.
Metaldehyde in pelletvorm is commercieel verkrijgbaar als droge brandstof (Meta). In combinatie met lokaas wordt metaldehyde gebruikt als molluscicide.
3.7.3. Polyaceetaldehyde
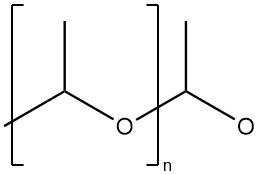
Polyacetaldehyde is een polymeer met een hoog moleculair gewicht en een acetaalstructuur (polyoxymethyleenstructuur).
Door gebruik te maken van kationische initiatoren wordt voornamelijk een amorf polymeer verkregen. Temperaturen onder -40 °C hebben in dit geval de voorkeur. Boven -30 °C worden voornamelijk paraldehyde en metaldehyde geproduceerd.
De initiatoractiviteit is ook afhankelijk van het gebruikte oplosmiddel. Geschikte initiatoren zijn onder meer H3PO4 in ether en pentaan, evenals HCl, HNO3, CF3COOH, AlCl3 in ether en met name BF3 in vloeibaar ethyleen. Al2O3 en SiO2 lijken ook goede initiatoren te zijn.
Het polymeer heeft een rubberachtige consistentie en is oplosbaar in gangbare organische oplosmiddelen. Het depolymeriseert bij kamertemperatuur, waarbij aceetaldehyde vrijkomt. Het verdampt volledig binnen een paar dagen of weken. Zure verbindingen versnellen de depolymerisatie en aminen (bijv. pyridine) stabiliseren polyacetaldehyde tot op zekere hoogte.
3.8. Consumptie
In de Verenigde Staten werd aceetaldehyde vanaf 1993 niet meer gebruikt in de productieprocessen van azijnzuur, butanol en 2-ethylhexanol, omdat er nu alternatieve methoden worden gebruikt voor de productie ervan.
De vraag naar aceetaldehyde is echter toegenomen voor andere stoffen zoals perazijnzuur en pyridinebasen.
| Producten | Consumptie (t) |
|---|---|
| Azijnzuur/azijnzuuranhydride | 147.000 |
| Acetaatesters | 321.000 |
| Pentaerythritol | 80.000 |
| Pyridine en pyridinebasen | 83.000 |
| Perazijnzuur zuur | 23.000 |
| 1,3-Butyleenglycol | 14.000 |
| Anders | 98.000 |
Referentie
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
