Anilina: proprietà, reazioni, produzione e usi
Cos’è l’anilina?
L’anilina, nota anche come amminobenzene, è un’ammina aromatica con formula chimica C6H5NH2. È un liquido infiammabile incolore o leggermente giallo con un odore dolce, simile all’ammina, e diventa marrone se esposto all’aria e alla luce.
Il suo isolamento risale all’inizio del XIX secolo e la sua struttura fu definitivamente stabilita da A. W. Von Hofmann nel 1843 attraverso la riduzione del nitrobenzene.
Il metodo industriale iniziale per la sintesi dell’anilina fu stabilito già nel 1854. Negli ultimi 145 anni, l’anilina è emersa come uno dei 100 principali elementi costitutivi essenziali nel campo della chimica.
L’anilina è un intermedio essenziale in un’ampia gamma di applicazioni, ad esempio negli isocianati, negli agenti di lavorazione della gomma, nei coloranti e nei pigmenti, nei prodotti chimici agricoli e nei prodotti farmaceutici.
Sommario
1. Proprietà fisiche dell’anilina
L’anilina è parzialmente solubile in acqua e miscibile con la maggior parte dei solventi organici (ad esempio etanolo, acetone e benzene).
Le proprietà fisiche importanti dell’anilina sono le seguenti:
- Massa molecolare = 93,13 g/mol
- Punto di ebollizione (101,3 kPa) = 184,4 °C
- Punto di solidificazione = -6,2 °C
- Punto di infiammabilità (DIN 51758) = 76 °C
- Temperatura di accensione (DIN 51758) = 540 °C
- Soglia di odore = 0,5 mL/m3
- Densità liquido (20 °C) = 1,022 g/cm3
- Solubilità (20 °C) Anilina in acqua =3,6 %
- pKb = 9.30
- Valore pH (3,6 g di anilina per litro, 20 °C) = 8.8
2. Reazioni chimiche dell’anilina
La chimica dell’anilina è determinata dal gruppo amminico primario (Figura 1) e dal nucleo benzenico attivato (Figura 2).
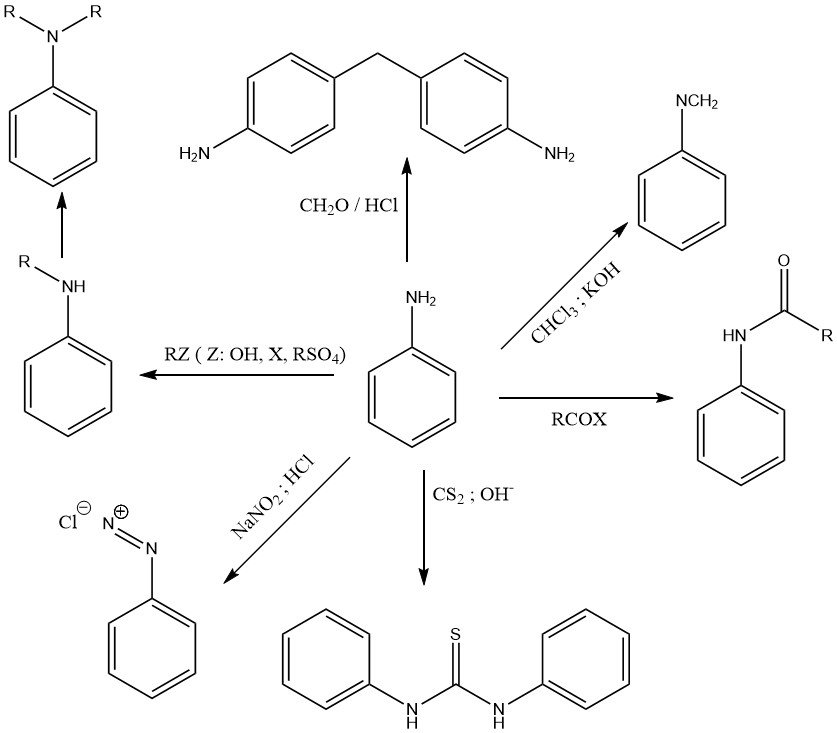
La coppia di elettroni solitari sull’azoto del gruppo amminico è parzialmente delocalizzata nel sistema ad anello aromatico. Pertanto, l’anilina è solo una base debole (pKa = 4,60) rispetto alle ammine alifatiche come la cicloesilammina (pKa = 10,64).
Tuttavia, l’anilina forma sali stabili e solubili in acqua con acidi minerali forti (ad esempio, acido cloridrico o solforico). La formazione di solfato di anilina può essere utilizzata per proteggere il gruppo amminico dell’anilina dall’ossidazione durante le successive fasi di sintesi.
Vari agenti alchilanti (come alcoli, alogenuri alchilici, alchilsolfati e olefine) alchilano il gruppo amminico per formare N-alchil e N,N-dialchilanilina in reazioni catalizzate da acido di Lewis a temperatura e pressione elevate.
La reazione dell’anilina con cloroformio in una soluzione di potassa caustica produce fenilisocianuro.
La N,N-difeniltiourea è il prodotto della reazione di anilina e disolfuro di carbonio in una soluzione alcolica alcalina.
Una reazione caratteristica delle ammine aromatiche primarie come l’anilina è la formazione di sali di diazonio con acido nitroso.
L’anilina subisce reazioni di condensazione con alchilaldeidi. La reazione più importante è la formazione di 4,4′-metilenedianilina (MDA) per condensazione dell’anilina con formaldeide in presenza di acido cloridrico.
L’anilina reagisce con acidi organici e derivati acidi per formare ammidi.
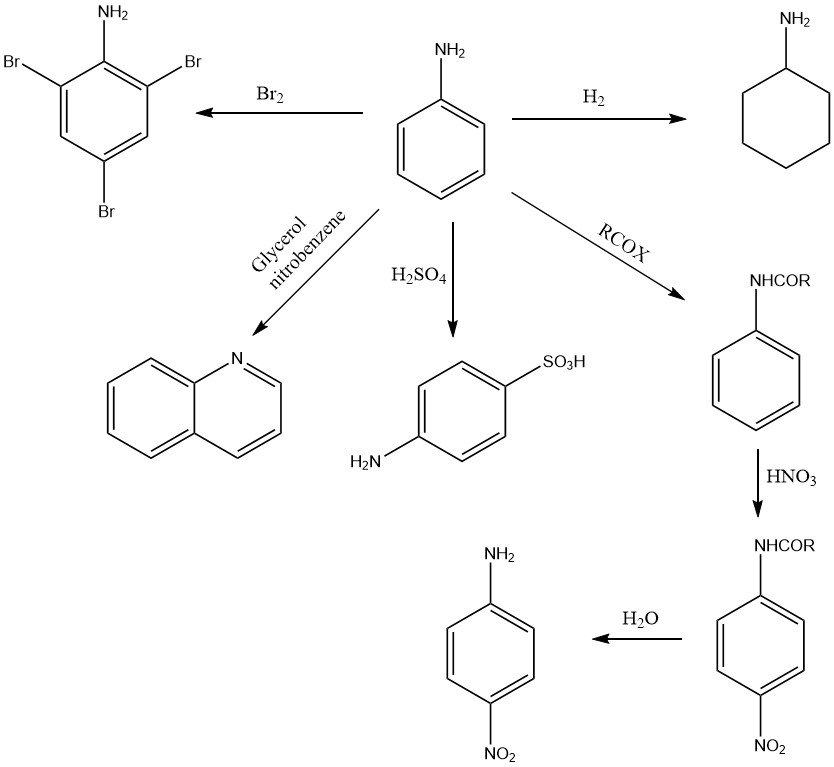
L’anilina subisce una varietà di reazioni di ossidazione, a seconda dell’agente ossidante e delle condizioni. Possono essere formati prodotti mononucleari come p-benzochinone (MnO2, H2SO4), composti bimolecolari come l’azobenzene (aria) o sostanze polimeriche come il nero di anilina (Cu o V, Na2Cr2O7 o NaClO3) (vedere Figura 2).
L’anello aromatico dell’anilina viene idrogenato cataliticamente per dare cicloesilammina e/o dicicloesilammina a temperatura e pressione elevate, a seconda delle condizioni e del tipo di catalizzatore.
La presenza del gruppo amminico attiva le posizioni orto e para dell’anello aromatico e, di conseguenza, l’anilina reagisce facilmente con le sostanze elettrofile. Ad esempio, la bromazione dell’anilina con bromo produce 1,3,5-tribromoanilina in condizioni blande.
La reazione con acido solforico ad alta temperatura forma quasi esclusivamente acido 4-amminobenzene solfonico (acido 4-solfanilico).
La nitrazione dell’anilina (dopo aver protetto il gruppo amminico dall’ossidazione mediante la formazione di acetanilide) forma il composto 4-nitro.
Dall’anilina si possono ottenere numerosi composti N-eterociclici. Ad esempio, la chinolina viene prodotta nella sintesi di Skraup mediante condensazione dell’anilina con glicerolo o acrilaldeide (acroleina) nel nitrobenzene.
3. Produzione di anilina
La maggior parte dei processi di sintesi dell’anilina utilizzati nelle applicazioni commerciali inizia dal benzene.
Sebbene vi siano stati tentativi di aminare direttamente il benzene, il processo richiede alte temperature e pressioni, nonché un eccesso di ammoniaca, il che ha ostacolato lo sviluppo di un metodo economicamente sostenibile.
Invece, DuPont e Mitsui Toatsu hanno studiato l’aminazione ossidativa del benzene, che genera acqua come sottoprodotto.
Attualmente, tutti i produttori globali, ad eccezione di Mitsui Petrochemicals Ind. (Giappone), utilizzano il nitrobenzene come materia prima per la produzione di anilina.
Mitsui Petrochemicals Ind. impiega inoltre il fenolo come materiale di partenza, mentre Aristech Chemical Corp. (Stati Uniti) utilizza esclusivamente la via del fenolo.
3.1. Produzione di anilina mediante idrogenazione catalitica del nitrobenzene
L’idrogenazione catalitica altamente esotermica (ΔH = -544 kJ/mol a 200 °C) del nitrobenzene viene eseguita sia in fase di vapore che in fase liquida in processi utilizzati commercialmente.
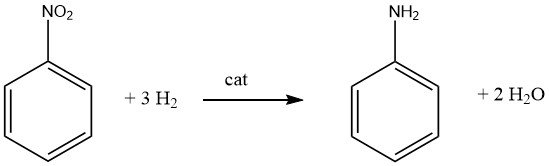
Uno scambio di calore efficiente e l’utilizzo del calore di reazione sono aspetti cruciali per qualsiasi processo che utilizzi nitrobenzene come materia prima.
3.1.1. Idrogenazione catalitica in fase vapore
Il nitrobenzene può essere convertito in anilina con rese elevate utilizzando processi di idrogenazione.
Vengono solitamente impiegate tecniche in fase vapore a letto fisso o a letto fluido, con i catalizzatori più efficaci che sono rame o palladio supportati su carbone attivo o un substrato ossidico, in combinazione con modificatori o promotori come Pb, V, P o Cr per migliorare l’attività e la selettività.
Nel processo Lonza, gestito da First Chemical Corp., una miscela omogeneizzata di idrogeno e nitrobenzene viene fatta passare su un catalizzatore a letto fisso di rame su pomice.
Il nitrobenzene viene spruzzato in un flusso di gas circolante riscaldato di idrogeno fresco in una posizione fissa per garantire l’omogeneizzazione.
Il rapporto molare tra alimentazione di nitrobenzene e idrogeno totale è di circa 1:100 all’ingresso del reattore e i prodotti di reazione escono dal reattore con una temperatura superiore a 300 °C. Il calore generato dall’idrogenazione viene utilizzato per la produzione di vapore e per riscaldare il flusso di gas di riciclo.
L’idrogeno in eccesso, l’anilina grezza e l’acqua vengono separati raffreddando l’uscita del reattore in un condensatore e l’anilina viene purificata tramite distillazione.
Bayer utilizza reattori a letto fisso convenzionali che impiegano un catalizzatore al palladio su un supporto di allumina modificato dall’aggiunta di vanadio e piombo.
Il processo rivendica l’idrogenazione adiabatica del nitrobenzene su un catalizzatore a letto fisso di 1,5-4% in peso di palladio su coke con 0,1-2% in peso di piombo come modificatore.
La miscela di nitrobenzene vaporizzato e idrogeno in un rapporto molare da 1:120 a 1:200 viene immessa nel reattore adiabatico a una pressione di 100 – 700 kPa e una temperatura di ingresso di 250 – 350 °C.
Il letto del catalizzatore nel reattore è alto da 0,1 a 1,0 m e i prodotti di reazione escono dal reattore senza raffreddamento a una temperatura massima di 460 °C.
Dopo il raffreddamento, l’anilina grezza, le acque reflue grezze e l’idrogeno riciclato vengono separati sotto pressione. L’anilina grezza viene purificata tramite distillazione.
BASF impiega un processo a letto fluidizzato in fase di vapore, in cui il nitrobenzene viene parzialmente evaporato tramite atomizzazione con un flusso di gas caldo composto principalmente da idrogeno.
Il flusso di gas viene fatto circolare in presenza di un catalizzatore fluidizzato e i prodotti di reazione vengono condensati e l’anilina viene separata dai prodotti di reazione grezzi. Il rame supportato su silice con promotori di cromo, zinco e bario è un catalizzatore preferito.
La miscela bifase di nitrobenzene e idrogeno viene iniettata attraverso ugelli a varie altezze nel letto fluidizzato e l’idrogenazione avviene in presenza di idrogeno in eccesso a 250-300 °C e 400-1000 kPa. Il calore di reazione viene utilizzato per la produzione di vapore e il gas prodotto caldo viene raffreddato in uno scambiatore di calore.
Dopo la rigenerazione del catalizzatore, il materiale organico depositato sulla superficie del catalizzatore viene bruciato a 200-250 °C con aria e il catalizzatore viene nuovamente attivato riducendo l’ossido di rame a rame con idrogeno a 200-300 °C.
3.1.2. Idrogenazione catalitica in fase liquida
I processi di idrogenazione per l’anilina impiegati da ICI e DuPont vengono condotti in fase liquida. Questi processi sono in genere eseguiti a temperature comprese tra 90 e 200 °C e pressioni comprese tra 100 e 600 kPa.
La reazione in fase liquida può essere eseguita utilizzando reattori a poltiglia o a letto fluido. La conversione del nitrobenzene in anilina è in genere completa dopo un singolo passaggio del reattore con rese dal 98 al 99%.
Negli anni ’60, ICI ha sviluppato un processo di idrogenazione continua che utilizzava l’anilina come solvente, comprendente oltre il 95% in peso della fase liquida.
Il processo funziona vicino o al punto di ebollizione del solvente (solitamente a pressioni inferiori a 100 kPa), consentendo alla miscela di reazione di evaporare e dissipare parte o tutto il calore della reazione.
L’acqua viene rimossa insieme ai vapori effluenti, mentre una quantità sufficiente di anilina viene restituita al reattore per mantenere condizioni di stato stazionario. Il processo utilizza nichel finemente suddiviso su kieselguhr come catalizzatore preferito.
DuPont, d’altro canto, impiega un processo di idrogenazione in fase liquida per il nitrobenzene utilizzando un catalizzatore al platino-palladio su un supporto di carbonio con ferro come modificatore.
Il modificatore fornisce una buona durata del catalizzatore, elevata attività e protezione contro l’idrogenazione dell’anello aromatico. Il processo impiega un reattore a flusso a pistone che raggiunge rese quasi quantitative, con il prodotto che esce dal reattore praticamente privo di nitrobenzene.
Il confronto tra l’idrogenazione catalitica in fase liquida e in fase di vapore del nitrobenzene non rivela differenze significative nella resa e nella qualità del prodotto per entrambi i processi.
Il processo in fase liquida, tuttavia, ha una resa spazio-temporale più elevata e non richiede un ciclo di gas di riciclo, con conseguenti minori requisiti energetici.
Al contrario, il processo in fase vapore utilizza efficacemente il calore di reazione, producendo vapore senza la necessità di separazione prodotto-catalizzatore e con conseguente maggiore durata del catalizzatore.
3.2. Produzione di anilina mediante riduzione di nitrobenzene con ferro e sali di ferro
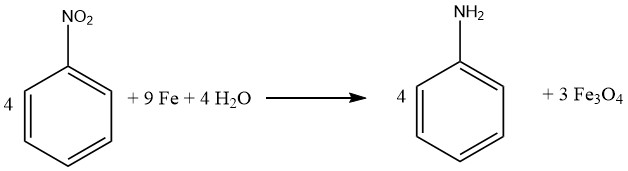
Il processo Bechamp è un metodo storico per ridurre il nitrobenzene, che impiega ferro e cloruro di ferro (II). Nonostante abbia più di un secolo, il processo è ancora utilizzato in due impianti di anilina Bayer per produrre pigmenti di ossido di ferro colorati come sottoprodotti.
Per eseguire il processo Bechamp, il nitrobenzene viene ridotto in un recipiente di reazione agitato con una soluzione di cloruro di ferro (II) e riempitivi di ferro macinato.
Il reattore viene riempito con acqua, inclusa acqua di anilina dalla distillazione dell’anilina, nonché il 20% di ferro, la quantità richiesta di catalizzatore e circa il 5-10% dell’alimentazione totale di nitrobenzene.
La miscela di reazione viene riscaldata a riflusso con agitazione intensa e, dopo l’inizio della riduzione, il nitrobenzene e il ferro rimanenti vengono aggiunti lentamente per evitare un accumulo eccessivo di temperatura e pressione.
La reazione viene completata in circa 8-10 ore riscaldando il recipiente a 100 °C per altre due ore dopo l’aggiunta di ferro/nitrobenzene. Dopo la neutralizzazione con calce, la miscela di reazione viene trasferita a un separatore e la fase organica contenente anilina viene estratta.
L’anilina viene quindi recuperata dalla fase organica tramite strippaggio con acqua e distillazione. Qualsiasi anilina rimanente viene recuperata dal materiale rimasto nel separatore prima che la sospensione di polvere di ossido di ferro venga trasformata in un pigmento colorato in particelle fini.
Il colore del sottoprodotto di ossido di ferro può essere manipolato alterando il mezzo di reazione con additivi, utilizzando diversi tipi di ferro e controllando le condizioni di calcinazione.
3.3. Produzione di anilina mediante aminazione di fenolo

Halcon ha sviluppato un percorso commerciale per il fenolo in cui il fenolo è sottoposto ad aminazione in fase di vapore utilizzando ammoniaca insieme a un catalizzatore di silice-allumina.
A causa della natura esotermica e reversibile della reazione (ΔH = -8,4 kJ/mol), è possibile ottenere alti tassi di conversione solo utilizzando ammoniaca in eccesso (rapporto molare di 20:1) e basse temperature di reazione per ridurre la dissociazione dell’ammoniaca.
Difenilammina, trifenilammina e carbazolo sono impurità prodotte come sottoprodotti. L’uso di ammoniaca in eccesso inibisce anche la formazione di queste impurità. La resa basata su fenolo e ammoniaca è rispettivamente ≥ 96% e 80%.
Il processo include la vaporizzazione separata di fenolo e ammoniaca fresca e riciclata per evitare perdite di resa. Vengono quindi combinati nel reattore di aminazione contenente il catalizzatore silice-allumina.
Dopo la reazione, il gas viene raffreddato e parzialmente condensato e l’ammoniaca in eccesso viene recuperata in una colonna di separazione, compressa e riciclata.
Il prodotto di condensazione passa attraverso una colonna di essiccazione per rimuovere l’acqua e poi attraverso una colonna di finitura sotto vuoto (meno di 80 kPa) per separare l’anilina dal fenolo residuo e dalle impurità. Il fenolo contenente un po’ di anilina (miscela azeotropica) viene riciclato.
Rispetto al percorso del nitrobenzene che parte dal benzene, il percorso del fenolo prevede quattro passaggi (cumene in fenolo tramite l’idroperossido di cumene intermedio), mentre il percorso del nitrobenzene prevede solo due passaggi.
Il percorso del nitrobenzene ha un vantaggio complessivo in termini di resa e minori requisiti energetici totali, mentre il percorso del fenolo ha un vantaggio in termini di durata prolungata del catalizzatore e qualità del prodotto.
La via del fenolo è preferita se è disponibile fenolo a basso costo dai produttori di fenolo.
4. Utilizzi dell’anilina
L’anilina è utilizzata in oltre 300 diversi prodotti finali, il più importante dei quali è il blocco di costruzione del poliuretano 4,4-metilen-di-parafenilene isocianato (MDI).
4.1 Metilene difenilene isocianato (MDI)
L’MDI è un isocianato cruciale che viene combinato con alcoli, come polioli e polieteroli, per formare poliuretani (PU). I sistemi PU basati su MDI sono ampiamente utilizzati nei settori dell’edilizia, dell’arredamento, dell’automotive e dell’isolamento.
Si prevede che queste applicazioni, così come nuovi campi di applicazione, alimenteranno una forte crescita per MDI-PU, in particolare nei mercati emergenti.
Un tipico processo commerciale MDI prevede la preparazione di una miscela di metilenfenilammine polimeriche mediante condensazione dell’anilina con formaldeide in presenza di HCl.
La reazione determina la formazione intermedia di cloridrati di ammina, che vengono neutralizzati con soda caustica. La reazione avviene solitamente a pressione subatmosferica e temperature comprese tra 70 e 105 °C, con un eccesso di anilina. La resa è di circa il 96%.
Il prodotto poliamminico viene quindi fatto reagire con fosgene in un solvente per produrre una miscela grezza di isocianati. La temperatura di reazione è di circa 120 °C e la pressione è di 345 kPa, con una resa di circa il 97%.
Il clorobenzene viene rimosso per distillazione e il grezzo viene separato per distillazione sotto vuoto in MDI puro e MDI polimerico, con la produzione di acido cloridrico come sottoprodotto della reazione.
4.2 Prodotti chimici per la lavorazione della gomma
Nel primo decennio di questo secolo, l’anilina pura è stata utilizzata come acceleratore di vulcanizzazione. La richiesta di maggiore efficacia e di una manipolazione più sicura ha portato allo sviluppo di acceleratori di mercaptotiazolo e ammide solfenica a base di anilina, che attualmente rappresentano circa l’80% di tutti gli acceleratori di vulcanizzazione utilizzati nel mondo.
La maggiore importanza dell’anilina nel settore dei prodotti chimici per la lavorazione della gomma risiede negli antidegradanti come parafenilendiammine (PPD), chinoline e difenilammina.
L’anilina è la materia prima per circa il 70% di tutti gli antidegradanti consumati a livello globale. Si prevede che la domanda futura di anilina nell’industria della gomma crescerà del 2-3% all’anno, in linea con la crescita globale della domanda di gomma sintetica e naturale.
4.3 Coloranti e pigmenti
L’anilina funge da materia prima per intermedi per coloranti e pigmenti, che costituiscono oltre il 50% di tutte le formulazioni note. Tuttavia, la maggior parte di queste formulazioni ha un’importanza minore. Le classi più grandi sono i composti mono-, di- e triazo.
La produzione di coloranti e pigmenti si è spostata verso i paesi asiatici, come Cina e India. Tuttavia, alcuni impianti di coloranti e pigmenti su scala mondiale in Europa e NAFTA (Stati Uniti, Canada, Messico) utilizzano ancora l’anilina, ad esempio per la produzione di indaco.
Da quando BASF ha realizzato industrialmente le sintesi chimiche dell’indaco alla fine del XIX secolo, l’indaco è diventato il colorante più critico basato sull’anilina.
Si prevede che la crescita mondiale per questa applicazione rimarrà bassa, a un tasso dell’1-2% all’anno.
4.4 Prodotti chimici agricoli
Oltre 40 principi attivi per pesticidi (erbicidi, fungicidi e insetticidi) utilizzano l’anilina come materia prima. In particolare, erbicidi ammidici e ureici. Le aziende situate nel NAFTA rappresentano oltre il 50% del consumo mondiale di anilina per prodotti chimici agricoli.
I principi attivi a base di anilina sono principalmente nelle fasi avanzate del loro ciclo di vita e stanno per essere sostituiti. Si prevede che il consumo globale diminuirà dell’1-2% all’anno.
4.5 Prodotti farmaceutici
L’anilina è una fonte stabile, seppur minore, per la preparazione di analgesici, antipiretici, antiallergici e vitamine. Sebbene si preveda che la produzione di anilina aumenterà nei prossimi cinque anni per i prodotti farmaceutici, ci sarà una corrispondente diminuzione del suo utilizzo per la produzione di vitamine a causa della crescente popolarità della tecnologia di fermentazione.
4.6 Cicloesilammina/Dicicloesilammina
Durante gli anni ’90, l’anilina è diventata la materia prima preferita per la produzione di cicloesilammina e dicicloesilammina. Queste ammine sono utilizzate principalmente come intermedi per acceleratori di vulcanizzazione sulfenammidica. La cicloesilammina è anche utilizzata in grandi quantità come inibitore della corrosione e materia prima per i ciclamati.
Si prevede che l’uso di queste ammine negli acceleratori e nel trattamento delle acque aumenterà di circa il 3-4% all’anno, mentre la domanda di cicloesilammina per la produzione di ciclamati ha subito notevoli fluttuazioni ed è difficile da prevedere. Se la FDA revocasse il divieto sui ciclamati come dolcificanti artificiali negli Stati Uniti, ci si potrebbe aspettare un aumento della domanda.
4.7 Varie
Tra una varietà di altri usi (come la produzione di alchilanilina, sbiancanti ottici, acidi solfonici, ecc.), vale la pena menzionare il consumo di anilina per la sintesi di fibre aramidiche.
Le aramidi sono versatili e possono essere utilizzate come sostituti dell’acciaio, con proprietà di rinforzo equivalenti a un peso significativamente inferiore. Le aramidi hanno tassi di crescita sani grazie alla loro applicazione in vari settori, come la sostituzione dell’amianto nelle guarnizioni dei freni.
Riferimento
- Anilina; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_303.pub2
