Triéthylamine : propriétés, production et utilisations
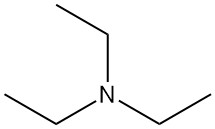
La triéthylamine (TEA) est une amine tertiaire, représentée par la formule chimique N(CH2CH3)3. C’est un liquide incolore facilement inflammable avec une odeur semblable à celle de l’ammoniaque. C’est l’une des bases aminés organiques les plus utilisées en chimie organique.
Table des matières
1. Propriétés physiques de la triéthylamine
La triéthylamine est un liquide incolore, à l’odeur désagréable et inflammable. Les propriétés physiques importantes sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro de registre CAS | [121-44-8] |
| Formule chimique | (C2H5)3N |
| Couleur | Incolore |
| État physique | Liquide |
| Poids moléculaire (M.) | 101.19 |
| Point de fusion (mp), °C | -115 |
| Point d'ébullition (point d'ébullition), °C | 89,3 |
| Densité (d) à 20 °C | 0,7275 |
| Indice de réfraction (n) à 20 °C | 1.4010 |
| Point d'éclair, °C | -11 |
| pKo (25 °C) | 3.24 |
| Constante de dissociation (pKa) | 10.76 |
| Seuil d'odeur, ppm ; v/v | 0,48 |
| Solubilité dans l'eau | Miscible à l'eau (112 g/L à 20 °C) |
| Solubilité dans les solvants organiques | Miscible dans l'éthanol et l'éther éthylique |
| Densité de pression de vapeur | 3.48 |
| Pression de vapeur à 20 °C, torr | 54 |
| Inflammabilité automatique (°C) | 215 |
2. Réactions chimiques de la triéthylamine
La triéthylamine présente des risques élevés d’incendie et de sécurité lorsqu’elle est exposée à la chaleur, aux flammes ou à des comburants, et elle devient explosive sous forme de vapeur.
La triéthylamine non diluée complexée au tétraoxyde de diazote peut se décomposer de manière explosive en dessous de 0°C.
La triéthylamine réagit de manière exothermique avec l’anhydride maléique au-dessus de 150°C, générant de la chaleur et présentant potentiellement des risques d’incendie. Lors de sa décomposition due à la chaleur, il émet des fumées toxiques d’oxyde d’azote (NOx).
Les principales réactions de la triéthylamine sont :
1. Formation de sels avec les acides
En raison de ses substituants alkyles, la triéthylamine est une base plus forte que l’ammoniac, formant des sels hautement solubles dans l’eau avec les acides organiques et inorganiques. La différence de solubilité entre la triéthylamine et son sel en fait un bon accepteur d’acide et un bon solvant pour l’épuration des gaz et pour certains processus d’extraction comme la production de pénicilline semi-synthétique.
En outre, il agit comme un puissant accepteur de protons dans diverses réactions, notamment les oxydations, les réductions, les éliminations, les substitutions et les additions. Les sels quaternaires résultants sont facilement éliminés une fois terminés.
2. Alkylation
La réaction de la triéthylamine avec des halogénures d’alkyle et des sulfates de dialkyle pour donner finalement des composés d’ammonium quaternaire est utilisée en chimie pharmaceutique préparative et pour la préparation d’agents anticorrosion et de biocides.
3. Oxydation
La triéthylamine est oxydée par le peroxyde d’hydrogène en oxyde de triéthylamine.

3. Production de triéthylamine
La triéthylamine est produite en faisant réagir l’ammoniac avec de l’éthanol, le N,N-diéthylacétamide avec de l’hydrure de lithium et d’aluminium, le chlorure d’éthyle avec de l’ammoniac sous chaleur et pression. et hydrogénation catalytique en phase gazeuse de l’acétonitrile.
1. Ammoniac et éthanol

La méthode la plus courante consiste à faire réagir de l’ammoniac (NH3) avec de l’éthanol (CH3CH2OH) à des températures et des pressions élevées sur un catalyseur de déshydratation ou de déshydrogénation. Des catalyseurs comme l’alumine, la silice-alumine ou l’argent favorisent efficacement la réaction, produisant un mélange d’éthylamine, de diéthylamine et de triéthylamine.
Les séparations ultérieures par extractions et distillations isolent la triéthylamine avec une grande pureté. Cette méthode offre des rendements élevés mais nécessite une manipulation prudente des intermédiaires volatils et des conditions de réaction énergivores.
Des mélanges de mono-, di- et triéthylamine peuvent également être synthétisés à partir de acétaldéhyde, ammoniac et hydrogène en présence d’un catalyseur d’hydrogénation.

a) Vaporisateur ; b) Échangeur de chaleur ; c) Surchauffeur ; d) Convertisseur catalytique ; e) Refroidisseur de produits ; f) Séparateur de gaz ; g) Colonne d'ammoniac ; h) Colonne de monoéthylamine ; i) Colonne de diéthylamine ; j) Carafe ; k) Colonne de triéthylamine
2. N,N-Diéthylacétamide et Hydrure de Lithium-Aluminium

Une voie spécialisée utilise le N,N-diéthylacétamide (CH3CH2CON(CH 2CH3)2) comme substrat. La réduction avec l’hydrure de lithium et d’aluminium (LiAlH4) génère directement de la triéthylamine. Cette méthode évite le mélange complexe de produits aminés mais nécessite des réactifs spécialisés et des protocoles de sécurité spécifiques en raison de la nature pyrophorique de LiAlH4.
3. Chlorure d’éthyle et ammoniac

À haute température et pression, le chlorure d’éthyle (CH3CH2Cl) peut réagir avec l’ammoniac pour former de la triéthylamine. Cependant, ce processus nécessite généralement des étapes de purification supplémentaires pour éliminer les sous-produits (HCl) et les réactifs résiduels.
4. Hydrogénation catalytique en phase gazeuse de l’acétonitrile

La triéthylamine peut être produite en continu par hydrogénation de l’acétonitrile en phase gazeuse, en utilisant un métal noble du groupe VIII du système périodique (par exemple, platine, palladium) comme catalyseur.
Un support spinelle au lithium-aluminium est utilisé pour améliorer les performances du catalyseur. Cette réaction est opérée à une température de 80°C à 115°C et une pression de 1 à 60 bars (pression relative).
Jusqu’à 3 % en poids de monoéthylamine et/ou de diéthylamine sont ajoutés par rapport à l’acétonitrile. Ceux-ci agissent comme promoteurs, améliorant potentiellement la vitesse de réaction ou la sélectivité.
4. Utilisations de la triéthylamine
L’utilisation prédominante de la triéthylamine (TEA) est comme catalyseur dans le durcissement des systèmes de résine dans les moules de fonderie, en particulier dans la production de noyaux de sable pour les processus de boîte froide ou d’isocure. Le thé est vaporisé sous forme de gaz et introduit dans le système.
Outre son rôle dans les applications de fonderie, le TEA est largement utilisé comme catalyseur de durcissement dans les adhésifs pour panneaux de particules phénol-formaldéhyde, avec une consommation annuelle d’environ 5 millions de livres aux États-Unis.
De plus, il est utilisé dans la purification des antibiotiques pénicilline et céphalosporine et dans le processus de polymérisation interfaciale pour la production de résines polycarbonate.
La triéthylamine est également utilisée comme éliminateur de HCl dans des réactions, par exemple lors de la fabrication de phtalates de benzyle, en mettant l’accent sur la récupération et le recyclage.
La TEA sert d’ingrédient dans la peinture d’étanchéité (0,5 % p/p), dans la fabrication d’adhésifs pour papier et carton et comme stabilisant pour les solvants chlorés comme le perchloroéthylène et le trichloréthylène.
Il agit comme catalyseur dans la formation de mousses d’uréthane et de résines époxy et participe aux réactions de déshydrohalogénation et de neutralisation acide pour les réactions de condensation. La TEA trouve également une application dans la chromatographie liquide haute performance (HPLC) en phase inverse en tant que modificateur de phase mobile.
Dans des industries spécifiques, le TEA est utilisé comme agent de neutralisation pour les résines aqueuses stabilisées anioniques, notamment les polyesters, les alkydes, les résines acryliques et les polyuréthanes contenant des groupes carboxyle ou autres groupes acides.
D’autres utilisations de la triéthylamine comprennent son utilisation comme activateur accélérateur pour le caoutchouc, comme inhibiteur de corrosion, comme propulseur, comme agent émulsifiant pour les colorants, comme ingrédient dans les accélérateurs de développement photographique, pour sécher les encres d’imprimerie, dans les nettoyants pour tapis, dans la production d’herbicides et de pesticides, et dans la préparation d’émulsifiants pour pesticides.
5. Toxicologie de la triéthylamine
1. Toxicité aiguë
- Inhalation : des volontaires humains exposés aux vapeurs de triéthylamine ont ressenti des troubles visuels et des modifications de l’activité cérébrale. L’exposition professionnelle a également été associée à des problèmes oculaires et respiratoires. Les études animales révèlent une toxicité et une mortalité sévères suite à l’inhalation de doses élevées, avec des valeurs DL50 allant de 420 à 10 000 mg/m³ chez le rat.
- Ingestion : L’exposition orale chez les animaux a entraîné une toxicité dose-dépendante, avec des valeurs DL50 allant de 450 à 1 000 mg/kg chez les rongeurs. Chez l’homme, la triéthylamine ingérée est principalement excrétée sous forme inchangée, avec une petite partie métabolisée en oxyde de triéthylamine et en diéthylamine.
- Voie cutanée : La triéthylamine présente une irritation cutanée importante chez les animaux, avec des valeurs DL50 d’environ 0,5 à 0,794 mL/kg chez le lapin.
2. Toxicité chronique
- Inhalation : une exposition à long terme (mois) à des concentrations modérées de triéthylamine chez des rats a provoqué des altérations des poumons, du cerveau et du foie. Des modifications du système nerveux, une anémie et une inflammation pulmonaire chronique ont été observées à des niveaux d’exposition plus élevés.
- Orale : aucun effet indésirable n’a été signalé chez les rats ayant reçu de la triéthylamine par voie orale pendant 2 mois à une dose modérée. Cependant, des doses plus élevées ont entraîné des changements de comportement et des convulsions, les femelles étant plus sensibles.
- Génotoxicité : des études in vitro et in vivo ont donné des résultats contradictoires concernant la génotoxicité de la triéthylamine. Alors que certains tests suggèrent un potentiel mutagène chez les bactéries, d’autres n’ont montré aucun effet clastogène ou aneugène chez le rat.
3. Reproduction et développement
- Études sur la reproduction : une étude multigénérationnelle sur des rats n’a révélé aucun impact significatif sur la fertilité ou la viabilité de la progéniture, bien qu’une légère réduction du poids corporel moyen ait été observée à la troisième génération.
- Toxicité pour le développement : l’administration de triéthylamine à des lapines gravides a perturbé le développement embryonnaire précoce.
4. Épidémiologie humaine
- Cancer : une étude menée dans une fonderie danoise a établi un lien entre l’exposition professionnelle à la triéthylamine et un risque accru de mortalité par cancer de la vessie.
- Sensibilisation : des études animales suggèrent un faible potentiel de sensibilisation cutanée ou respiratoire à la triéthylamine.
5. Autres observations
- La triéthylamine inhibe l’activité de la monoamine oxydase (MAO) et de la sulfotransférase dans les tissus animaux, ce qui a potentiellement un impact sur le métabolisme des neurotransmetteurs et des stéroïdes.
- Des études in vitro suggèrent que la triéthylamine interagit avec la dégradation et la synthèse des protéines cellulaires et peut induire un gonflement lysosomal.
Références
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
- Process for the preparation of triethylamine. – https://patents.google.com/patent/US4297512A/en
- Triethylamine; Review of Toxicological Literature
- Triethylamine. – https://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb12144e0013
- Triethylamine anhydrous(BASF). – https://products.basf.com/global/en/ci/triethylamine-anhydrous.html
