Réactions chimiques des amines aliphatiques
Les amines aliphatiques, caractérisées par la présence d’un groupe fonctionnel aminé attaché à une chaîne carbonée, présentent diverses réactions chimiques en raison de la paire d’électrons libres sur l’atome d’azote et de la tendance des atomes d’hydrogène liés à l’azote à être substitués par d’autres groupes.
Table des matières
1. Formation de sels d’amine
Un aspect important des amines aliphatiques est leur capacité à former des sels lorsqu’elles réagissent avec des acides. En raison des substituants alkyle qu’elles portent, les amines aliphatiques sont des bases plus fortes que l’ammoniac. Par conséquent, ils réagissent facilement avec des acides pour former des sels solubles dans l’eau qui sont insolubles dans les solvants organiques.

Cette propriété fait des amines d’excellents accepteurs d’acide et des solvants utiles dans les processus de lavage et d’extraction des gaz (par exemple, dans la synthèse de pénicillines semi-synthétiques).
Notamment, les amines tertiaires telles que la triméthylamine, la tributylamine et l’éthyldiisopropylamine sont largement utilisées comme accepteurs de protons et catalyseurs dans la synthèse organique car elles peuvent être éliminées du mélange organique après réaction.
2. Conversion en carboxamides
La réaction entre les amines et les acides carboxyliques, ainsi que leurs esters, chlorures et anhydrides, conduit à la production de carboxamides substitués :

Cette transformation conduit généralement à des rendements élevés, en particulier lors de l’emploi de chlorures d’acides carboxyliques, qui est une réaction fortement exothermique. Lors de la réaction avec des acides carboxyliques, la réaction s’arrête souvent à la formation du sel d’ammonium initial.
Ce type de réaction trouve une application industrielle importante, comme dans la synthèse de divers herbicides possédant une structure amide d’acide.
Lorsqu’une alkylamine réagit avec une lactone par ce processus, un lactame est généré. Un exemple notable de cette réaction est la formation de 1-éthyl-2-pyrrolidone à partir de la combinaison d’éthylamine et de γ-butyrolactone.
3. Conversion des amines en sulfonamides
La réaction des amines aliphatiques avec le chlorure de benzènesulfonyle est utilisée pour distinguer les amines primaires, secondaires et tertiaires, communément appelée test de Hinsberg. De plus, cette réaction peut être utilisée pour la séparation préparative de ces types d’amines.
Dans ce test, les amines primaires donnent des N-alkylbenzènesulfonamides solubles dans les alcalis, tandis que les amines secondaires produisent des N,N-dialkylbenzènesulfonamides insolubles dans les alcalis. Les amines tertiaires, en revanche, ne présentent aucune réactivité dans ces conditions particulières.
Il convient de noter que des limitations peuvent survenir avec les amines primaires à longue chaîne, car elles peuvent rester insolubles dans les alcalis malgré la présence d’hydrogène acide. Les amines tertiaires peuvent également subir une quaternisation avec du chlorure de sulfonyle, entraînant des résultats de réaction altérés.

Les sulfamides ont autrefois joué un rôle vital en tant que produits pharmaceutiques dans le traitement des infections bactériennes, sauvant d’innombrables vies pendant la Seconde Guerre mondiale. Cependant, ils ont depuis été remplacés par des alternatives plus sûres telles que la pénicilline et d’autres antibiotiques.
4. Réaction des amines avec des composés carbonylés
Dans des conditions de réaction spécifiques et avec des composés appropriés, les composés carbonylés peuvent subir des réactions avec des amines, conduisant à la formation d’imines (bases de Schiff) (2) ou d’énamines (3). Ces produits peuvent en outre subir une hydrogénation pour donner des amines plus alkylées. Cette réaction est important en tant que méthode de synthèse d’amines supérieures.
Il est à noter que les hémiaminals intermédiaires (1) formés au cours de la réaction ne sont généralement pas isolables. Les aldéhydes réagissent généralement plus rapidement que les cétones. Les amines secondaires forment exclusivement des énamines, tandis que les amines tertiaires ne donnent aucun des deux produits.

La réaction impliquant une amine, un aldéhyde et un composé possédant un atome d’hydrogène activé, tel qu’une cétone, conduit à la formation d’une base de Mannich.
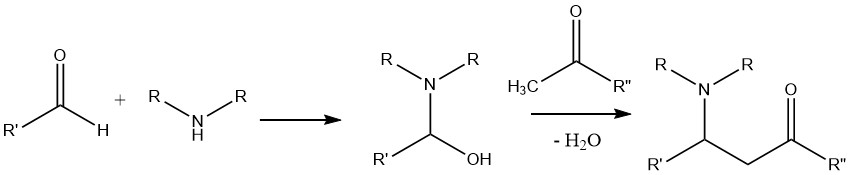
Dans cette réaction, le produit de condensation formé entre l’aldéhyde et l’amine est attaqué par le α-C-H acidique, qui provient de la cétone.
5. Réaction des amines avec le dioxyde de carbone et le disulfure de carbone
L’acide carbamique ou l’acide dithiocarbamique généré lors de cette réaction présente une instabilité, mais il peut être isolé sous forme de sel ou d’ester.

Les dithiocarbamates dérivés de diverses amines ont une importance significative en tant qu’accélérateurs de vulcanisation dans l’industrie du caoutchouc.
6. Réaction des amines avec les époxydes
Lorsque les amines primaires subissent une réaction avec des époxydes, un mélange de dérivés mono- et dioxyalkylés se forme. D’autre part, les amines secondaires donnent exclusivement des composés monooxyalkylés, tandis que les amines tertiaires donnent des composés d’ammonium quaternaire.
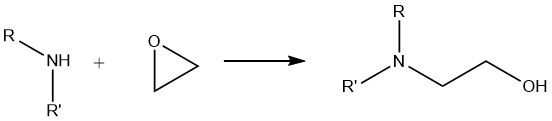
Cette réaction d’alcoxylation est très importante dans l’application industrielle des amines aliphatiques. EIle est largement utilisé dans la synthèse de floculants, de résines de revêtement de surface, d’intermédiaires pharmaceutiques et de produits utilisés dans les procédés d’épuration des gaz tels que l’éthanolamine et la propanolamine.
7. Alkylation des amines
La réaction des amines avec des halogénures d’alkyle et des sulfates de dialkyle conduit finalement à la formation de composés d’ammonium quaternaire, qui trouvent une application étendue dans la chimie pharmaceutique préparative ainsi que dans la synthèse d’agents anticorrosion et de biocides.
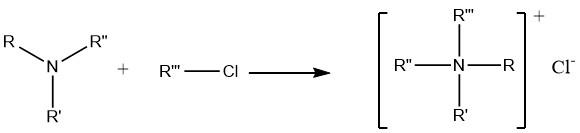
Cependant, la réaction entre les halogénures d’alkyle et l’ammoniac n’est pas particulièrement utile pour la préparation d’amines primaires ou secondaires. Cela est dû à la basicité plus forte des amines primaires et secondaires ils attaquent préférentiellement les halogénures plutôt que de subir des réactions de substitution.
Cependant, les amines tertiaires peuvent toujours être préparées par ces réactions. Dans les synthèses à l’échelle du laboratoire, les amines primaires peuvent être obtenues à l’aide d’hexaméthylènetétramine, tandis que les amines secondaires peuvent être synthétisées à l’aide de cyanamide.
8. Formation d’isocyanates et d’urées
La réaction entre le phosgène et les amines primaires donne initialement le chlorure de carbonyle correspondant. Le clivage ultérieur du chlorure d’hydrogène conduit à la formation d’isocyanate d’alkyle. L’amine en excès réagit alors avec l’isocyanate, entraînant la formation d’urées.
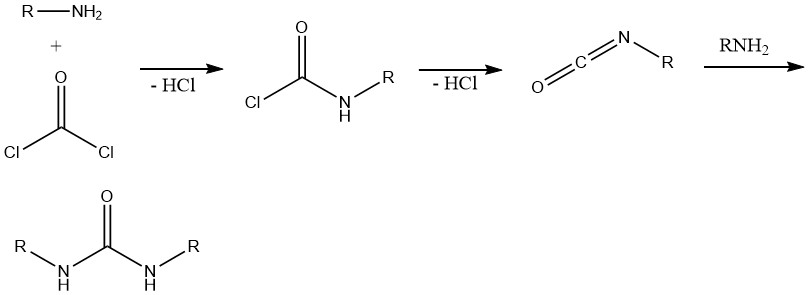
Cette réaction est importante dans la synthèse de divers herbicides contenant des structures urée, carbamate ou thiocarbamate et dans les systèmes d’amines polyfonctionnelles, principalement la chimie des polyuréthanes.
De même, les amines secondaires réagissent avec le phosgène via un chlorure intermédiaire analogue, conduisant à la formation de N,N’-tétraalkylurées.
9. Réaction des amines avec l’acrylonitrile
L’addition à l’échelle industrielle d’une amine primaire ou secondaire à l’acrylonitrile, connue sous le nom d’addition 1,2-Michael, est largement utilisée pour la synthèse de diamines et polyamines supérieures. Cette réaction est favorisée car la fonction nitrile peut être facilement hydrogénée en amine correspondante.

10. Formation d’Isonitriles
Dans des conditions basiques, les amines primaires subissent une réaction avec le trichlorométhane pour produire des isonitriles.
L’odeur forte et désagréable des isonitriles permet d’utiliser cette réaction comme test de la présence d’amines primaires. De plus, pour les amines inférieures, cette réaction peut également être utilisée comme méthode de synthèse.
Une approche alternative implique l’utilisation de N-alkylformamides comme matières premières pour la synthèse d’isonitriles.
11. Oxydation des amines
Les amines libres sont sensibles à l’oxydation, contrairement à leurs sels, entraînant la formation de produits divers selon l’agent oxydant et le type d’amine en cause.
Les amines tertiaires, lorsqu’elles sont oxydées avec du peroxyde d’hydrogène, forment des oxydes d’amine. D’autre part, les amines primaires et secondaires, lors de l’oxydation, donnent des hydroxylamines ou des aldoximes correspondantes par réactions ultérieures avec les composés formés.

L’utilisation d’acide nitreux pour l’oxydation sert de moyen de différencier les amines primaires, secondaires et tertiaires. Les amines primaires subissent une diazotation, suivie par élimination de l’azote gazeux, et finissent par former des alcools par la réaction de l’ion carbénium intermédiaire avec l’eau.
Les amines secondaires réagissent pour produire des N-nitrosoamines jaunes. Typiquement, les amines tertiaires ne présentent pas de réactivité dans ces conditions.
La formation de nitrosamines peut être une préoccupation importante, en particulier avec les amines secondaires, car elles sont hautement mutagènes. Bien qu’ils ne se forment généralement pas lors d’une utilisation normale, des traces peuvent se former au contact de nitrites ou d’oxydes nitreux, entraînant des problèmes de manipulation. La contamination de l’air due aux amines secondaires est donc considérée comme problématique.
12. Désalkylation des amines
Après avoir converti les amines tertiaires en sels basiques d’ammonium quaternaire, elles subissent une désalkylation lors du chauffage. Dans les cas où seuls des groupes méthyle sont présents, ils sont éliminés sous forme de méthanol ou d’éther diméthylique. Cependant, lorsque des groupes alkyle supérieurs sont présents, ils donnent des alcènes, comme illustré dans la réaction :

Cette réaction, appelée dégradation d’Hofmann, n’est pas fréquemment utilisée dans des applications synthétiques. Cependant, elle a joué un rôle important dans le passé en élucidant les caractéristiques structurelles d’amines inconnues.
Références
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
