Processus de production d’acétaldéhyde
Les matières premières suivantes ont été utilisées pour la production d’acétaldéhyde : éthanol obtenu par la fermentation d’hydrates de carbone ou l’hydratation d’éthylène, d’acétylène, d’éthylène, d’hydrocarbures inférieurs, de monoxyde de carbone, d’hydrogène et de méthanol.
La viabilité économique des procédés commerciaux dépend de la disponibilité et des prix des matières premières. Dans les pays hautement industrialisés, où le maintien des prix élevés de l’éthanol par des mesures fiscales était difficile ou où l’éthanol pétrochimique n’était pas disponible (comme c’était le cas en Allemagne ou au Japon avant 1939), l’acétylène est devenu la matière première préférée pour l’acétaldéhyde.
Le procédé à l’acétylène continue d’être utilisé dans certains pays d’Europe de l’Est et par des entreprises qui ont accès à de l’acétylène bon marché. Cependant, dans d’autres pays, l’éthanol produit par voie pétrochimique est devenu la matière première privilégiée, tandis que l’éthanol issu de la fermentation était et est toujours utilisé dans une moindre mesure dans les pays ayant une industrie chimique moins importante.
Dans les pays occidentaux, dont le Japon, ces procédés ont été largement remplacés par le procédé d’oxydation directe développé à la fin des années 1950 par Wacker-Chemie et Hoechst. Ce changement s’est produit parce que l’éthylène est disponible à un coût inférieur à celui de l’acétylène.
Même les procédés en deux étapes qui utilisent de l’éthanol dérivé de l’éthylène comme matériau de départ ne sont plus compétitifs en raison de l’importance décroissante de l’acétaldéhyde en tant qu’intermédiaire organique.
En général, les procédés basés sur l’acétylène, l’éthylène et l’éthanol ont une sélectivité plus élevée par rapport à l’oxydation des hydrocarbures saturés. En effet, dans ce dernier cas, des produits d’oxydation supplémentaires se forment à côté de l’acétaldéhyde.
Cependant, ces procédés ne sont économiquement viables que dans des opérations à grande échelle où tous les produits primaires et secondaires obtenus au cours du procédé sont utilisés, car la séparation du mélange de produits peut être coûteuse.
Table des matières
1. Production d’acétaldéhyde à partir d’éthanol
Pour produire de l’acétaldéhyde, il existe deux méthodes impliquant l’éthanol : la déshydrogénation et l’oxydation en présence d’oxygène. Entre 1918 et 1939, la déshydrogénation a été favorisée en raison de la production simultanée d’hydrogène.
Cependant, plus tard, l’oxydation catalytique en phase vapeur de l’éthanol est devenue le procédé préféré, probablement en raison de la durée de vie prolongée du catalyseur et du potentiel de récupération d’énergie.
1.1. Déshydrogénation de l’éthanol
Les premières études sur la déshydrogénation de l’éthanol, documentées en 1886, impliquaient de faire passer de l’éthanol dans des tubes de verre à 260 °C.
CH3CH2OH → CH3CHO + H2 ΔH = +82,5 kJ/mol
Des rendements améliorés sont obtenus avec des catalyseurs tels que les oxydes de platine, de cuivre ou de zinc, de nickel ou de cobalt. Des brevets ultérieurs mentionnent des catalyseurs au zinc et au chrome, des oxydes de métaux de terres rares et des mélanges d’oxydes de cuivre et de chrome.
Les catalyseurs au cuivre donnent le moins de produits de décomposition, mais une régénération fréquente du catalyseur est nécessaire.
1.1.1. Description du processus
La vapeur d’éthanol est dirigée à travers un réacteur tubulaire contenant un catalyseur composé d’éponge de cuivre ou de cuivre activé avec de l’oxyde de chrome à des températures de 260 à 290 °C. Chaque exécution se traduit par un taux de conversion de 25 à 50 %.
L’acétaldéhyde et l’éthanol sont séparés des gaz d’échappement, principalement composés d’hydrogène, par lavage à l’alcool et à l’eau. L’acétaldéhyde pur est obtenu par distillation, tandis que l’éthanol est séparé de l’eau et des produits à point d’ébullition plus élevé par distillation et renvoyé au réacteur.
Le rendement final en acétaldéhyde est d’environ 90 %. Les sous-produits comprennent l’acide butyrique, le crotonaldéhyde et l’acétate d’éthyle.
1.2. Oxydation de l’éthanol
L’oxydation de l’éthanol est la méthode de laboratoire la plus ancienne et la plus efficace pour synthétiser l’acétaldéhyde. Dans le procédé commercial, l’éthanol est oxydé catalytiquement avec de l’oxygène (ou de l’air) en phase vapeur.
CH3CH2OH + 0,5 O2 → CH3CHO + H2O ΔH = -242 kJ/mol
Le cuivre, l’argent et leurs oxydes ou alliages sont des catalyseurs couramment utilisés.
1.3. Procédé Veba-Chemie
Dans le procédé Veba-Chemie, l’éthanol est combiné avec de l’air et passé sur un catalyseur à l’argent à des températures allant de 500 à 650 °C. La température spécifique dépend du rapport alcool-air et du débit de gaz à travers le catalyseur.
La conversion de l’alcool varie de 50% à 70%, tandis que le rendement varie entre 97% et 99%, selon les conditions de réaction. L’acétaldéhyde et l’alcool non converti sont séparés des gaz résiduaires par lavage à froid à l’alcool et distillation fractionnée.
Après concentration, l’alcool retourne dans le réacteur. La chaleur générée pendant la réaction est utilisée pour la production de vapeur à l’aide d’un système de récupération de chaleur perdue immédiatement après la zone de réaction.
Les gaz résiduaires se composent principalement d’azote, d’hydrogène, de méthane, de monoxyde de carbone et de dioxyde de carbone, et sont brûlés en tant que gaz pauvre à faible pouvoir calorifique dans des générateurs de vapeur. De petites quantités d’acide acétique sont produites comme sous-produit.
2. Production d’acétaldéhyde à partir d’acétylène
L’utilisation de composés de mercure sert de catalyseur principal pour le processus industriel d’addition d’eau (hydratation) dans la production d’acétylène.
Pour réussir la mise en œuvre industrielle de ce procédé, il est important d’éliminer les produits de polymérisation et de condensation de l’acétaldéhyde formés en milieu acide.
En 1912, le Consortium für elektrochemische Industrie a proposé un procédé qui utilisait un excès d’acétylène à une température élevée. Cela impliquait l’élimination immédiate du produit acétaldéhyde du liquide de réaction.
Simultanément, la chaleur générée lors de la réaction a été dissipée en distillant une quantité appropriée d’eau. Des réactions secondaires, telles que l’oxydation de l’acétaldéhyde pour former de l’acide acétique et du dioxyde de carbone, ont entraîné la réduction du Hg2+ en mercure métallique. La production d’acétaldéhyde à partir d’acétylène a maintenant été arrêtée dans les pays occidentaux.
2.1. Procédé d’oxydation humide (Hoechst)
Le processus d’oxydation par voie humide offrait une solution pour éviter la manipulation directe des composés toxiques du mercure. Il a été utilisé par Wacker-Chemie, entre autres, jusqu’au passage à l’éthylène comme matière première en 1962.
Dans cette méthode, du sulfate de fer (III) a été ajouté pour réoxyder le mercure métallique en sel de mercure (II), garantissant des concentrations adéquates du catalyseur actif. L’acétylène réagi avec la solution aqueuse de catalyseur à 90-95°C.
Environ 30 à 50 % de l’acétylène injecté ont subi une réaction à chaque passage. Le gaz sortant du réacteur était refroidi, entraînant la séparation de l’eau et des traces de mercure, qui étaient ensuite renvoyées dans le réacteur.
L’acétaldéhyde et l’eau ont été condensés dans des refroidisseurs supplémentaires, et l’acétaldéhyde a finalement été lavé avec de l’eau du gaz de cycle refroidi. Ce procédé a donné une solution aqueuse d’acétaldéhyde à 8-10 %.
L’azote a été introduit avec le gaz d’alimentation, tandis que le dioxyde de carbone a été produit comme sous-produit. Pour éviter une accumulation excessive, ces gaz ont été éliminés en retirant un petit courant du gaz de cycle.
Du sulfate de fer (II) s’est formé au cours de la réaction et oxydé dans un réacteur séparé avec de l’acide nitrique à 30 % à 95 °C. L’acétaldéhyde pur a été obtenu par distillation fractionnée de la solution aqueuse à environ 200 kPa.
2.2. Processus Chisso
Le procédé Chisso utilisait une solution d’acide sulfurique/sulfate de mercure comme catalyseur. L’acétylène a réagi complètement avec la solution de catalyseur à 68-78°C et une pression manométrique de 140 kPa.
Une combinaison d’étapes de processus sous pression et sous vide, menées à basse température et sans excès d’acétylène, a permis l’isolement et la distillation d’acétaldéhyde pur, en utilisant la chaleur générée pendant la réaction.
Semblable au procédé Hoechst, le catalyseur pourrait être régénéré avec de l’acide nitrique. Cependant, la production d’acétaldéhyde utilisant cette méthode a été interrompue chez Chisso Corp. il y a plus de dix ans.
2.3. Production via Vinyl Ether
REPPE chez BASF a introduit une méthode utilisant de l’éther vinylique, évitant complètement l’utilisation de composés de mercure toxiques. Du méthanol a été ajouté à de l’acétylène à 150-160 °C et 1600 kPa en présence d’hydroxyde de potassium, ce qui a entraîné la formation d’éther méthylvinylique. L’éther méthylvinylique a ensuite été hydrolysé avec un acide dilué.
2.4. Production via le diacétate d’éthylidène
L’addition d’acide acétique à l’acétylène en présence de sels de mercure(II) a donné du diacétate d’éthylidène (CH3CH(OCOCH3)2). Ce composé s’est décomposé en acétaldéhyde et anhydride acétique à 130-145 °C à l’aide de catalyseurs acides tels que ZnCl2.
Bien que ce procédé ait été initialement développé par la Société Chimique des Usines du Rhône à l’échelle industrielle en 1914, il a perdu de son importance ces derniers temps.
3. Production à partir d’éthylène
L’éthylène est devenu la principale matière première pour la production d’acétaldéhyde, le procédé Wacker étant la méthode dominante pour l’oxydation directe de l’éthylène.
3.1. Oxydation directe de l’éthylène
Le procédé Wacker, développé par Wacker-Chemie et Hoechst entre 1957 et 1959, implique la réaction suivante :
CH4 + 0.5 O2 → CH3CHO ΔH= -244 kJ/mol
Une solution de catalyseur contenant du PdCl2 et du CuCl2 est utilisée. La réaction entre l’éthylène et le chlorure de palladium aqueux s’est avérée produire de l’acétaldéhyde presque quantitativement:
C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2HCl
Dans le procédé Wacker-Hoechst, le palladium métallique est réoxydé par CuCl2, qui est ensuite régénéré avec de l’oxygène :
Pd+2CuCl2 → PdCl2 + 2CuCl
2CuCl + 0.5 O2 + 2HCl → 2CuCl2 + H2O
Par conséquent, seule une petite quantité de PdCl2 est nécessaire pour la conversion de l’éthylène, et l’étape déterminant la vitesse est la réaction de l’éthylène avec le chlorure de palladium.
Le procédé peut être réalisé en une ou deux étapes. Dans le procédé en une étape, un mélange éthylène-oxygène réagit avec la solution de catalyseur. Un état stationnaire est établi où la formation d’acétaldéhyde et la réduction de CuCl2 se produisent à la même vitesse. Le degré d’oxydation du catalyseur, exprimé par le rapport CCu2+/(CCu2++CCu+), détermine cet état stationnaire.
Dans le procédé en deux étapes, l’éthylène et l’oxygène réagissent séparément dans différents réacteurs et la solution de catalyseur est alternativement réduite et oxydée. L’air est généralement utilisé pour l’oxydation du catalyseur au lieu de l’oxygène pur.
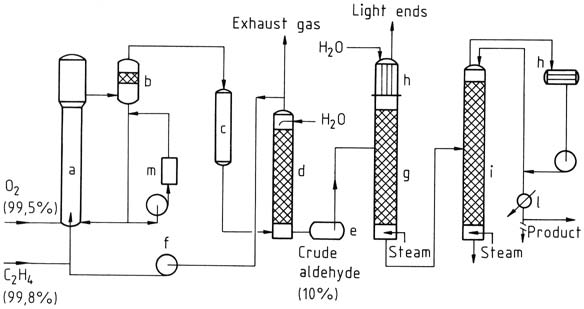
3.1.1. Processus en une étape
Dans le procédé en une étape, l’éthylène et l’oxygène sont introduits dans une tour de réaction. La solution catalytique est mise en circulation et mélangée au gaz selon le principe de l’airlift. La réaction a lieu à environ 130 °C et 400 kPa.
Le mélange résultant d’acétaldéhyde, de vapeur d’eau et de gaz non converti est séparé, refroidi et lavé pour séparer les produits de réaction.
Le gaz non converti est recyclé vers le réacteur, une petite partie étant évacuée comme gaz d’échappement pour empêcher l’accumulation de gaz inerte. L’acétaldéhyde brut issu du lavage est ensuite distillé en deux étapes pour obtenir de l’acétaldéhyde purifié.
3.1.2. Processus en deux étapes
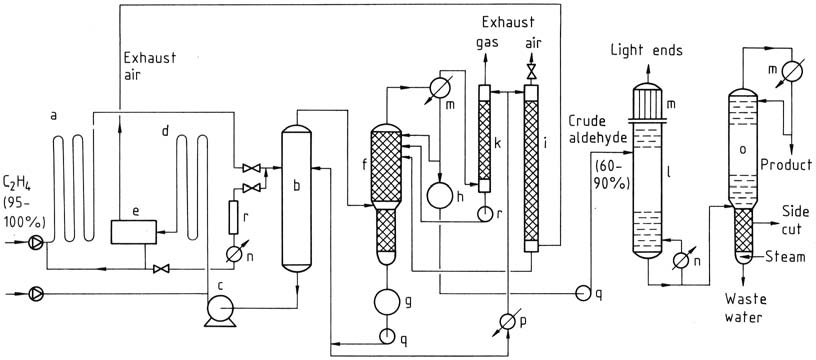
Le procédé en deux étapes implique l’utilisation de réacteurs tubulaires pour les étapes de réaction et d’oxydation. Les gaz réagissent presque complètement en présence du catalyseur. L’éthylène réagit à des températures et des pressions plus basses, et la solution de catalyseur contenant de l’acétaldéhyde est ensuite détendue dans une tour flash.
Le mélange acétaldéhyde-vapeur d’eau est distillé, et le catalyseur est recyclé pour la réaction avec l’éthylène. L’eau de traitement est réutilisée et une partie est utilisée pour épurer l’air et les gaz d’échappement afin d’éliminer les impuretés. L’acétaldéhyde brut est soumis à une distillation en deux étapes pour obtenir de l’acétaldéhyde pur.
Les procédés en une étape et en deux étapes ont un rendement en acétaldéhyde similaire d’environ 95 % et des coûts de production comparables. Le choix entre ces méthodes dépend de facteurs tels que la disponibilité des matières premières, les considérations énergétiques et le coût de l’oxygène.
3.2. Formation d’acétaldéhyde en tant que sous-produit
La génération d’acétaldéhyde se produit lors du processus de fabrication de l’acétate de vinyle à partir d’éthylène ou d’acétylène. La distillation est utilisée pour séparer l’acétaldéhyde, qui est ensuite converti en acide acétique à des fins de recyclage.
Dans une variante spécifique du procédé à partir d’éthylène, à la fois l’acétate de vinyle et l’acétaldéhyde sont obtenus dans des proportions molaires égales de 1:1. Cette caractéristique rend le procédé quasiment autosuffisant en termes de production d’acide acétique.
3.3. Isomérisation de l’oxyde d’éthylène
Avant que l’oxydation directe de l’éthylène ne devienne la méthode préférée, des recherches approfondies ont été menées sur ce procédé. Des catalyseurs tels que Al2O3, SiO2 et des sels acides dérivés d’acides minéraux comme l’acide sulfurique, l’acide phosphorique ou l’acide molybdique ont été utilisés.
Bien que des rendements de 90 à 95 % aient été rapportés, cette approche n’a pas acquis une importance industrielle significative.
4. Production à partir de sources C1
Suite aux augmentations du prix du pétrole en 1973/74 et 1977, les matériaux C1 ont suscité de l’intérêt comme matière première pour la chimie organique et comme alternative à la pétrochimie.
Cependant, en termes de production d’acétaldéhyde, les matériaux C1 semblent avoir une importance limitée puisque la plupart des dérivés d’acétaldéhyde traditionnels peuvent être synthétisés à partir de sources C1.
4.1. Production directe à partir de gaz de synthèse
L’acétaldéhyde se forme avec une sélectivité relativement faible, produisant environ 30 % à partir du gaz de synthèse. Le mélange résultant contient également de l’acide acétique, de l’éthanol et des hydrocarbures saturés, principalement du méthane.
Des catalyseurs comprenant des composés de cobalt et de rhodium activés par des composés d’iode ou du chlorure de magnésium, supportés sur un support de silicate, sont utilisés. A ce jour, ce procédé n’a pas trouvé d’applications industrielles.
4.2. Production via du méthanol, de l’acétate de méthyle ou de l’anhydride acétique
L’hydroformylation du méthanol à l’aide de CO/H2, connue sous le nom de procédé oxo, est bien établie. Cette réaction se produit en présence de catalyseurs d’hydroformylation tels que les sels de cobalt, de nickel et de fer (par exemple, CoBr2, CoI2) ou les carbonyles métalliques correspondants.
Elle est réalisée à des températures élevées (180-200 °C) et à haute pression (30-40 MPa). Une sélectivité en acétaldéhyde de 80% ou plus a été rapportée en utilisant des catalyseurs fer-cobalt carbonyle ou cobalt-nickel en conjonction avec des amines tertiaires, des phosphines ou des nitriles.
De même, une sélectivité élevée a été revendiquée pour l’hydrocarbylation de l’acétate de méthyle à l’aide de catalyseurs au palladium ou au rhodium, accompagnés de phosphines tertiaires et de composés d’iode, ou de catalyseurs au cobalt-ruthénium, en présence d’iodures de méthyle et de sodium.
Certains brevets décrivent la génération d’acétaldéhyde par la réduction de l’anhydride acétique avec de l’hydrogène sur des catalyseurs au palladium ou au platine supportés sur un support, fonctionnant à de basses pressions et à des températures modérées.
Si à l’avenir l’importance de l’acétaldéhyde en tant qu’intermédiaire organique diminue, cette méthode pourrait s’avérer intéressante pour produire économiquement de petites quantités d’acétaldéhyde.
5. Production à partir d’hydrocarbures
L’acétaldéhyde est un sous-produit de la production d’acroléine, d’acide acrylique et d’oxyde de propène à partir du propène. De plus, il est formé par l’oxydation d’hydrocarbures saturés (par exemple, le propane ou le butane) en phase gazeuse, comme mis en œuvre par Celanese aux États-Unis.
Référence
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
