Malononitrile : propriétés, réactions, production et utilisations
Qu’est-ce que le malononitrile ?
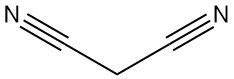
Le malononitrile, également connu sous le nom de propanedinitrile, dinitrile d’acide malonique ou dicyanométhane, est un composé organique de formule chimique C3H2N2. Il s’agit d’un solide incolore ou blanc qui constitue un élément de base précieux largement utilisé en synthèse organique.
Table des matières
1. Propriétés physiques du malononitrile
Le malononitrile forme des cristaux incolores qui sont solubles dans les solvants polaires comme l’eau, les alcools inférieurs, l’acétonitrile et l’éther diéthylique, mais il est insoluble dans les solvants non polaires comme le tétrachlorométhane, l’éther de pétrole et le xylène.
Un stockage prolongé peut induire un changement de couleur, transformant les cristaux d’incolores en jaune ou même en brun foncé sans compromettre leur qualité.
Le malononitrile est toxique s’il est ingéré et peut provoquer une grave irritation de la peau et des yeux.
Les propriétés physiques du malononitrile sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro d'enregistrement CAS | [109-77-3] |
| Formule moléculaire | C3H2N2 |
| Masse moléculaire | 66,06 g/mol |
| Point de fusion | 31,6 °C |
| Point d'ébullition | 218 – 219 °C |
| Densité (20 °C) | 1,19 g/mL |
| Indice de réfraction (34 °C) | 1,4146 |
| Moment dipolaire (25 °C) | 3,57 D |
| pKa | 11,2 |
| Densité de vapeur | 2,3 |
| Pression de vapeur | 0,2 mmHg |
| Point d'éclair | > 86 °C |
| Solubilité (20 °C) | |
| eau | 133 g/L |
| éther diéthylique | 200 g/L |
| éthanol | 400 g/L |
2. Réactions chimiques du malononitrile
Le malononitrile présente une réactivité polyvalente en raison de la nucléophilie de l’anion malononitrile, qui peut être obtenue par déprotonation avec une base faible, et de la nature électrophile de ses groupes cyano.
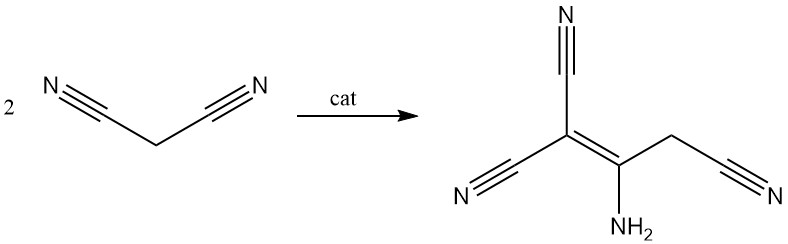
Le malononitrile est dimérisé en présence d’une base pour donner du 2-amino-1,1,3-tricyano-2-propène.
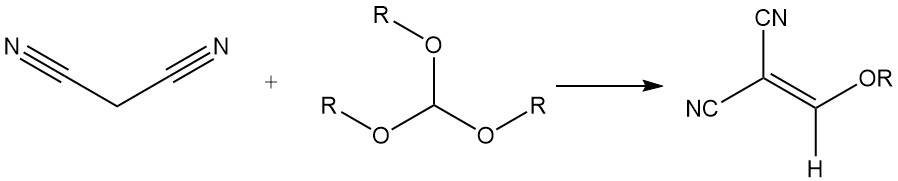
Il réagit avec les orthoformates de trialkyle pour produire des alcoxyméthylène malonitriles, qui sont utilisés pour la synthèse de colorants styryliques.
La dialkylation du malononitrile avec des halogénures d’alkyle et l’acylation avec des chlorures/anhydrides d’acides sont possibles.
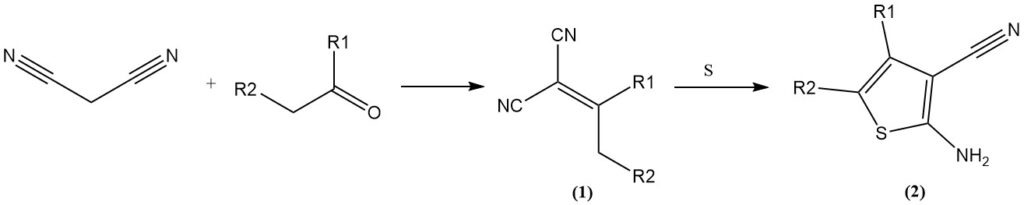
La condensation de Knoevenagel avec des aldéhydes/cétones donne des ylidène malonitriles (1), qui peuvent subir d’autres réactions. On peut citer comme exemples la réaction avec le soufre élémentaire (réaction de Gewald) pour former des 3-cyano-2-amino-thiophènes (2) ou la cycloaddition avec des azotures pour produire des tétrazoles.
Le malononitrile réagit avec le brome pour donner des dérivés mono- ou dibromés. La décomposition thermique du complexe dibromure donne du tétracyanoéthylène.
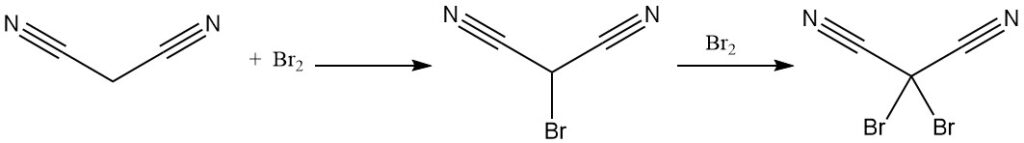
La réaction du dibromalononitrile avec le cyanure de potassium donne le sel de potassium du tricyanométhane, également produit à partir du malononitrile et du chlorure de cyanogène. Le tricyanométhane est utilisé dans la synthèse de liquides ioniques.
La réaction du malononitrile avec le disulfure de carbone en présence d’une base produit des sels de (dimercaptométhylène)malonitrile, un précurseur des antimicrobiens. La diméthylation donne un autre élément constitutif important des hétérocycles.
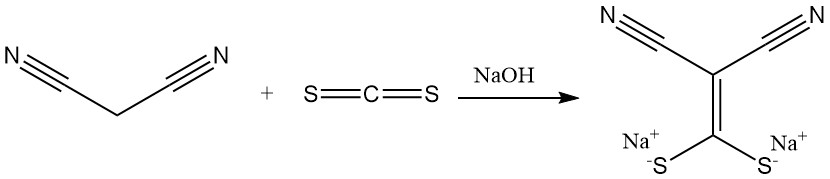
Le cyanothioacétamide est préparé par réaction avec du sulfure d’hydrogène.
Les réactions acido-catalysées du malononitrile avec des alcools génèrent des imidates (3), qui sont des matières premières pour les hétérocycles azotés comme les 4,6-diméthoxypyrimidines (4) ou les bis(oxazolines) (5).
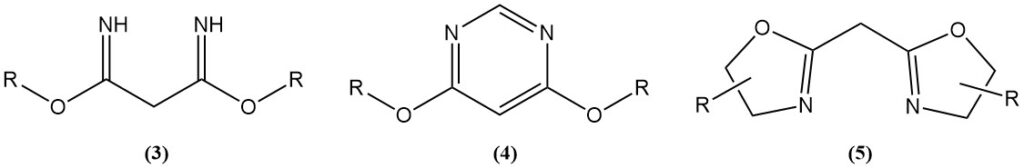
Les bis(oxazolines) sont produites par des réactions de type Ritter ou en utilisant un catalyseur. Les bis(oxazolines) synthétisées à partir de malononitrile ou de ses dérivés et d’aminoalcools chiraux sont utilisées comme ligands dans des réactions catalysées par des métaux de transition asymétriques.
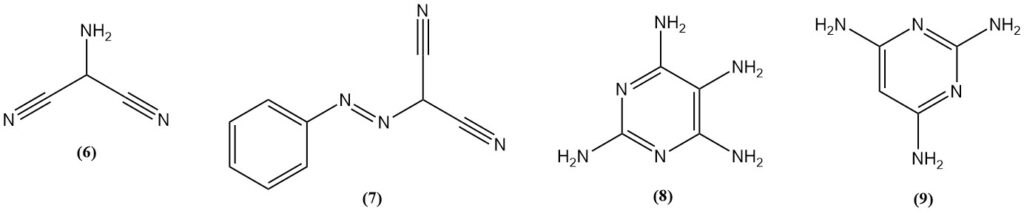
Le 2-aminomalononitrile (6) est obtenu par nitrosation du malononitrile, suivie d’une hydrogénation ou d’une réduction du (phénylazo)malononitrile (7). L’aminomalononitrile réagit avec la guanidine pour donner la 2,4,5,6-tétraaminopyrimidine (8).
La 2,4,6-triaminopyrimidine (9) peut être préparée par la réaction du malononitrile et de la guanidine, tandis que la 2,4,6-triaminopyrimidine est produite à partir de formamidine.
3. Production de malononitrile
Jusqu’aux années 1970, le malononitrile était produit par un procédé discontinu par déshydratation de cyanoacétamide à l’aide de pentachlorure de phosphore ou d’oxychlorure de phosphore. Cette méthode, bien que documentée par des brevets encore récents, n’est plus utilisée commercialement, sauf dans certaines petites usines chinoises.
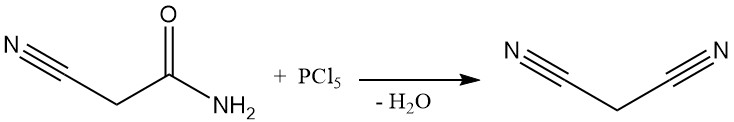
La méthode industrielle dominante de synthèse du malononitrile est aujourd’hui une réaction continue à haute température entre l’acétonitrile et le chlorure de cyanogène. Ce procédé utilise un réacteur tubulaire fonctionnant à plus de 700 °C et permet une conversion presque complète en un seul passage, ce qui permet d’obtenir du malononitrile.
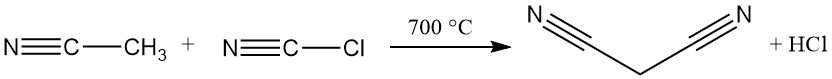
L’acétonitrile, l’acide chlorhydrique et des traces d’acides maléique, succinique et fumarique sont présents avec le produit souhaité comme impuretés.
Le produit sortant du réacteur est rapidement refroidi pour arrêter la réaction et séparer le chlorure d’hydrogène gazeux, qui est ensuite récupéré par épuration. L’acétonitrile en excès est éliminé par une combinaison de distillation sous vide et d’évaporation en couche mince, ce qui permet son recyclage avec une contamination minimale.
La séparation des acides maléique et fumarique du malononitrile brut est peu pratique en raison de leurs points d’ébullition similaires. Par conséquent, ces impuretés sont converties en composés à point d’ébullition plus élevé par une réaction de Diels-Alder dans un réacteur séparé. Enfin, deux distillations sous vide éliminent ces sous-produits, ce qui donne un rendement de 66 % de malononitrile basé sur les deux matières de départ.
La première usine industrielle utilisant ce procédé a été exploitée en 1973 par Lonza à Viège, en Suisse.
Bien que des méthodes alternatives de production de malononitrile aient été proposées, telles que celles utilisant des cyanoacétates, des malonates ou des réactions avec de l’ammoniac et divers catalyseurs, aucune de ces méthodes n’est actuellement utilisée à l’échelle industrielle.
4. Utilisations du malononitrile
Le malononitrile est largement utilisé comme matière première dans la production de vitamines, de produits agrochimiques, de produits pharmaceutiques et de colorants.
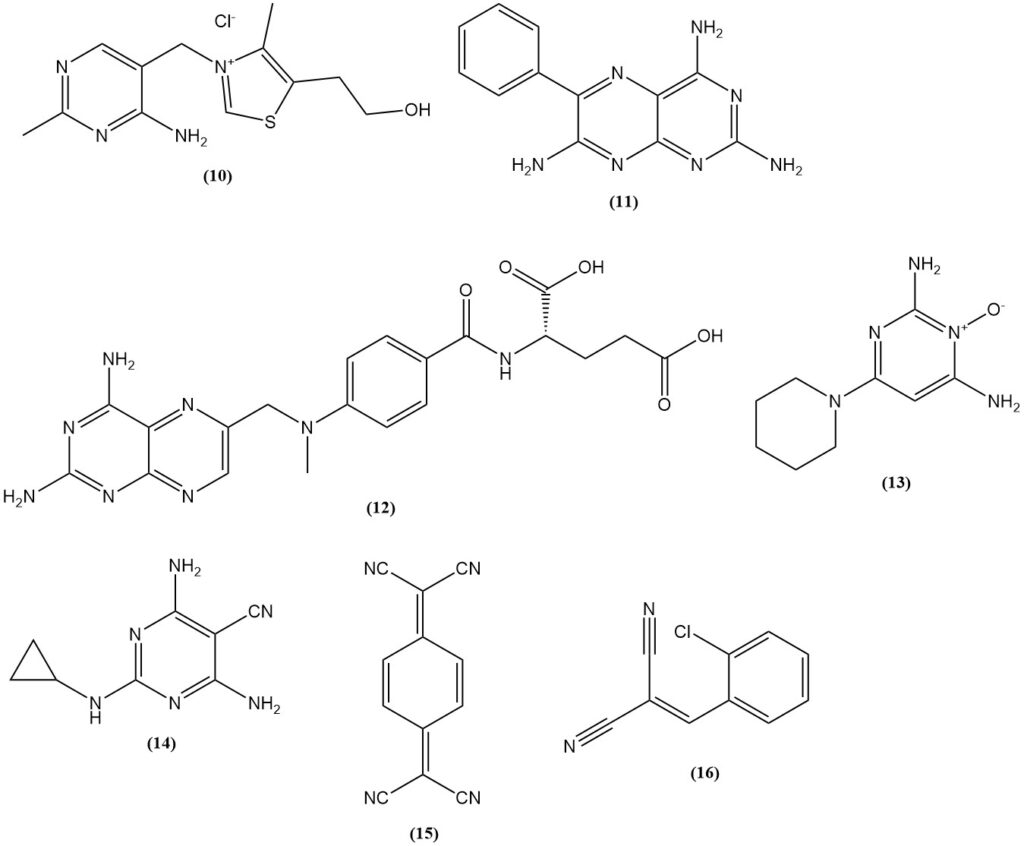
Le malononitrile est utilisé dans la synthèse de la thiamine (10) (vitamine B1), des herbicides sulfonylurées à base de 2-amino-4,6-diméthoxypyrimidine, tels que le benzsulfuron-méthyl et l’halosulfuron-méthyl et des produits pharmaceutiques (le diurétique triamtérène (11), l’antagoniste de l’acide folique méthotrexate (12), l’antihypertenseur minoxidil (13) et le pesticide dicyclanil (14)).
Parmi les exemples de colorants et de pigments produits à partir du malononitrile, on peut citer les colorants méthine jaune avec un groupe N,N-dialkylaminoaryle (aminoarylneutrocyanines) comme le C.I. Disperse Yellow 90 ; les colorants aminoarylneutrocyanine bleus comme le C.I. Disperse Blue 354 et l’acide 1,4,5,8-naphtalènetétracarboxylique, qui est un précurseur des pigments périnone.
Il est également utilisé dans la production de conducteurs électriques tels que les sels de transfert de charge du 7,7,8,8-tétracyanoquinodiméthane (15) (TCNQ) et le gaz lacrymogène (o-chlorobenzylidène)malonitrile (16), qui peut être produit à partir de la condensation de l’o-chlorobenzaldéhyde avec le malononitrile.
5. Toxicologie du malononitrile
Le malononitrile peut provoquer une grave irritation oculaire chez les lapins après exposition à 5 mg pendant 24 heures.
Le malononitrile est hautement toxique par diverses voies, avec des valeurs de DL50 orales allant de 14 mg/kg à 69,8 mg/kg chez le rat. Les effets courants comprennent des convulsions, une faiblesse musculaire, une dépression respiratoire et des changements de comportement.
Le contact cutané avec le malononitrile peut également être mortel chez le rat à des doses de 350 mg/kg. Les données disponibles suggèrent des effets potentiels sur divers organes, notamment les poumons, le sang et le système nerveux.
L’exposition orale répétée chez le rat à des doses plus faibles (285 mg/kg/19 semaines) peut provoquer des modifications du foie et du poids.
Des limites d’exposition professionnelle existent pour réguler les concentrations de malononitrile dans l’air du lieu de travail (par exemple, le niveau d’exposition recommandé par le NIOSH : 3 ppm).
Références
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Malononitrile
- https://www.cdc.gov/niosh-rtecs/OO3010B0.html
