Chloroamines

Les chloroamines sont des composés contenant de l’azote, inorganiques ou organiques, dans lesquels un ou plusieurs atomes de chlore sont directement liés à un atome d’azote. La monochloroamine (NH2Cl), découverte au début des années 1800, est un exemple bien connu.
Les chloroamines sont des substances chlorantes et oxydantes utilisées dans des réactions de synthèse et comme agents de blanchiment, désinfectants et bactéricides. Comparés au chlore gazeux ou aux hypochlorites métalliques, ils offrent une manipulation plus sûre et une plus grande stabilité.
Pour cette raison, ils sont utilisés dans la purification de l’eau potable et l’assainissement des piscines. Les acides N-chloroisocyanurique et la 1-bromo-3-chloro-5,5-diméthylhydantoïne deviennent plus importants sur les marchés de l’assainissement et de la désinfection que l’hypochlorite de calcium, 1,3-dichloro-5,5-diméthylhydantoïne et chloramine-T.
Table des matières
1. Propriétés chimiques des N-chloroamines
Les N-chloroamines possèdent des capacités oxydantes, acceptant deux électrons pour les convertir en ions chlorure. Cette propriété leur permet d’oxyder l’acide iodhydrique, libérant de l’iode, dans une réaction utilisée pour l’analyse quantitative :
2 HI + RR’NCl → HCl + RR’NH + I2
La teneur théorique en chlore dans une N-chloroamine est calculée comme étant le double de la fraction massique de chlore. Cependant, les applications pratiques l’expriment comme l’équivalent du chlore élémentaire en fonction de sa capacité oxydante réelle.
Les N-chloroamines subissent une hydrolyse dans l’eau, libérant de l’acide hypochloreux (HOCl). La constante quantitative d’hydrolyse (valeur K), comprise entre 10-4 et 10-10 (Tableau 1), reflète cette réaction :
RR’NCl + H2O ⇌ RR’NH + HOCl
K = [RR’NH][HOCl] / [RR’NCl]
| N-Chloroamine | Valeur K |
|---|---|
| Acide trichloroisocyanurique | 6,7 × 10-4 |
| 1,3-Dichloro-5,5-diméthylhydantoïne | 2,5 × 10-4 |
| N-Chlorosuccinimide | 6,6 × 10-5 |
| Dichloramine-T | 8,0 × 10-7 |
| Chloramine-T | 4,9 × 10-8 |
| Monochloroamine | 2,8 × 10-10 |
Cette valeur K concerne le pouvoir bactéricide des N-chloroamines, car leur efficacité dépend de la génération d’acide hypochloreux dans l’eau.
Les liaisons N-Cl dans les N-chloroamines sont covalentes et facilement hydrolysées, libérant de l’acide hypochloreux. Ils présentent une instabilité thermique, ne parviennent souvent pas à fondre de manière cohérente et peuvent exploser à des températures élevées. La trichloroamine (NCl3) est un composé particulièrement instable et peut provoquer des explosions même en tant qu’impureté.
Un stockage approprié des N-chloroamines nécessite des températures fraîches et une protection contre la lumière, l’eau, les amines et les composés d’ammonium, les acides et bases forts, ainsi que les matières organiques facilement oxydables.
2. Réactions des chloroamines
De nombreuses N-chloroamines jouent un rôle précieux en tant que réactifs ou intermédiaires dans diverses réactions organiques.
Dégradation de Hofmann : Les N-chloroamides dérivés d’acides carboxyliques organiques subissent une réduction avec un alcali pour produire les amines correspondantes avec une grande efficacité. Cette réaction, connue sous le nom de dégradation d’Hofmann, est utilisée pour la synthèse d’amines aromatiques, d’amines hétérocycliques et d’amines alicycliques. .
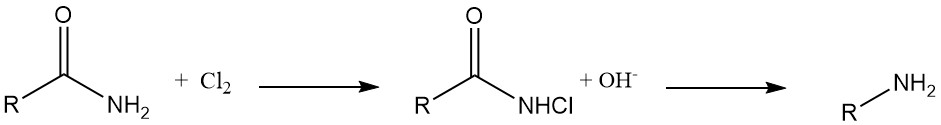
Synthèse des hydrazines : les N-chlorourées se transforment en hydrazines lors d’un traitement avec une base dans des solutions alcooliques ou aqueuses.
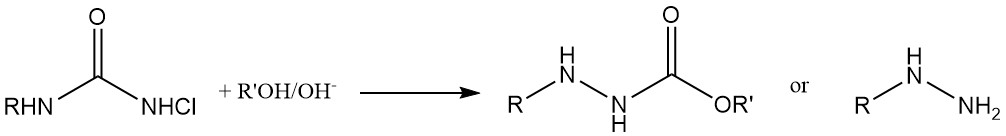
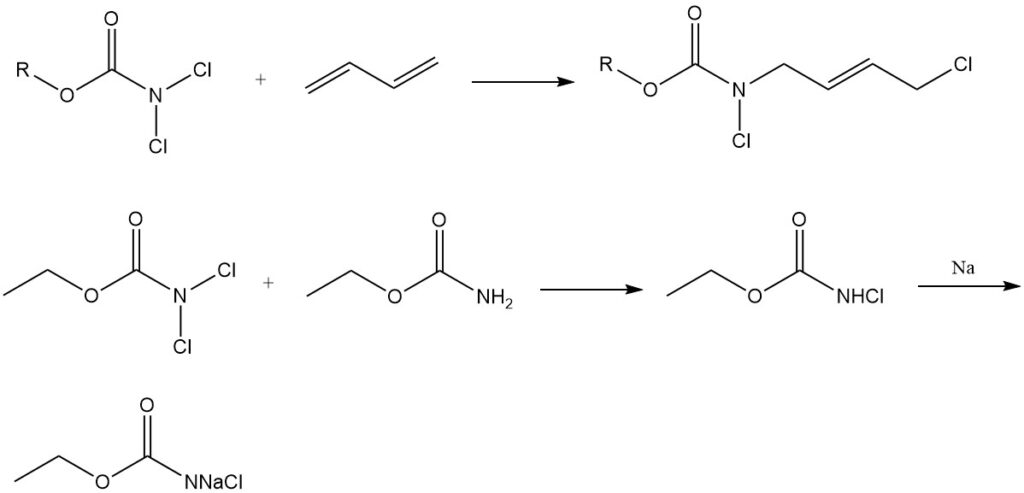
Agents de chloration et addition aux diènes : Les N,N-dichlorocarbamates (Cl2NCOOR) sont utilisés comme agents de chloration et s’engagent également dans des réactions supplémentaires avec les diènes. Ils agissent en outre comme matières premières pour la synthèse des N-halo-N-métallocarbamidates, des intermédiaires importants dans la production de dérivés carbamates de composés physiologiquement actifs.
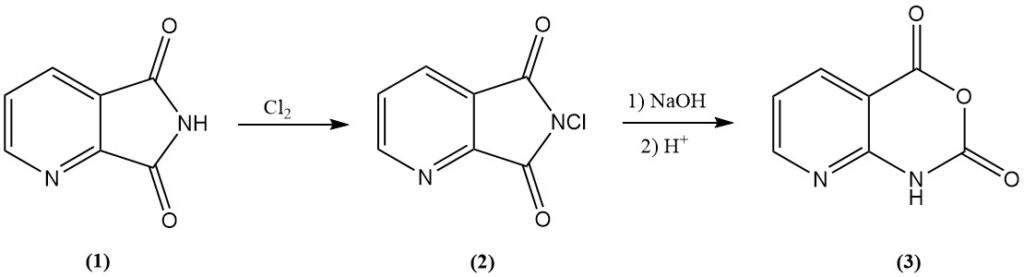
L’anhydride 8-azaisatoïque (3), un intermédiaire dans divers produits agrochimiques, est obtenu efficacement par chloration du 2,3-pyridinedicarboximide (1) en N-chloro-2,3-pyridinedicarboximide (2), suivie d’un traitement alcalin.
Synthèse de cycles hétérocycliques : les N-chloroamidines et les N-chloroguanidines sont utilisées comme matières premières pour la production de systèmes de cycles hétérocycliques comme les imidazoles, les thiazoles et les oxadiazoles.
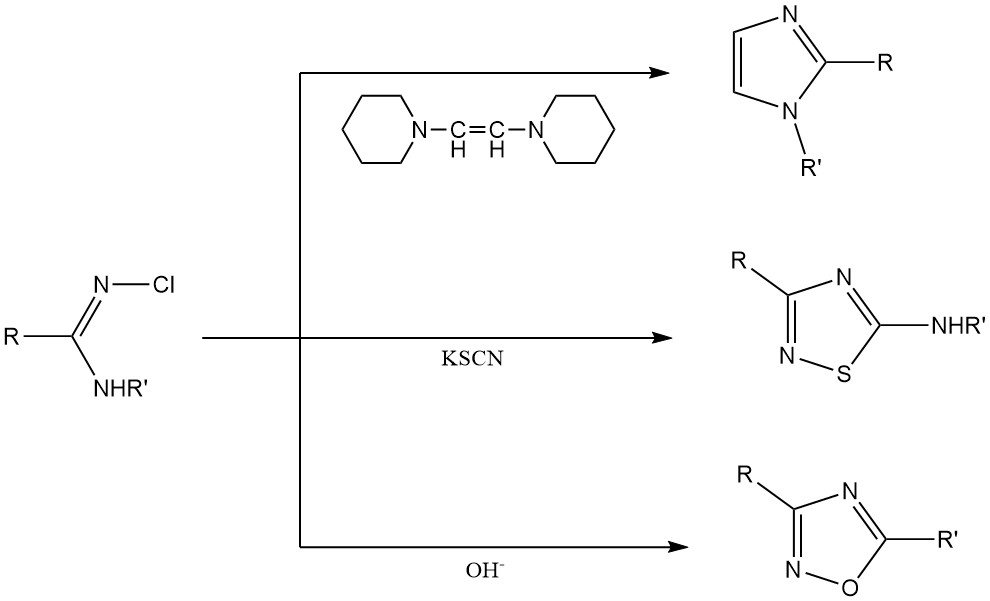
3. N-chloroamines inorganiques
La Monochloroamine (NH2Cl) est un liquide incolore à forte odeur qui est plus stable dans les solutions aqueuses que les autres N-chloroamines comme la dichloroamine (NHCl2) et la trichloroamine (NCl3). Sa principale application est la désinfection de l’eau potable. Il est également utilisé comme agent oxydant en synthèse organique, notamment pour les phosphines trisubstituées.
Les N-chloroamines sont synthétisées par des réactions à pH contrôlé entre les sels d’ammonium et l’acide hypochloreux, ou chlore.
Une extrême prudence est de mise lors de la manipulation de N-chloroamines pures en raison de leur instabilité et de leur explosivité inhérentes, même à température ambiante.
Acide N-chlorosulfamique (ClSO2NH2), acide N,N-dichlorosulfamique et N-chloroimidodi-sulfonate de sodium (ClSO2NNaSO2) sont utilisés comme désinfectants et agents de blanchiment du papier ou des tissus. Ils sont produits à partir d’acide sulfamique et d’acide hypochloreux.
4. Acides N-chloroisocyanuriques
Les acides N-chloroisocyanuriques (chloroisocyanurates), comme l’acide trichloroisocyanurique (Symclosene ou TCC) et le dichloroisocyanurate de sodium (DCC-Na), connaissent une augmentation remarquable de leur utilisation comme désinfectants. Cette popularité croissante est due à leur stabilité et leur convivialité supérieures à celles des hypochlorites métalliques traditionnels.
Le tableau 2 répertorie certaines propriétés physiques importantes du TCC et du DCC-Na.
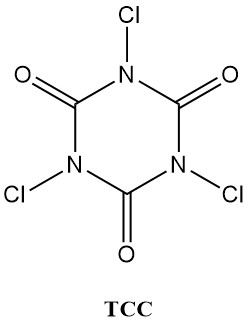
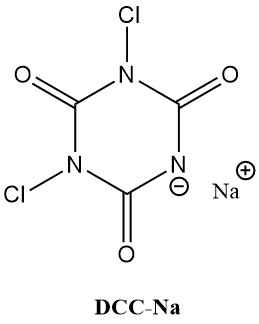
| Propriété | TCC | DCC-Na |
|---|---|---|
| Numéro CAS | [87-90-1] | [2893-78-9] |
| Forme physique | Poudre blanche | Poudre blanche |
| Formule | (ClNCO)3 | Cl2Na(NCO)3 |
| Monsieur | 232.44 | 219,98 |
| mp | 234 °C (décomp.) | 225 °C (décomp.) |
| Chlore disponible théorique (%) | 91,5 | 64,5 |
| Chlore disponible Valeur typique | 90,0 | 62,0 |
| pH (solution aqueuse à 1 %) | 2,7 – 3,3 | 6,2 – 6,8 |
| Solubilité dans l'eau (25 °C) (g/100 g) | 1.0 | 30,0 |
| Solubilité dans l'acétone (30 °C) | 35,0 | 0,5 |
Le TCC et le DCC-Na ont pris une part de marché importante, historiquement dominée par l’hypochlorite de calcium, les huiles de pin, les sels d’ammonium quaternaire et les phénols.
Les acides N-chloroisocyanuriques sont produits par une réaction de chloration continue de l’acide isocyanurique dans de l’hydroxyde de sodium aqueux à basse température (0-15 °C). Un contrôle précis du pH et de la température de réaction est important pour empêcher la formation de trichloroamine (NCl3) hautement explosive.
L’acide trichloroisocyanurique (TCC) se décompose progressivement en milieu alcalin pour générer des sous-produits comme la trichloroamine (NCl3), la dichloroamine (NHCl 2), et la monochloroamine (NH2Cl).
Le dichloroisocyanurate de sodium (DCC-Na) et son dihydrate ont une solubilité dans l’eau plus élevée que le TCC. Le dihydrate de DCC-Na est obtenu en refroidissant une solution aqueuse saturée de DCC-Na (45 °C) à 10 °C; cette forme offre une stabilité thermique améliorée par rapport à sa forme anhydre.
Le pouvoir désinfectant et assainissant des acides N-chloroisocyanuriques est dû à leur libération progressive d’acide hypochloreux (HOCl) dans l’eau, qui présente des propriétés à la fois oxydantes et biocides.
Ces composés sont utilisés à de nombreuses fins, notamment :
- Traitement anti-rétrécissement de la laine : Ils protègent les fibres de laine du rétrécissement pendant le traitement.
- Désinfection des piscines : Les acides N-chloroisocyanuriques éliminent efficacement les micro-organismes nocifs dans les piscines, maintenant ainsi l’hygiène de l’eau.
- Nettoyer et désinfecter les salles de bains.
- Javellisant à lessive : ils sont utilisés comme agent de blanchiment à lessive efficace pour éliminer les taches et améliorer la blancheur.
Les nettoyants et désinfectants à base d’acide N-chloroisocyanurique contiennent souvent des composants supplémentaires tels que des phosphates, des métasilicates de sodium, des tensioactifs et des sels neutres (sulfate de sodium, carbonate de sodium).
Cette combinaison améliore leurs capacités d’élimination de l’huile et des protéines, ce qui les rend idéales pour diverses tâches de nettoyage. Ils sont recommandés pour la vaisselle dans les hôtels, les hôpitaux, les restaurants et les installations de transformation des aliments en raison de leur efficacité contre divers micro-organismes.
5. N-Chloroamines Organiques
Divers composés N-chloroamines organiques et leurs applications sont répertoriés ci-dessous :
1,3-Dichloro-5,5-diméthylhydantoïne (Dactine) (4)
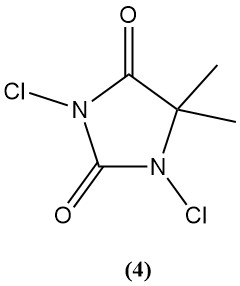
- Poids moléculaire : 197,03 g/mol
- Point de fusion : 132°C
- Teneur théorique en chlore : 77,6 %
- Solubilité dans l’eau : 2,1 g/L
- Il est préparé en chlorant de la 5,5-diméthylhydantoïne aqueuse.
- Il était historiquement utilisé comme bactéricide et désinfectant, mais son utilisation a décliné en raison de la concurrence de TCC et Di-Halo.
1-Bromo-3-chloro-5,5-diméthylhydantoïne (Di-Halo) (5)
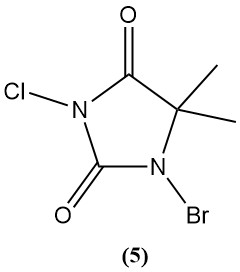
- Poids moléculaire : 241,48 g/mol
- Point de fusion : 130°C (décomp.)
- pH : 2,88 (solution à 0,1 %)
- Solubilité dans l’eau (20°C) : 2 g/L
- Il est préparé par bromation et chloration séquentielles de 5,5-diméthylhydantoïne.
- C’est une poudre blanche stable sans formation de chloroamine dans les solutions faiblement basiques.
- Il est largement utilisé comme désinfectant pour piscine (0,5 à 3 mg/L d’halogène actif) en raison de sa stabilité, de son activité à large spectre et de sa longue durée de conservation.
1-Chloro-2,5-pyrrolidinedione (N-chlorosuccinimide) (6)
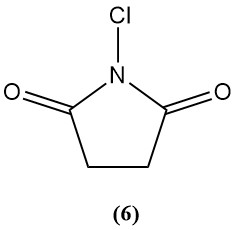
- Poids moléculaire : 133,54 g/mol
- Point de fusion : 150-151 °C
- Il est peu soluble dans divers solvants organiques.
- Chlore disponible : 50 à 54 %
- Il est principalement utilisé comme agent de chloration de synthèse organique.
N-Chloroglycolurils
- Ils sont étudiés comme agents de protection contre les gaz toxiques.
- Ils sont préparés par condensation de 1,2-dicétone avec de l’urée, suivie d’une chloration.
- 2,4,6,8-tétrachloro-2,4,6,8-tétrazabi-cyclo[3.3.0]octane-3,7 -dione (7) est un exemple important de cette classe.
![2,4,6,8-tetrachloro-2,4,6,8-tetrazabi-cyclo[3.3.0]octane-3,7-dione structure](https://chemcess.com/wp-content/uploads/2024/02/2468-tetrachloro-2468-tetrazabi-cyclo3.3.0octane-37-dione-structure.jpg)
1,3,4,6-tétrachloro-3α,6α-diphénylglycoluril (iodogène) (8)
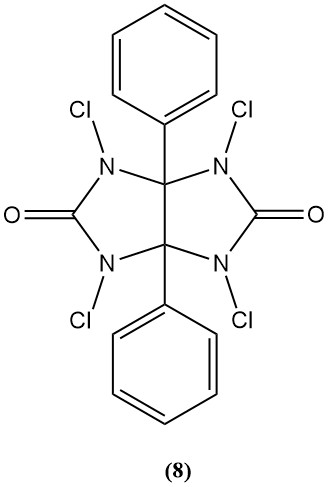
- Poids moléculaire : 431,94 g/mol
- Il est utilisé comme bactéricide et agent oxydant dans la synthèse peptidique.
3-Chloro-4,4-diméthyl-2-oxazolidinon (9)
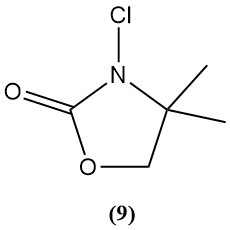
- Poids moléculaire : 149,50 g/mol
- Il s’agit d’un exemple d’une nouvelle classe de N-chloroamines à l’étude comme désinfectants.
N-chloro-p-toluènesulfonamide de sodium (Chloramine-T) (10)
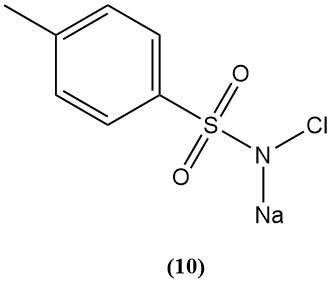
- Poids moléculaire : 227,67 g/mol (hydrate)
- Point de fusion : 175 °C ; explosif
- Chlore disponible : 25 %
- Il est préparé par chloration du p-toluènesulfonamide dans de l’hydroxyde de sodium.
- C’est un électrolyte fort dans l’acide, un bon agent oxydant dans la base, et assez soluble dans l’eau et insoluble dans le benzène.
- Il réagit avec le gaz moutarde pour former des cristaux de sulfimide inoffensifs.
- Leurs dérivés sont étudiés pour la protection contre les gaz toxiques.
N,N’,N »-Trichloromélamine (11)
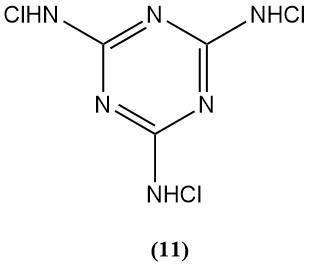
- Poids moléculaire : 229,46 g/mol
- Point de fusion : 175°C (décomp.),
- Teneur théorique en chlore : 92,8%
- Il est utilisé comme agent stérilisant, limité par sa faible solubilité dans l’eau.
Les dérivés d’acides aminés N-chlorés sont à l’étude pour leur potentiel en tant qu’agents de blanchiment et bactéricides.
6. Toxicologie des N-chloroamines
Les N-chloroamines sont largement utilisées dans l’eau potable, les piscines et la transformation des aliments, ce qui nécessite un examen attentif de leurs effets toxicologiques potentiels.
Lorsqu’il est utilisé dans des eaux riches en matières organiques, une vigilance particulière est requise pour éviter la formation d’halométhanes faiblement cancérigènes. Leur présence est souvent quantifiée par des méthodes d’espace de tête, de piège de purge ou d’extraction par solvant, suivies d’une analyse GC avec des détecteurs à capture d’électrons, ou GC-MS.
La plupart des N-chloroamines présentent des effets irritants locaux sur les yeux, la peau humide et les voies respiratoires supérieures. Les solutions diluées (jusqu’à 100 ppm de chlore disponible) d’acides N-chloroisocyanuriques ne posent généralement pas de problèmes de toxicité, d’irritation ou de sensibilisation.
Cependant, l’ingestion de solides purs ou de suspensions concentrées peut endommager la muqueuse de l’estomac. De plus, l’acide isocyanurique, formé lors de l’hydrolyse, possède une faible toxicité inhérente. Un résumé des valeurs de toxicité aiguë pour certaines N-chloroamines est fourni dans le Tableau 3.
| Composé | DL50 (mg/kg, rat, orale) |
|---|---|
| TCC | 1300 |
| DCC-Na | 1420 |
| 1,3-Dichloro-5,5-diméthylhydantoïne | 542 |
| N-Chlorosuccinimide | 2 700 |
- Chloramine-T : bien qu’irritant pour la peau, ce composé présente une toxicité importante lors de son absorption dans la circulation sanguine, nécessitant son utilisation uniquement dans des solutions diluées.
- Monochloroamine : Bien qu’elle présente un risque moindre de formation d’halométhane, son utilisation généralisée dans la désinfection de l’eau potable soulève des inquiétudes en raison de sa toxicité mutagène et aquatique potentielle. L’Environmental Protection Agency des États-Unis a même proposé d’interdire son utilisation dans l’eau potable.
Des études suggèrent que la 1-bromo-3-chloro-5,5-diméthylhydantoïne présente une toxicité plus faible envers certaines espèces de poissons que la 1,3-dichloro-5,5-diméthylhydantoïne.
Référence
- Chloroamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_553
