Butyrolactone : propriétés, production et utilisations
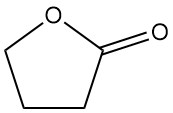
La γ-Butyrolactone (CAS 96-48-0), également connue sous le nom de lactone d’acide γ-hydroxybutyrique, est un composé organique simple de formule C4H6O2. C’est un liquide hygroscopique et incolore avec une légère odeur qui peut paraître banale à première vue.
Sa production industrielle a débuté dans les années 1940 grâce aux travaux de Reppe et de ses collègues de BASF. Le procédé Reppe reste la méthode dominante pour la synthèse de la γ-butyrolactone à grande échelle.
Table des matières
1. Propriétés physiques de la butyrolactone
La γ-Butyrolactone existe sous la forme d’un liquide incolore légèrement hygroscopique avec une légère odeur. Il est miscible avec l’eau, les alcools, les esters, les éthers, les cétones et les hydrocarbures aromatiques. Bien qu’il ait une miscibilité limitée avec les hydrocarbures aliphatiques linéaires et cycliques, il est utilisé comme solvant pour de nombreux polymères et hydrocarbures inférieurs.
Certaines propriétés physiques de la γ-butyrolactone sont répertoriées dans le tableau ci-dessous :
| Propriété | Valeur |
|---|---|
| Masse molaire | 86,09 g/mol |
| Point de fusion | -43,5°C |
| Point d'ébullition | 204-206°C (à 101,3 kPa) |
| Densité (0°C) | 1,15 g/cm³ |
| Densité (20°C) | 1,13 g/cm³ |
| Densité (40°C) | 1,11 g/cm³ |
| Température critique | 436,5°C |
| Pression critique | 3,35 MPa |
| Pression de vapeur (20°C) | 0,04 kPa |
| Pression de vapeur (50°C) | 0,3 kPa |
| Pression de vapeur (100°C) | 3,6 kPa |
| Pression de vapeur (150°C) | 22,5 kPa |
| Pression de vapeur (205°C) | 101,3 kPa |
| Chaleur de vaporisation (206°C) | 535 kJ/kg |
| Chaleur de la solution dans l'eau | 2 500 J/mol |
| Capacité thermique spécifique (cp) - Liquide (25°C) | 1680 J kg⁻¹ K⁻¹ |
| Capacité thermique spécifique (cp) - Liquide (100°C) | 1 850 J kg⁻¹ K⁻¹ |
| Capacité thermique spécifique (cp) - Liquide (200°C) | 2 200 J kg⁻¹ K⁻¹ |
| Capacité thermique spécifique (cp) - Gaz (100 °C) | 1275 J kg⁻¹ K⁻¹ |
| Capacité thermique spécifique (cp) - Gaz (200 °C) | 1575 J kg⁻¹ K⁻¹ |
| Capacité thermique spécifique (cp) - Gaz (300 °C) | 1 820 J kg⁻¹ K⁻¹ |
| Point éclair | 100-101°C |
| Température d'inflammation | 455°C |
| Chaleur de combustion | 234 kJ/g |
| Limites d'explosion - Inférieures | 2,7 % en volume |
| Limites d'explosion - Supérieures | 15,6 % en volume |
| Indice de réfraction (20°C) | 1.4352 |
| Viscosité (20°C) | 1,90 mPa·s |
| Viscosité (50°C) | 1,25 mPa·s |
| Viscosité (80°C) | 0,86 mPa·s |
| Viscosité (110°C) | 0,63 mPa·s |
| Viscosité (140°C) | 0,49 mPa·s |
| Viscosité (170°C) | 0,40 mPa·s |
| Tension superficielle (20°C) | 44,6 x 10⁻⁵ N/cm |
| Constante diélectrique (20°C) | 39.1 |
| Conductivité thermique (25-65°C) | 0,276 J m⁻¹ s⁻¹ K⁻¹ |
| Conductivité | 0,7 μS/cm |
2. Propriétés chimiques de la butyrolactone
Dans une solution aqueuse, l’isomérisation entre la forme lactone et la forme acide hydroxybutyrique libre est un équilibre dépendant de la température. À 0 °C, la forme lactone prédomine complètement, tandis qu’à 100 °C, environ 80 % existent sous forme de lactone.
Des conditions fortement alcalines (un équivalent molaire d’alcali) déplacent entièrement l’équilibre vers la forme acide hydroxybutyrique. Cette propriété permet le dosage titrimétrique de la butyrolactone. A pH neutre (7), la butyrolactone est très stable.
La butyrolactone subit des réactions de clivage cyclique avec divers réactifs, donnant des dérivés de l’acide γ-hydroxybutyrique. Les exemples incluent les réactions avec des bases, des halogénures d’hydrogène et des alcools (dans des conditions acides).
Il subit également des réactions en position α sans clivage de cycle. Celles-ci incluent des réactions avec l’ammoniac, les amines, les composés carbonylés et l’halogénation. Par exemple, sa condensation avec l’acétate d’éthyle forme l’α-acétobutyrolactone, un intermédiaire important dans la synthèse de la vitamine B1.
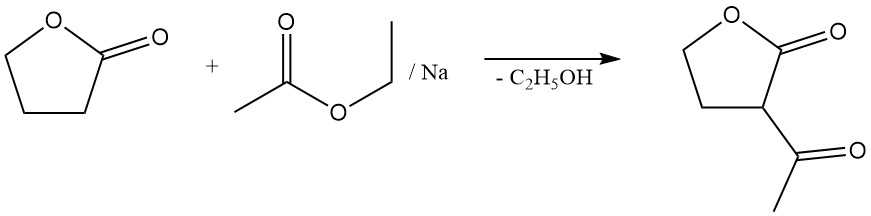
La réaction de clivage du cycle lactone permet la préparation de précieux dérivés d’acide butyrique γ-substitués. Par exemple, la réaction avec le sulfure de sodium donne l’additif pour caoutchouc acide thiodibutyrique,
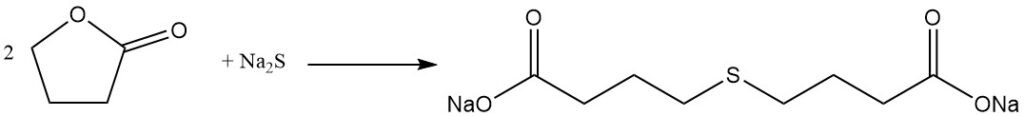
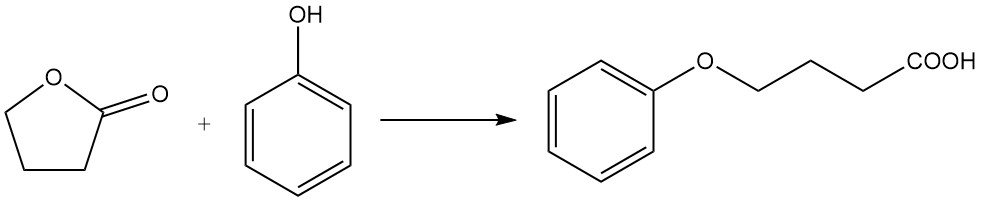
tandis que la réaction avec le phénol produit de l’acide phénoxybutyrique.
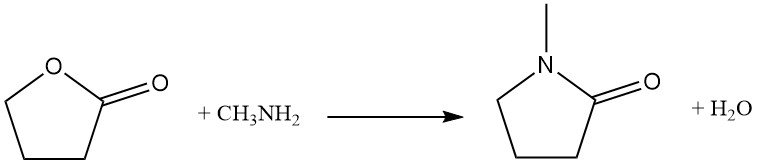
Le remplacement de l’atome d’oxygène du cycle par de l’azote est une réaction industrielle utilisée pour la synthèse de dérivés de la pyrrolidone. À titre d’exemple, la butyrolactone réagit avec la méthylamine pour produire de la N-méthylpyrrolidone (NMP), un solvant industriel clé.
L’homopolymérisation directe de la butyrolactone nécessite une pression élevée (2 000 MPa), mais des voies alternatives, telles que la fermentation des sucres, peuvent donner un produit similaire.
3. Production de butyrolactone
3.1. Production de butyrolactone par déshydrogénation du 1,4-butanediol
Le procédé Reppe est la voie industrielle prédominante pour la synthèse de la butyrolactone, réalisée par la déshydrogénation endothermique en phase gazeuse du 1,4-butanediol. Cette réaction en plusieurs étapes se déroule via des intermédiaires γ-hydroxybutyraldéhyde et 2-hydroxytétrahydrofurane.

Les principaux fabricants employant ce processus comprennent BASF, Ashland et Lyondell.
La vapeur de 1,4-butanediol préchauffée est combinée avec un flux d’hydrogène chaud en circulation et passée sur un lit de catalyseur en cuivre à pression atmosphérique et à des températures allant de 180 à 300°C (Figure 1). Cette réaction fournit un rendement élevé d’environ 95 % de butyrolactone.
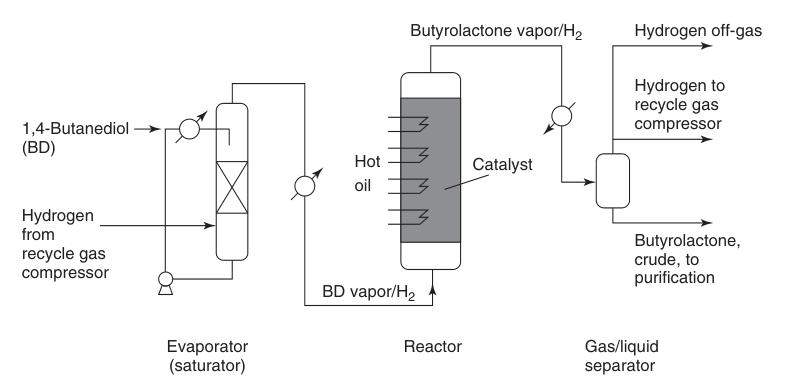
Le sous-produit d’hydrogène généré nécessite une purification minimale pour une réutilisation potentielle, impliquant généralement une méthanisation catalytique pour éliminer les impuretés de monoxyde de carbone.
La butyrolactone brute qui est séparée du flux de gaz recyclé contient des impuretés mineures comme le 1,4-butanediol n’ayant pas réagi, l’acide butyrique et des composés à point d’ébullition élevé. Ceux-ci sont éliminés par distillation pour obtenir de la butyrolactone pure.
La butyrolactone elle-même est non corrosive et compatible avec les équipements en acier au carbone. Cependant, les composants exposés à un produit brut chaud contenant de l’acide butyrique, tels que des parties des cuves de synthèse ou de distillation et des canalisations, nécessitent l’utilisation d’acier inoxydable pour une durabilité accrue.
3.2. Production de butyrolactone par hydrogénation d’anhydride maléique
Une voie alternative à la butyrolactone implique l’hydrogénation catalytique de l’anhydride maléique. Dans ce processus, de l’anhydride maléique fondu préchauffé est introduit dans un flux d’hydrogène en circulation sous pression (6-12 MPa) et température (160-280°C). Un catalyseur à base de nickel favorise la réaction, qui se déroule de manière exothermique avec un ΔH de -211 kJ/mol :
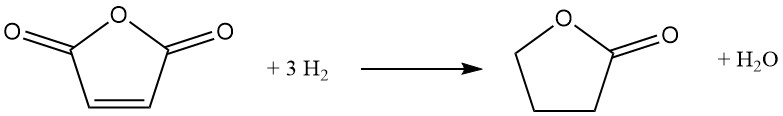
La voie réactionnelle implique un anhydride succinique intermédiaire et, selon les conditions choisies, peut être davantage orientée vers la production de tétrahydrofuranne. L’hydrogénation complète de l’anhydride succinique conduit cependant inévitablement à la co-formation de tétrahydrofuranne.
L’excès d’hydrogène est recyclé après lavage à l’eau pour éliminer les impuretés. Les sous-produits formés lors de la synthèse de la butyrolactone, notamment le propanol, le butanol, l’acide propionique et l’acide butyrique, sont séparés du flux gazeux en circulation. Une distillation ultérieure purifie le flux de butyrolactone.
En raison de la présence de sous-produits acides, les équipements de synthèse et de distillation nécessitent une construction en acier inoxydable. Mitsubishi Chemical Corporation est un fabricant qui utilise cette méthode.
3.3. Production de butyrolactone par hydrogénation d’esters maléiques
Apparus dans les années 1980, plusieurs procédés utilisant le maléate de diméthyle comme intermédiaire offrent des voies alternatives au 1,4-butanediol et au tétrahydrofurane (THF). Ces méthodes présentent également la possibilité d’isoler la butyrolactone, un intermédiaire dans la séquence réactionnelle.
Un procédé notable, développé par Kvaerner Process Technology (maintenant Johnson Matthey Davy Technologies), utilise le maléate de diméthyle comme produit initial obtenu à partir d’anhydride maléique et de méthanol à l’aide d’un catalyseur échangeur d’ions acide fort.
L’hydrogénation ultérieure en phase gazeuse sur un système catalytique à base de cuivre, sous des pressions de 2 à 8 MPa et des températures de 150 à 250 °C, donne un mélange de produits souhaités : 1,4-butanediol, THF, butyrolactone, des traces de diméthyle. le succinate (intermédiaire) et le n-butanol comme sous-produit majeur.
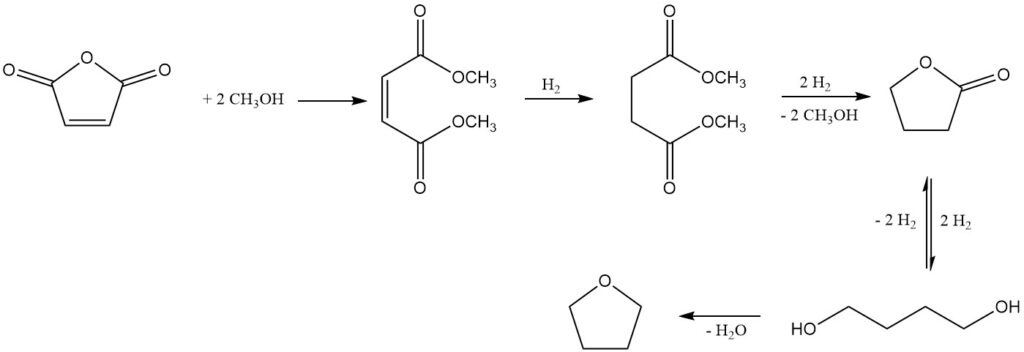
La butyrolactone et le succinate de diméthyle forment un mélange azéotropique, permettant leur récupération et leur recyclage vers l’étape d’hydrogénation. Cette stratégie de recyclage favorise une conversion complète vers le 1,4-butanediol et le THF. Alternativement, l’azéotrope peut être raffiné par distillation pour isoler la butyrolactone pure.
Le rendement en butyrolactone est directement influencé par la pression et la température de fonctionnement lors de l’hydrogénation, qui dictent l’équilibre entre le 1,4-butanediol et la butyrolactone. Dans les conditions rapportées, les rendements peuvent varier de 5 % à 50 %.
Ce procédé innovant a suscité un intérêt commercial considérable, KPT et JM Davy ayant obtenu des licences pour la construction de plusieurs usines de butanediol-butyrolactone-THF en Arabie saoudite, en Malaisie, en Corée et en Chine.
3.4. Production de butyrolactone par procédé biosourcé
Metabolix (maintenant Yield10 Bioscience, Inc.) a développé un processus de fermentation pour produire du poly(4-hydroxybutyrate) (polybutyrolactone) à partir de sucres.
Ce polymère peut être dépolymérisé en butyrolactone à des températures supérieures à 200 °C, l’hydroxyde de calcium obtenant des résultats optimaux. La biomasse restante est convertie en combustible solide. En 2019, aucune usine commerciale utilisant cette méthode n’existe.
BioAmber a proposé une voie biologique où les sucres sont fermentés en sel diammonique d’acide succinique. L’élimination ultérieure de l’ammoniac produit de l’acide succinique, qui peut être hydrogéné en présence d’un catalyseur de métal précieux pour produire de la butyrolactone, aux côtés du 1,4-butanediol et du tétrahydrofuranne. Ce procédé n’a pas encore atteint une application commerciale.
Bien que cela ne soit pas significatif sur le plan commercial, la recherche a exploré diverses voies alternatives pour la synthèse de la butyrolactone à partir du tétrahydrofurane, du dihydrofurane, de l’acétylène, du butynediol, des oléfines, du butadiène ou par carbonylation.
4. Utilisations de la butyrolactone
La polyvalence de la butyrolactone s’étend bien au-delà de son rôle de simple intermédiaire chimique. Ses applications couvrent divers domaines, des formulations pharmaceutiques à la science des polymères et même aux technologies émergentes en électronique.
La butyrolactone sert d’élément de base crucial pour divers produits chimiques, notamment la N-méthylpyrrolidone (NMP) et la pyrrolidone, toutes deux ayant leurs propres utilisations importantes. Il est également utilisé dans la synthèse d’herbicides phénoxy comme le MCPB (acide γ-2-méthyl-4-chlorophénoxybutyrique) et de régulateurs de croissance.
C’est un intermédiaire dans la production d’α-acétobutyrolactone, étape vitale dans la synthèse de la vitamine B1. La butyrolactone est également utilisée pour la production d’acide thiodibutyrique, un additif précieux dans la fabrication du caoutchouc.
C’est un solvant capable de dissoudre divers polymères, facilitant ainsi leur traitement et leur manipulation. De plus, c’est un catalyseur précieux pour des réactions de polymérisation spécifiques.
La butyrolactone contribue à la formulation de compositions pour ondulations capillaires, de lotions solaires, d’autres produits de soins personnels et de produits pharmaceutiques.
D’autres applications de la butyrolactone comprennent : comme solvant dans l’encre d’impression à jet d’encre, comme extractant dans l’industrie pétrolière, comme stabilisant pour les chlorohydrocarbures et les pesticides à base de phosphore et comme nématocide.
Ses propriétés uniques en font un co-solvant prometteur pour les électrolytes de condensateurs dans l’industrie électronique et pourrait être utilisé dans les photorésists.
5. Toxicologie et santé au travail
Absorption et métabolisme :
- La butyrolactone est facilement absorbée par l’intestin et la peau. Sa demi-vie orale chez le rat est d’environ 20 minutes.
- Le métabolisme et l’excrétion sont rapides, produisant principalement de l’acide γ-hydroxybutyrique comme principal métabolite.
- Chez l’homme, des études rapportent du (S)-3,4-dihydroxybutyrate, acide glycolique et autres métabolites présents dans l’urine après ingestion.
Toxicité aiguë :
- La butyrolactone présente une faible toxicité aiguë, avec des valeurs DL50 comprises entre 800 et 1 800 mg/kg chez les rongeurs et entre 500 et 1 700 mg/kg chez les cobayes.
- La DL50 cutanée chez le cobaye est de 5 600 mg/kg.
- La CL50 par inhalation (rat, 4 h) dépasse la concentration non létale la plus élevée testée (> 5,1 mg/L).
- L’inhalation à température ambiante saturée ne montre aucun effet indésirable chez le rat [BASF, (1960) résultats non publiés].
Effets neurologiques :
- La dépression du système nerveux central (SNC) causée par la butyrolactone se produit par l’intermédiaire de son métabolite, l’acide γ-hydroxybutyrique, avec des effets anesthésiques supplémentaires sur le système nerveux périphérique.
- Des doses de 2 500 mg chez des humains adultes ont induit un sommeil temporaire.
- Des doses de 66 mg/kg chez les enfants pour l’anesthésie ont entraîné un sommeil profond avec une dépression respiratoire occasionnelle.
- Des doses orales accidentelles plus élevées chez les adultes et les nourrissons ont provoqué une perte de conscience induite par une dépression du SNC, parfois un coma, une bradycardie et une dépression respiratoire. Les patients se sont complètement rétablis en 24 heures grâce à des soins de soutien.
Effets locaux et cutanés :
- La butyrolactone n’est pas irritante pour la peau mais modérément irritante pour les yeux chez le lapin [BASF, (1960) résultats non publiés].
- Aucune sensibilisation cutanée observée chez les cobayes.
- Les tests cutanés effectués sur 200 volontaires n’ont révélé aucune réaction cutanée.
- Les lotions contenant de la butyrolactone sont bien tolérées pour une application topique.
- Il a servi d’analgésique topique efficace contre les douleurs musculo-squelettiques, les maux de tête et les migraines.
Études de toxicité chronique et de cancérogénicité :
- Une administration orale prolongée à raison de 3 g/kg par jour pendant quatre semaines a entraîné une dépression du SNC chez les rats, mais aucun autre effet significatif.
- Des études à doses répétées ont montré une toxicité légèrement supérieure à celle du gavage, avec des effets possibles en bolus.
- De nombreuses études de mutagénicité et de génotoxicité n’indiquent aucun potentiel génotoxique.
- Des études de cancérogénicité à long terme chez des rats et des souris à des doses élevées n’ont trouvé aucune preuve de potentiel tumorigène.
- Les premières études cutanées et orales n’ont pas non plus montré d’effets cancérigènes.
- Dans l’ensemble, les preuves suggèrent qu’il n’y a aucun risque cancérogène significatif associé à la butyrolactone.
Effets sur le développement et la reproduction :
- L’exposition prénatale chez le rat et le lapin par voie orale et par inhalation n’a montré aucun effet sur le développement lié à la substance (BASF AG, (1993) résultats non publiés).
Exposition professionnelle :
- Des limites d’exposition professionnelle spécifiques à la butyrolactone ne sont pas établies en Europe ou aux États-Unis.
Impact environnemental :
- Les données sur la toxicité aiguë et la biodégradabilité rapide suggèrent un risque environnemental minime.
Référence
- Butyrolactone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_495.pub2
