Brome: production, réactions et utilisations

Table des matières
Le brome est un liquide dense, rouge foncé, fumant, hautement corrosif et lacrymogène. Sa forte odeur piquante est détectable à 1 ppm en volume dans l’air.
La couleur du brome varie avec la température (jaune orangé à 20 K, rouge orangé, brun rouge, jusqu’à presque noir à son point de fusion). Le brome liquide est toujours rouge foncé, tandis que les vapeurs de brome sont généralement orange à brun rouge.
Le brome a été découvert pour la première fois par A. J. BALARD en 1824. Il avait isolé l’élément en étudiant la flore d’un marais salé près de Montpellier, en France.
Il remarqua un dépôt de sulfate de sodium qui s’était cristallisé dans une casserole contenant une liqueur mère de gros sel. En étudiant les utilisations des liqueurs résiduelles, BALARD a observé qu’après saturation en chlore, le nouveau liquide rouge pouvait être obtenu par distillation.
1. Réactions chimiques du brome
De nombreuses réactions chimiques du brome résultent de ses fortes propriétés oxydantes. La tendance du brome à gagner un seul électron se situe comme prévu entre le chlore et l’iode, comme la plupart des autres propriétés chimiques.
Le brome n’est qu’un agent oxydant modérément puissant. Conformément à sa position dans la série électromotrice, le chlore oxyde l’ion bromure en brome élémentaire.
Le brome subit une réduction en bromure dans l’eau. L’agent réducteur peut être soit l’eau elle-même, soit le brome restant. Dans le premier cas, l’oxygène se forme :
2 Br2 + 2 H2O → 4 H+ + 4 Br– + O2 E0298 = +0,25 V
Le brome réagit avec le cyanure d’hydrogène pour produire du bromure de cyanogène :
Br2 + HCN → BrCN + HBr
Les carbonates réagissent avec le brome, formant des sels de bromure et de bromate :
3 Br2 + 3 Na2CO3 → 5 NaBr + NaBrO3 + 3 CO2
Le dioxyde de soufre est oxydé en acide sulfurique par le brome :
Br2 + SO2 + 2 H2O → 2HBr + H2SO4
On sait également que le brome réagit avec le phosphore rouge et d’autres composés du phosphore selon les réactions suivantes :
3 Br2 + 2 P + 6 H2O → 6 HBr + 2 H3PO3
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
H3PO3 + Br2 + NaOH → NaH2PO4
Les composés contenant de l’azote, par exemple l’ammoniac, l’hydrazine, les nitrites et les azotures subissent également une oxydation par le brome, l’azote élémentaire étant le produit fréquent de ces réactions.
Le brome réagit directement avec l’hydrogène (H2) à des températures plus élevées pour former du bromure d’hydrogène, une réaction qui est à la base de la production commerciale de HBr. Les catalyseurs de cette réaction comprennent du charbon de bois chauffé et du platine métallique finement divisé.
Le brome réagit également avec de nombreux métaux pour former des bromures. Le sodium est stable dans le brome sec, mais la vapeur de sodium réagit vigoureusement. Le potassium et le césium réagissent violemment avec le brome.
Le brome est également très réactif avec l’aluminium et le titane. L’aluminium réagit avec l’émission de lumière. Le magnésium, l’argent, le nickel et le plomb sont recouverts de leur bromure, ce qui empêche toute réaction ultérieure.
Ce revêtement protecteur fait du plomb un matériau utile pour les récipients contenant du brome. D’autres métaux non ferreux utiles pour la manipulation du brome sont le nickel, le tantale, l’Hastelloy C, le monel et certains autres alliages de cuivre.
L’humidité est importante dans la corrosion des métaux par le brome. Ceci est probablement dû aux produits d’hydrolyse, acides bromhydrique et hypobromeux. À des teneurs en humidité inférieures à 40 ppm, des conteneurs en nickel peuvent être utilisés pour le transport du brome.
Le mercure est attaqué par le brome et ne doit pas être utilisé dans les instruments et jauges exposés à la vapeur de brome. Le brome sec réagit lentement avec le fer pour former une couche protectrice de bromure ferrique ; mais lorsqu’il est mouillé, il se forme un mélange de bromures de fer hydratés qui n’adhère pas à la surface du fer.
D’autres métaux lourds, tels que le cuivre, le manganèse, le chrome, l’antimoine, le cobalt, le cadmium et le bismuth, réagissent avec le brome, bien que certains métaux nécessitent une température plus élevée.
1.1. Addition de brome aux alcènes et alcynes
Le brome s’ajoute facilement aux composés insaturés. De telles réactions sont généralement conduites à basse température pour éviter les réactions secondaires de substitution. Bien qu’un catalyseur ne soit généralement pas nécessaire, un rayonnement ultraviolet ou une température élevée peuvent être utilisés pour accélérer la réaction.
Parmi les produits commerciaux les plus importants de l’addition de brome aux composés insaturés figurent le bromure d’éthylène, le tétrabromure d’acétylène, le 2,3-dibromopropanol, l’hexabromocyclodécane et le tétrabromobisphénol A bis (2,3-dibromopropyléther).
1.2. Bromation des composés aromatiques
Les composés aromatiques peuvent subir trois types de réactions avec le brome : (1) addition, (2) substitution sur les chaînes latérales et (3) substitution sur le cycle aromatique.
L’addition catalysée par la lumière de brome à travers les doubles liaisons aromatiques est généralement une réaction lente, mais l’utilisation de chlore augmente la vitesse. La bromation des chaînes latérales aromatiques est normalement un processus radicalaire.
La substitution électrophile sur le cycle aromatique est de loin le type le plus important de bromation aromatique. En présence d’un catalyseur, le brome réagit avec les composés aromatiques pour donner des bromures d’aryle et du bromure d’hydrogène :
ArH + Br2 → ArBr + HBr
Les catalyseurs appropriés pour les bromations aromatiques sont les acides de Lewis, tels que les halogénures d’aluminium, de fer, de zinc ou d’antimoine. Les composés aromatiques activés, tels que le phénol, l’aniline et les éthers aromatiques, peuvent être bromés sans catalyseur.
En revanche, les composés aromatiques très fortement désactivés contenant des groupes attirant les électrons subissent une bromation en présence d’acide sulfurique en combinaison avec de l’acide nitrique.
Le brome in situ généré à partir de bromure d’hydrogène est utilisé plus efficacement en substitution aromatique :
ArH + HBr + Cl2 → ArBr + 2 HCl
Le chlorure de brome préformé peut également être utilisé dans le même but. Les réactions de substitution impliquant BrCl sont beaucoup plus rapides que celles utilisant le brome seul.
1.3. Bromation radicalaire
La bromation des hydrocarbures saturés et des chaînes latérales alkyle des composés aromatiques se produit par une réaction radicalaire en chaîne :
Br2 → 2 Br•
RH + Br• → R• + HBr
R• + Br2 → RBr + Br•
La dissociation des molécules de brome est nécessaire pour initier cette réaction. Le brome peut être dissocié thermiquement, photolytiquement, par rayonnement gamma ou en utilisant des initiateurs peroxydes.
Comparé au chlore, l’atome de brome est moins réactif et l’étape d’extraction de l’hydrogène est endothermique. En conséquence, les vitesses de réaction sont relativement lentes et l’atome de brome présente une sélectivité de position élevée.
Par exemple, dans la bromation du n-butane, les atomes d’hydrogène secondaires sont remplacés 82 fois plus rapidement que les atomes primaires. La bromation des chaînes latérales aromatiques est une réaction beaucoup plus rapide que la bromation des alcanes.
1.4. Production de bromure d’hydrogène
Le bromure d’hydrogène est un intermédiaire important dans la production de divers bromures organiques et inorganiques. Les intermédiaires trouvent des applications dans la production de médicaments, de colorants, de parfums, de produits chimiques photographiques et de nombreux autres produits chimiques.
Le bromure d’hydrogène est préparé commercialement par la réaction directe en phase gazeuse de l’hydrogène et du brome :
Br2 + H2 → 2 HBr + Chaleur
La réaction peut être conduite sans catalyseur en maintenant une flamme auto-entretenue dans un brûleur fermé.
Le bromure d’hydrogène peut être préparé en laboratoire en distillant une solution de bromure de sodium ou de potassium avec de l’acide phosphorique ou de l’acide sulfurique dilué (5,8 M). Pour le bromure de sodium comme matière première.
L’utilisation d’acide sulfurique plus concentré ou le fait de laisser la température de la solution de réaction dépasser 75 °C n’est pas efficace car le HBr initialement formé sera oxydé en brome gazeux (Br2).
Une autre méthode de préparation de HBr en laboratoire est basée sur la réduction du brome avec de l’acide phosphoreux :
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
1.5. Bromation à l’aide de transporteurs de brome
Les complexes de brome et les bromoimides sont utiles pour les bromations où la sélectivité est d’une importance primordiale. Le support de brome qui a été le plus utilisé dans les bromations de laboratoire est le N-bromosuccinimide (NBS).
Une application unique du NBS est dans les bromations allyliques radicalaires :

D’autres supports de brome utiles sont la dibromodiméthylhydantoïne, le dibromure de dioxane, le dibromure de bromhydrate de pyridine et divers polybromures d’ammonium quaternaire.
2. Production de brome
La production de brome utilise des liqueurs contenant du brome (saumures), qui se produisent naturellement ou résultent de la fabrication de sels de potassium ou d’eau de mer.
Dans la plupart des saumures, ainsi que dans l’eau des océans, la concentration molaire des ions chlorure est probablement de 200 à 700 fois supérieure à celle des ions bromure. Par conséquent, isoler le brome de ces sources nécessite une méthode de séparation de haute sélectivité.
Heureusement, une telle méthode existe. Il est basé sur la plus grande facilité avec laquelle le bromure peut être oxydé par rapport au chlorure, et sur le fait que le produit d’oxydation, le brome, est assez volatil.
Le chlore est l’oxydant le plus économique et le plus pratique.
Il y a 4 étapes principales dans la production de brome :
- Oxydation du bromure en brome
- Extraction du brome de la solution aqueuse
- Séparation du brome de la vapeur
- Purification du brome
Deux procédés généraux utilisant la chloration pour la récupération du brome sont basés sur la réaction chimique suivante :
2 Br– + Cl2 → Br2 + 2 Cl–
- Procédé d’évaporation pour les saumures et les liqueurs résiduaires contenant du brome. La vapeur est utilisée lorsque la concentration de bromure dans la saumure est supérieure à 1000 ppm. L’avantage de ce procédé est que le brome peut être condensé directement à partir de la vapeur.
- Processus de soufflage pour l’eau de mer. L’air est utilisé lorsque l’eau de mer est la source de brome car de très grands volumes de gaz d’extraction sont nécessaires et la vapeur serait trop coûteuse. Lorsque l’air est utilisé, il est nécessaire de piéger le brome dans une solution alcaline ou réductrice pour le concentrer.
2.1. Processus d’évaporation des saumures
La production de brome à partir de saumures contenant du Br- à des concentrations de 1 à 5 g/L suit essentiellement le processus décrit par KUBIERSCHKY en 1906.
La saumure brute est réchauffée dans un échangeur de chaleur (a) et amenée à traverser successivement deux tours à garnissage (b), (c) par écoulement gravitaire (figure 1). Dans la tour supérieure (plus petite), il rencontre un flux de gaz de recyclage à partir duquel le chlore et le brome sont absorbés.
Près du fond de la tour inférieure (c), du chlore et de la vapeur sont introduits ; au fur et à mesure qu’ils montent, le chlore réagit avec le bromure dans la saumure et un mélange de vapeur de brome et de chlore (environ 85: 15 en poids) avec de la vapeur est prélevé par le haut.
L’eau et la plupart des halogènes sont condensés (d), les phases liquides entrent dans un séparateur gravitaire (e) et le gaz va vers la tour supérieure. Depuis le séparateur, l’eau contenant des halogènes dissous est envoyée vers la tour inférieure (d’évaporation) et la couche de brome plus lourde, contenant un peu de chlore, s’écoule vers une colonne de fractionnement (g).
Les vapeurs de chlore rejoignent le flux vers la tour supérieure tandis que le brome liquide, pur à environ 99%, est soutiré soit pour être utilisé directement dans la fabrication de composés bromés, soit pour être purifié davantage pour la vente ou pour des utilisations plus exigeantes.
La saumure chaude débromée est traitée pour neutraliser l’acidité (h) et pour réduire les halogènes libres, si nécessaire, puis passe à travers l’échangeur de chaleur, où elle réchauffe la saumure entrante.
Les modifications plus récentes du procédé Kubierschky original sont généralement liées à la plus grande échelle des opérations modernes, aux matériaux de construction, qui doivent être résistants à la corrosion, et aux procédures et instruments nécessaires au contrôle.
Les processus sont contrôlés en mesurant le pH, les potentiels d’oxydoréduction, les débits, les températures et les pressions aux points critiques.
Une certaine acidité est générée lorsque le chlore réagit avec des substances réductrices, telles que le sulfure d’hydrogène, dans la saumure. Cette acidité ajoute à l’efficacité de la libération du brome en empêchant l’hydrolyse en acide hypobromeux.
L’utilisation d’acide sulfurique n’est pas recommandée si la saumure contient du calcium ou du strontium car ils peuvent précipiter sous forme de sulfates et encrasser le garnissage de la tour, les surfaces d’échange de chaleur ou les puits d’élimination de la saumure. Cependant, des sulfates se formeront si la saumure contient des sulfures.
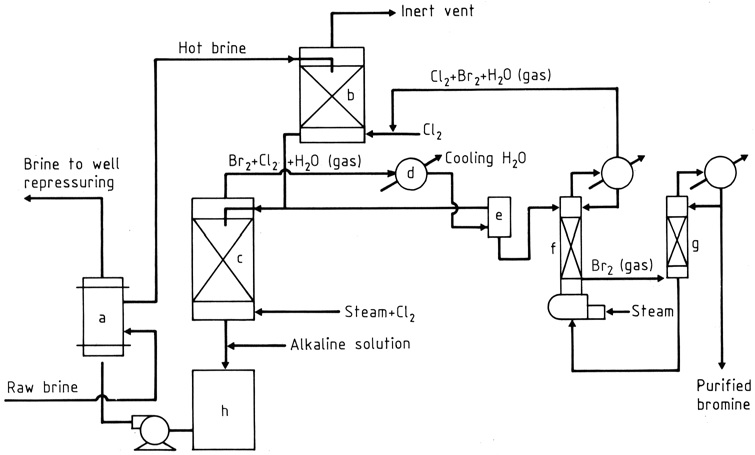
a) Échangeur de chaleur croisé pour brome ; b) Absorbeur de chlore ; c) tour d’évaporation ; d) Condenseur ; e) Séparateur ; f) Colonne de stripage ; g) colonne de fractionnement ; h) Neutralisant
2.2. Processus d’eau de mer
La première récupération économiquement réussie de brome directement de la mer a été réalisée près de Wilmington, en Caroline du Nord (États-Unis), en utilisant un procédé de soufflage d’air développé à l’origine pour les opérations de saumure par HH DOW.
L’utilisation d’air plutôt que de vapeur est nécessaire car le coût de la vapeur pour chauffer l’eau de mer, avec sa teneur en brome d’environ 65 mg/L seulement, serait prohibitif. L’usine de Wilmington a depuis été abandonnée.
L’eau de l’océan est pompée au sommet de tours de soufflage, de l’acide sulfurique et du chlore étant ajoutés juste au-dessus des pompes afin que le mélange ait lieu pendant l’ascension.
Il faut environ 1,3 kg d’acide sulfurique à 10 % par tonne d’eau pour neutraliser les hydrogénocarbonates naturels et amener le pH à 3,5 ; 15 % de chlore en excès par rapport aux besoins théoriques sont utilisés.
L’air est aspiré à travers les tours, balayant un mélange de brome et de chlore (ou chlorure de brome) de l’eau océanique descendante. L’air est ensuite aspiré à travers des tours d’absorption dans lesquelles il est lavé à contre-courant par une solution de carbonate de sodium.
Les différentes réactions qui ont lieu peuvent être résumées approximativement par l’équation :
3 Na2CO3 + 2 Br2 + BrCl → NaBrO3 + 4 NaBr + NaCl + 3 CO2
Pour éliminer les embruns de l’air, de petites chambres garnies sont interposées entre les tours d’absorption et les ventilateurs. Lorsque l’alcalinité de la solution de lavage est presque épuisée, la solution est d’abord amenée dans un réservoir de stockage, puis dans un réacteur dans lequel elle est traitée avec de l’acide sulfurique et évaporée pour libérer du brome :
NaBrO3 + 5 NaBr + 3 H2SO4 → 3 Br2 + 3 Na2SO4 + 3 H2O
D’autres procédés sont utilisés parmi lesquels :
- L’électrolyse a été utilisée au début de la production en Allemagne au lieu du chlore pour oxyder les bromures.
- Aux États-Unis, un procédé Kubierschky modifié a été utilisé pour récupérer le brome en tant que sous-produit des liqueurs de production de chlorure de potassium.
3. Utilisations du brome
Les principales utilisations du brome en termes de consommation sont les retardateurs de flamme, les fluides de forage, la synthèse organique, les produits pharmaceutiques, les biocides pour le traitement de l’eau et l’agriculture.
Le brome est également utilisé dans la fabrication de teintures, d’insectifuges, de parfums et de matériel photographique. D’autres composés de brome trouvent des utilisations dans d’autres applications, notamment le contrôle du mercure et la fabrication de papier.
Les retardateurs de flamme bromés constituent la partie la plus volumineuse et la plus importante des dérivés du brome. La consommation de brome dans les retardateurs de flamme a considérablement augmenté depuis le début des années 1990 et en 2013
formé plus de la moitié de la consommation totale de brome.
Les retardateurs de flamme bromés sont utilisés dans les équipements industriels et domestiques tels que les ordinateurs, les meubles, les tableaux, les téléphones portables, les téléviseurs et les textiles.
Les caractéristiques de haute densité des composés de brome sont avantageusement appliquées dans les fluides hydrauliques, les fluides de jaugeage, la flottation du minerai et les fluides de forage. L’industrie du forage pétrolier et gazier utilise des bromures de calcium, de zinc et de sodium pour préparer des fluides de forage, de complétion, de packer et de reconditionnement à haute densité et à saumure claire.
Un groupe important et en expansion de biocides bromés est destiné au traitement de l’eau. Alors que le chlore contrôle la majorité des marchés du traitement de l’eau, les composés bromés deviennent de plus en plus populaires.
En général, les segments industriels et consommateurs de l’industrie du traitement de l’eau remplacent de plus en plus le chlore et les composés chlorés, tels que les désinfectants et les biocides, par des produits à base de brome.
Les biocides bromés sont plus performants que les biocides chlorés dans un certain nombre d’applications industrielles en raison de leur plus grande tolérance à une large gamme de niveaux de pH, une préoccupation dans les tours de refroidissement et les eaux de traitement.
L’utilisation de brome et de composés de brome pour atténuer les émissions de mercure dans les centrales électriques au charbon a été un marché en croissance pour les producteurs de brome. Les composés inorganiques du brome (bromure de calcium et bromure de sodium) se lient au mercure présent dans les gaz de combustion des centrales électriques au charbon, créant des composés de mercure qui sont capturés dans les épurateurs, éliminant ainsi jusqu’à 90 % du mercure libéré lors de la combustion.
Les références
- Bromine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_391.pub2
Bromine; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0218151310010311.a01.pub3
