Benzotrichlorure : Réactions, Production et Utilisations
Le benzotrichlorure est le produit résultant de la chloration poussée de la chaîne latérale du toluène aussi appelé (trichlorométhylbenzène, α,α,α-trichlorotoluène, phényl chloroforme).
La synthèse du benzotrichlorure a été initialement réalisée en 1858 par L. SCHISCHKOFF et A. ROSING, utilisant la réaction entre PCl5 et le chlorure de benzoyle.
Aujourd’hui, en raison de son rôle important en tant qu’intermédiaire important dans la synthèse des chlorures d’acide (en particulier le chlorure de benzoyle), des colorants, des herbicides, des pesticides et de divers autres produits, le benzotrichlorure est produit à grande échelle.
Table des matières
Propriétés physiques du benzotrichlorure
Benzotrichlorure, un liquide incolore possédant une odeur piquante et irritant pour les yeux et les muqueuses. Il génère des fumées lorsqu’il est exposé à l’air humide.
L’éthanol, l’éther diéthylique et le chloroforme sont de bons solvants pour le benzotrichlorure. Cependant, sa solubilité dans l’eau est limitée, avec seulement 0,05 g par litre à 5°C et 0,25 g par litre à 39°C. Notamment, l’hydrolyse se produit au cours du processus de dissolution dans l’eau.
La quantité de chlore pouvant être dissoute dans 100 grammes de benzotrichlorure dépend de la température. A 30°C, la solubilité est de 5,1 grammes, tandis qu’à 50°C, elle diminue à 3,4 grammes, et à 100°C, elle diminue encore à 1,3 grammes.
Les propriétés physiques du benzotrichlorure sont les suivantes :
- Masse molaire = 195,48 g/mol
- Point d’ébullition = 220,7 °C
- Point de fusion = -4,5 °C
- Densité = 1,373 à 20 °C
- Indice de réfraction = 1,558 à 20 °C
- Point d’éclair = 108 °C
- Température d’inflammation = 420 °C
Réactions chimiques du benzotrichlorure
L’acide benzoïque est produit par hydrolyse acide ou basique du benzotrichlorure, tandis que l’hydrolyse partielle produit du chlorure de benzoyle.
Lorsque le benzotrichlorure réagit avec des acides carboxyliques, il donne les chlorures d’acide correspondants ainsi que le chlorure de benzoyle.
La condensation du benzotrichlorure avec le benzène, en présence de catalyseurs tels que FeCl3, AlCl3 ou ZnCl2, conduit à la formation de diphényl- et triphénylméthane.
Le traitement du benzotrichlorure avec de l’acide fluorhydrique ou des fluorures permet le remplacement des trois atomes de chlore par du fluor.
En faisant réagir le benzotrichlorure avec des alcools anhydres, des ortho-esters d’acide benzoïque peuvent être préparés.
L’hydrolyse du benzotrichlorure peut être obtenue par réaction avec de l’eau.
Production du benzotrichlorure
Une méthode proche de la procédure employée pour le chlorure de benzyle peut être utilisée pour la chloration exhaustive de la chaîne latérale du toluène, facilitant la production de benzotrichlorure. La chloration photochimique, en particulier, est couramment employée à cette fin.
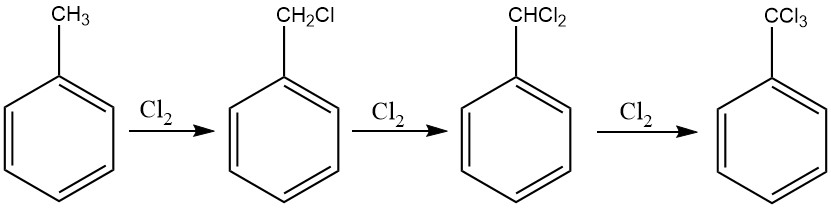
Dans les procédés continus, il convient de mettre en oeuvre une cascade de six à dix réacteurs pour éviter la formation de dérivés chlorés sur le cycle. Cette approche permet de contrôler l’alimentation en chlore, garantissant l’obtention de benzotrichlorure avec des quantités minimales de chlorure de benzal.
La figure 1 représente une installation fonctionnant en continu conçue pour la production de benzotrichlorure. Le toluène frais est dirigé à travers le pré-chlorateur (R0) et entre ensuite dans le premier réacteur de la cascade de huit réacteurs. Les réacteurs sont chargés avec des quantités décroissantes de chlore.
Typiquement, le dernier réacteur de la cascade est purgé avec de l’azote pur pour éliminer le chlore gazeux résiduel. Aux fins de l’élimination des gaz résiduaires (indiqués par des lignes pointillées), les réacteurs peuvent être classés en trois groupes.
Les réacteurs R1-R3 reçoivent un dosage précis du chlore, dont la majeure partie est consommée lors de la réaction. Les effluents gazeux des réacteurs R4-R8 contiennent une concentration plus élevée de chlore en raison de la chloration avancée du matériau dans ces réacteurs. Par conséquent, ce gaz est recyclé vers les réacteurs R1 et R2.
De même, les effluents gazeux des réacteurs R1-R4 sont introduits dans le pré-chlorateur (R0), qui contient la plus forte proportion de toluène, pour éliminer les éventuelles traces de chlore restantes. Les effluents gazeux du réacteur R0 sont ainsi dépourvus de chlore et sont dirigés vers le système de lavage pour éliminer HCl.
En contrôlant avec précision les apports de chlore et de toluène, cette technique permet d’obtenir une conversion presque complète du toluène en benzotrichlorure, générant des gaz résiduaires principalement composés de chlorure d’hydrogène et d’azote, sans chlore présent.

Pour améliorer le rendement et la vitesse de réaction, l’exclusion de l’oxygène est impérative et des quantités catalytiques de brome, de chlorure d’ammonium ou d’une combinaison de trichlorure de phosphore et de disulfure de bis (diméthylthiocarbamoyle) peuvent être ajoutées.
Revendiquée pour offrir un rendement élevé de produits très purs, la chloration des méthylbenzènes dans les trichlorures correspondants comme solvants présente une méthode alternative pour la production de benzotrichlorure.
Un autre procédé de fabrication du benzotrichlorure consiste à chlorer l’éther dibenzylique, un sous-produit obtenu lors de la conversion du chlorure de benzyle en alcool benzylique. Ce processus de chloration donne un mélange de benzotrichlorure et de chlorure de benzoyle, qui peut ensuite être traité pour obtenir du chlorure de benzoyle pur.
Cette approche améliore indirectement la viabilité économique de la production d’alcool benzylique.
Utilisations du benzotrichlorure
L’application principale du benzotrichlorure réside dans son utilisation pour la production de chlorure de benzoyle par hydrolyse partielle avec de l’eau ou réaction avec l’acide benzoïque.
Le benzotrichlorure trouve également des applications à plus petite échelle dans diverses industries. Il est utilisé dans la production de produits pharmaceutiques et agrochimiques, notamment après avoir subi une transformation en benzotrifluorure. De plus, il sert de précurseur pour la synthèse de stabilisants UV et de colorants de type benzophénone.
Toxicologie du benzotrichlorure
Le benzotrichlorure est un produit chimique toxique qui peut provoquer une irritation de la peau, des yeux et des voies respiratoires. C’est également un cancérigène probable pour l’homme.
La toxicité orale aiguë (DL50) du benzotrichlorure est de 2 188 mg/kg chez les rats mâles et de 1 590 mg/kg chez les rats femelles. Cela signifie que 50 % des rats mourront s’ils ingèrent respectivement 2 188 mg/kg ou 1 590 mg/kg de benzotrichlorure.
Les valeurs CL50 pour le benzotrichlorure sont supérieures à 600 mg/m³ chez les rats mâles et à environ 500 mg/m³ chez les rats femelles après une période d’exposition de 4 heures. Cela signifie que 50 % des rats mourront s’ils sont exposés à des vapeurs de benzotrichlorure à une concentration supérieure à 600 mg/m³ ou environ 500 mg/m³, respectivement, pendant 4 heures.
Il a également été démontré que le benzotrichlorure est mutagène dans les systèmes de tests bactériens. Cela signifie qu’il peut provoquer des modifications de l’ADN pouvant conduire au cancer.
L’exposition par inhalation de souris femelles au benzotrichlorure a entraîné l’apparition de tumeurs bénignes et malignes du poumon et de la peau. Dans une étude sur les tumeurs pulmonaires chez la souris, l’injection intrapéritonéale de benzotrichlorure a augmenté l’incidence des adénomes pulmonaires.
De plus, l’administration orale de benzotrichlorure à 40 souris femelles pendant 25 semaines a induit des néoplasmes dans le préestomac, les poumons et la glande thymique à la dose la plus élevée.
Ces résultats suggèrent que le benzotrichlorure est un cancérigène potentiel pour les humains. Il est important d’éviter toute exposition à ce produit chimique en prenant les précautions de sécurité appropriées lors de sa manipulation.
Référence
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
