Benzidine : production, réactions et utilisations
La benzidine est une base diphénylique largement utilisée comme intermédiaire dans la fabrication de colorants et de pigments azoïques. Il est également utilisé comme agent de réticulation dans les plastiques polyuréthanes et comme réactifs analytiques et diagnostiques.
La benzidine peut réagir avec diverses substances, notamment des cations, des anions, des composés organiques et des agents oxydants. Cette polyvalence en fait des outils précieux pour un large éventail d’applications.
Table des matières
1. Propriétés physiques de la benzidine
La benzidine, un composé diacide de formule chimique C12H12N2 et de masse molaire 184,24 g/mol, présente les propriétés physiques suivantes :
| Propriété | Valeur |
|---|---|
| Apparence | Poudre blanche |
| Point de fusion | 128 °C (bâtonnets grossiers), 122-125 °C (modification métastable) |
| Point d'ébullition | 400-401 °C |
| Densité | 1,25 g/cm³ |
| Solubilité dans l'eau | 1 partie en poids dans 2447 parties d'eau à 12 °C, 106,5 parties d'eau à 100 °C |
| Solubilité dans les solvants organiques | Peu soluble dans l'éther (45 parties) et l'éthanol absolu (13 parties) à 20 °C |
| Acidité | Diacide (peut donner deux protons en solution) |
| Constantes de dissociation (à 30 °C) | K1 = 9,3 x 10⁻¹⁰, K2 = 5,6 x 10⁻¹¹ |
| Chaleur de neutralisation | 106,5 kJ/mol |
| Pression de vapeur | < 0,1 mmHg à 25 °C |
| Indice de réfraction | 1,652 à 25 °C |
| Point d'éclair | 205 °C |
| Température d'auto-inflammation | 300 °C |
2. Réactions chimiques de la benzidine
La benzidine présente les réactions chimiques suivantes :
- Exposition à l’air : La benzidine se décolore lorsqu’elle est exposée à l’air.
- Résistance à l’eau : La benzidine résiste à l’eau.
- Réactions colorées : la benzidine forme des colorations bleues, vertes ou rouges et précipite avec des agents oxydants. Ces réactions sont précieuses pour détecter les agents oxydants.
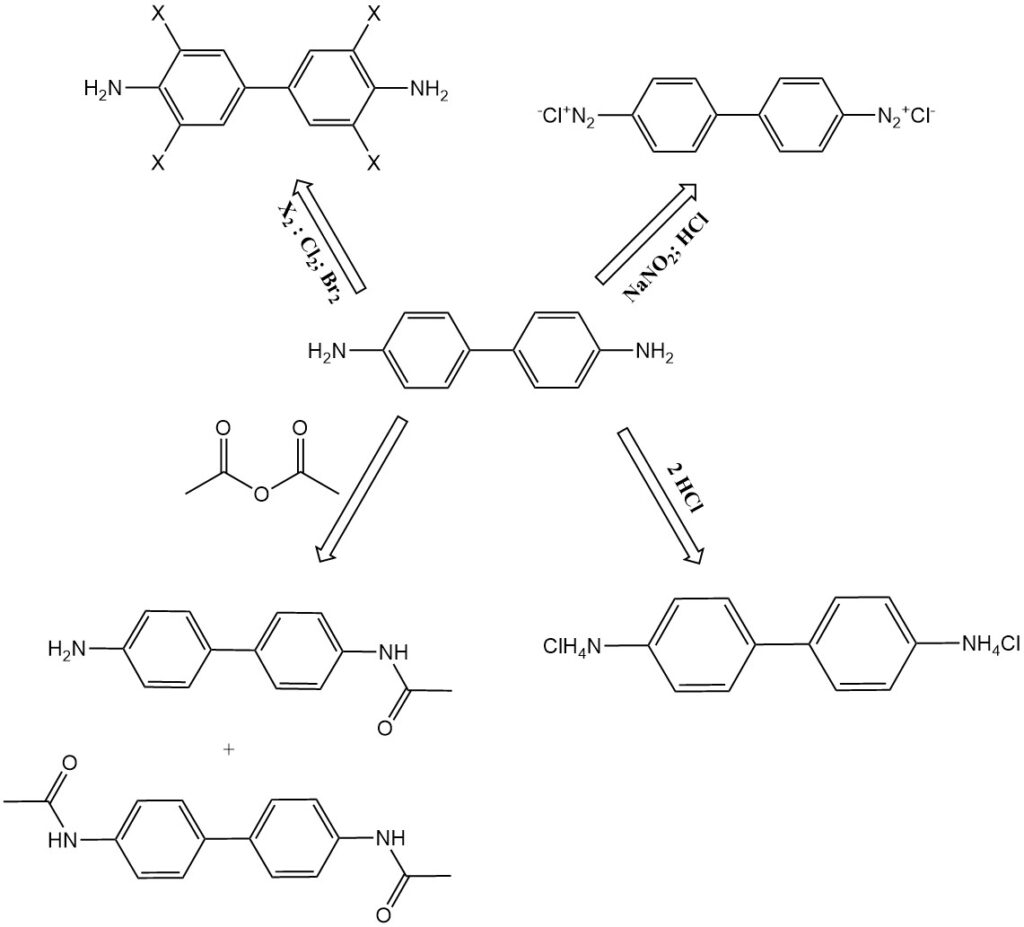
- Chloration et bromation : La benzidine se transforme respectivement en 3,3′,5,5′-tétrachlorobenzidine et en tétrabromobenzidine.
- Nitration et sulfonation : le sulfate de benzidine produit de la 2-nitrobenzidine, de la 2,2′-dinitrobenzidine et du 2,3′-dinitrobenzène par réactions de nitration. Des acides sulfoniques et des sulfones de benzidine peuvent être formés dans des conditions de sulfonation.
- N-acétylation: la benzidine réagit avec l’anhydride acétique pour former des produits de N-acétylation, tels que la N-acétyl-benzidine et la N,N’-diacétyl-benzidine. Ces composés se retrouvent également sous forme de métabolites dans la digestion animale.
- Diazotation : la benzidine peut être diazotée pour former des composés de tétrazonium. Le premier groupe de diazonium s’accouple vigoureusement, tandis que le second réagit plus lentement. Cela permet la production de colorants diazoïques asymétriques.
- Formation de sel : la benzidine forme des sels avec des acides, tels que le monochlorhydrate de benzidine, le dichlorhydrate de benzidine et le sulfate de benzidine.
3. Production de benzidine
La benzidine est produite en trois étapes :
- Réduction du groupe nitro pour former des composés hydrazoïques
- Réarrangement de la benzidine
- Isolation des bases
La benzidine est fabriquée industriellement à partir du nitrobenzène depuis la fin du 19e siècle. Les méthodes de production courantes comprennent la réduction alcaline du fer, la réduction des amalgames et la réduction électrochimique.
L’hydrazobenzène résultant est réarrangé avec de l’acide chlorhydrique ou de l’acide sulfurique pendant le refroidissement, et le produit est isolé sous forme de chlorhydrate de benzidine ou de sulfate de benzidine. Pour minimiser le risque de toxicité chronique, la conversion de ces sels en base libre est évitée autant que possible.
3.1. Réduction du nitrobenzène
La réduction du nitrobenzène en hydrazobenzène peut être représentée par l’équation suivante :
2 C6H5NO2 + 10 H → C6H5NH-NHC6H5 + 4 H2O
Ce processus de réduction est connu sous le nom de procédé Haber et passe par plusieurs étapes, impliquant la condensation intermédiaire d’un composé nitroso avec un composé hydroxylamine pour former le composé azoxy.
Cette méthode aboutit à la formation de composés hydrazoïques symétriques. Le principal sous-produit généré est l’amine primaire monocyclique, telle que l’aniline, correspondant au composé nitro d’origine. Ce sous-produit est formé à la fois par la réduction supplémentaire de la phénylhydroxyamine et par la dismutation du composé hydrazo instable.
Diverses techniques de réduction sont utilisées dans les applications industrielles, notamment :
1. Réduction avec de la poussière de zinc : Cette méthode implique la réduction de composés nitro aromatiques avec de la poussière de zinc dans un environnement alcalin. La réaction est donnée par :
2 C6H5NO2 + 5 Zn + 10 NaOH → C6H5NH-NHC6H5 + 5 Na2ZnO2 + 4 H2O
Industriellement, le nitrobenzène est dissous dans un solvant à point d’ébullition élevé et de la poussière de zinc est en suspension dans la solution. La solution d’hydroxyde de sodium est émulsionnée et la réduction a lieu. Un contrôle minutieux de la température de réaction est nécessaire et le processus est terminé lorsque la couleur rouge de l’étape azoïque disparaît.
2. Réduction avec du fer : La réduction avec du fer et une solution d’hydroxyde de sodium est moins courante en chimie préparative mais a été explorée pour une production commerciale. L’équation de réduction est :
2 C6H5NO2 + 4 Fe + 6 H2O → C6H5NH-NHC6H5 + 2 Fe(OH)2 + 2 Fe(OH)3
Différentes formes de fer, telles que des tournures de fonte ou de la poudre de fer, sont utilisées dans cette méthode. La réduction est réalisée dans un rapport molaire de 1:2:4 pour le nitrobenzène, le fer et l’hydroxyde de sodium, respectivement.
3. Réduction avec l’amalgame de sodium : L’amalgame de sodium est utilisé pour la réduction du nitrobenzène à des températures élevées. La réduction se produit dans un mélange émulsionné de nitrobenzène dans de l’eau ou de l’hydroxyde de sodium, et un produit azobenzène est formé. Cependant, une certaine surréduction en amines monocycliques peut se produire au cours de ce processus.
4. Réduction électrolytique : La réduction électrochimique à l’échelle commerciale est une autre méthode utilisée pour la réduction des composés nitro en composés hydrazoïques. Cela implique l’utilisation de cellules électrolytiques avec des cathodes, des diaphragmes et des anodes, et la réaction peut être représentée comme suit :
2 C6H5NO2 + 10 H+ + 10 e- → C6H5NH-NHC6H5 + 4 H2O
La réduction est réalisée à des températures élevées et à des densités de courant spécifiques, le processus étant régulé en contrôlant l’ajout de réactifs.
5. Réduction catalytique : Le nitrobenzène peut être réduit en hydrazobenzène par hydrogénation catalytique en présence d’un catalyseur palladium-carbone. Cette méthode peut inclure de l’alcool dilué, une base et des conditions de température et de pression élevées.
Il existe d’autres agents réducteurs utilisés en chimie préparative, tels que divers métaux, amalgames et agents réducteurs organiques comme le méthanol, le formaldéhyde et le glucose, qui sont utilisés en fonction des exigences de réaction spécifiques.
3.2. Réarrangement de la benzidine
Le réarrangement de la benzidine est une étape clé dans la production de composés diaminodiphényles. Ces composés sont formés en réarrangeant des composés hydrazoïques aromatiques, qui sont initialement dérivés de la réduction de composés nitro aromatiques avec une solution alcaline.
Le processus de réarrangement, généralement catalysé par les acides minéraux, conduit à la formation de composés diaminodiphényles (1), (2) et (3) et de composés aminodiphénylamines (4) et (5).

- Les réarrangements ortho produisent de petites quantités d’o-benzidine (2,2′-diaminodiphényl) (2) et de diphényline (2,4′-diaminodiphényl) (3).
- Les réarrangements partiels produisent de l’o-sémidine (2-aminodiphénylamine) (4) et de la p-sémidine (4-aminodiphénylamine) (5).

Le type et la quantité de produits de réarrangement sont influencés par la structure chimique du matériau de départ mais ne peuvent être ajustés que de manière minimale en faisant varier les conditions de réaction. Certains sous-produits, comme la diphényline (3), sont produits en quantités allant jusqu’à 15 % mais n’ont aucune valeur commerciale.
Le réarrangement de la benzidine est une véritable réaction intramoléculaire, ce qui signifie qu’il ne produit pas de benzidines mixtes à partir de mélanges de différents composés hydrazoïques. Au lieu de cela, elle produit exclusivement la benzidine asymétrique correspondante à partir d’hydrazobenzènes asymétriquement substitués.
Dans le processus industriel, le réarrangement de la benzidine commence par la solution chaude obtenue par réduction du nitrobenzène en hydrazobenzène. Bien qu’une isolation intermédiaire de l’hydrazobenzène ne soit pas toujours nécessaire, elle est conseillée dans des cas particuliers, tels que les réductions d’amalgame.
Pour réduire la teneur en azoïque de l’hydrazobenzène, certains agents réducteurs comme l’hydrosulfite de sodium (dithionite de sodium) ou la poussière de zinc peuvent être ajoutés avant le réarrangement.
La réaction se produit lorsque la solution d’hydrazobenzène est mélangée avec un acide minéral approprié, généralement 10 à 30 % d’acide chlorhydrique, 20 à 80 % d’acide sulfurique ou un mélange des deux.
La température optimale pour le réarrangement est de 100 °C pour les bases diphényliques. Il est crucial de maintenir les températures dans une plage appropriée, car une chaleur excessive peut réduire le rendement, généralement visé entre 70 et 95 %.
3.3. Isolement du produit pur
L’étape la plus importante du réarrangement de la benzidine est la formation du sel d’acide chlorhydrique ou sulfurique de la benzidine. Ce sel peut être soit isolé directement, par exemple par relargage avec du chlorure de sodium ou du sulfate de sodium, soit d’abord converti en base libre à l’aide d’un alcali dilué, tel qu’une solution d’hydroxyde de sodium ou une solution d’ammoniaque.
Les sous-produits, notamment l’aniline et la diphényline, peuvent être séparés en raison de leur plus grande solubilité. L’azobenzène est le seul composé restant dans le solvant inerte après extraction acide et peut être renvoyé au processus de réduction.
4. Utilisations de la benzidine
La benzidine a plusieurs applications, notamment :
- Production de teintures : la benzidine est utilisée pour produire des teintures azoïques pour la laine, le coton et le cuir. Cependant, son utilisation à ce titre a diminué en raison de sa cancérogénicité.
- Détermination quantitative de l’acide sulfurique : La benzidine peut être utilisée pour déterminer la concentration d’acide sulfurique.
- Détection et détermination des anions et des ions métalliques : la benzidine peut être utilisée pour détecter et quantifier divers anions et ions métalliques.
- Détection du chlore libre ou de la pyridine : La benzidine peut être utilisée pour détecter des traces de chlore libre ou de pyridine dans l’eau potable.
- Détection du sang : la benzidine peut être utilisée pour détecter le sang en fonction de son changement de couleur du vert au bleu en présence de peroxyde d’hydrogène et de peroxydases.
- Production de caoutchouc : la benzidine est utilisée comme agent de réticulation dans la production de produits en caoutchouc, tels que les pneus et les tuyaux.
- Production de plastique : la benzidine est utilisée comme stabilisant dans la production de certains plastiques.
- Production pharmaceutique : La benzidine est utilisée comme intermédiaire dans la production de certains produits pharmaceutiques, tels que les antihistaminiques et les antispasmodiques.
La benzidine est un composé hautement toxique, mais elle continue d’être utilisée dans diverses synthèses et applications chimiques.
5. Toxicologie de la benzidine
Toxicité orale aiguë : DL50 chez le rat = 1,57 g/kg
Exposition alimentaire subaiguë : Les effets indésirables chez la souris comprennent un gonflement trouble du foie, une dégénérescence vacuolaire des tubules rénaux, une hyperplasie des éléments myéloïdes dans la moelle osseuse et des modifications des cellules lymphoïdes dans le thymus et la rate.
Absorption cutanée et pulmonaire : Des informations limitées sont disponibles, mais des manifestations systémiques de toxicité suggèrent qu’une absorption importante peut se produire.
Injection intraveineuse et métabolisme : la benzidine est convertie en N-acétyl-benzidine et en N,N’-diacétylbenzidine, qui sont ensuite transformées en N-hydroxy-N,N’-diacétylbenzidine et en 3-hydroxy-N,N’-diacétylbenzidine. Ce dernier composé se lie aux acides nucléiques.
Résultats du test d’Ames : le test d’Ames est positif à la benzidine et il a également été démontré que ses métabolites induisent des mutations.
Effets sur l’ADN : la benzidine entraîne des cassures de brins d’ADN et une transformation cellulaire. Il induit une synthèse non programmée d’ADN dans les cellules HeLa et les hépatocytes de rat.
Propriétés cancérigènes : Il a été démontré que le chlorhydrate de benzidine induisait un carcinome hépatocellulaire chez la souris et d’autres cancers chez le rat, le hamster et l’humain.
La benzidine est un puissant cancérigène chez les animaux et les humains. Il est classé Groupe A1 par la commission MAK et Groupe A1b par l’ACGIH.
Référence
- Benzidine and Benzidine Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_539
