Acide salicylique : propriétés, production, utilisations et dérivés
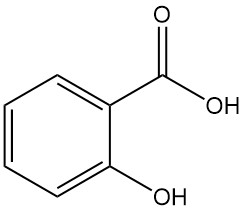
L’acide salicylique, également connu sous le nom d’acide 2-hydroxybenzoïque ou d’acide o-hydroxybenzoïque, est un composé aromatique de formule C7H6O3. Il s’agit d’un solide cristallin incolore et inodore que l’on trouve naturellement dans de nombreuses plantes, principalement sous forme d’esters.
Les preuves de son usage médicinal remontent à la Grèce antique. Il y a environ 2 400 ans, Hippocrate prescrivait des décoctions d’écorce de saule pour traiter la fièvre et la douleur. Cet effet thérapeutique peut être attribué à l’acide salicylique, l’ingrédient actif de l’écorce de saule.
La biosynthèse de l’acide salicylique dans les plantes se produit par la désamination de la phénylalanine en acide trans-cinnamique, qui est ensuite hydrolysé et oxydé au niveau du carbone bêta pour produire de l’acide salicylique.
Les esters salicylés sont abondants dans divers genres de plantes, notamment Salix (saule), Spiraea (reine des prés) et Gaultheria (gaulthérie). Par exemple, le salicylate de méthyle, un dérivé de l’acide salicylique, est présent en concentrations élevées sous forme de glucoside dans l’écorce de bouleau, certaines espèces de spirées et les feuilles de gaulthérie.
L’acide salicylique a été isolé pour la première fois en 1838 par R. Piria en traitant le salicylaldéhyde (dérivé de la reine des prés) avec de l’hydroxyde de potassium. Six ans plus tard, C. Cahours, un chimiste français, obtenait l’acide salicylique en hydrolysant le salicylate de méthyle.
La production d’acide salicylique a été réalisée en 1874 par H. Kolbe, un chimiste allemand, par carboxylation du phénoxate de sodium, procédé encore utilisé aujourd’hui.
L’acide salicylique et ses dérivés sont importants dans diverses industries. Ils servent principalement de précurseurs pour la synthèse de produits pharmaceutiques, de colorants, de produits agrochimiques et de parfumerie.
Table des matières
1. Propriétés physiques de l’acide salicylique
L’acide salicylique est un acide o-hydroxycarboxylique aromatique qui présente des liaisons hydrogène intramoléculaires. Ceci, contrairement à ses isomères méta et para, améliore sa volatilité à la vapeur et sa tendance à la sublimation. De plus, l’acidité de l’acide salicylique est significativement plus élevée que celle de l’acide 3-hydroxybenzoïque (isomère méta) et de l’acide 4-hydroxybenzoïque (isomère para).
Les propriétés physiques importantes de l’acide salicylique sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | 69-72-7 |
| Formule | C7H6O3 |
| Masse molaire | 138,12 g/mol |
| Structure cristalline | Aiguilles incolores (eau) ou prismes monocliniques (éthanol) |
| Point de fusion | 159 °C |
| Sublimation | Commence à 76 °C |
| Point d'éclair (coupelle fermée) | 157 °C |
| Chaleur de sublimation | 81,8 kJ/mol |
| Densité | 1.443 |
| Constantes de dissociation | K₁ = 1,05 × 10-3 K₂ = 4,0 × 10-14 (19 °C) |
| Pression de vapeur | 1,66 mbar (110 °C) 19,3 mbar (150 °C) |
| Solubilité | |
| Solvant | Solubilité |
| Méthanol | 38,46 g/100 g (21 °C) |
| Éthanol | 34,87 g/100 g (21 °C) |
| Chloroforme | 1,55 g/100 g (30 °C) |
| Benzène | 1,00 g/100 g (30 °C) |
| Éther diéthylique | 23,4 g/100 ml (17 °C) |
| Acétone | 31,3 g/100 ml (23 °C) |
| Ammoniac | Extrêmement soluble |
| Dioxyde de soufre liquide | Insoluble |
La solubilité de l’acide salicylique dans l’eau dépend de la température, comme le montre le tableau 2.
| Température (°C) | Solubilité (g/L) |
|---|---|
| 0 | 0,8 |
| 10 | 1.2 |
| 20 | 1.8 |
| 40 | 3.7 |
| 60 | 8.2 |
| 80 | 20,5 |
2. Réactions chimiques de l’acide salicylique
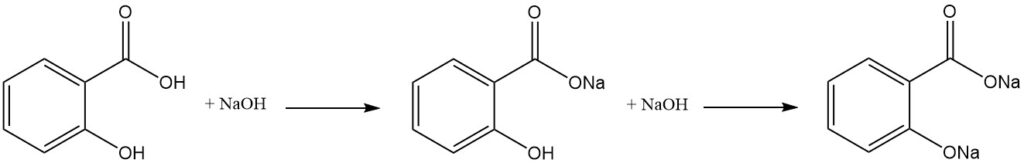
L’acide salicylique est une molécule difonctionnelle qui possède des propriétés caractéristiques à la fois des phénols et des acides carboxyliques aromatiques. En raison de la différence d’acidité entre les groupes hydroxyle et carboxylique, un équivalent d’une base forte neutralise sélectivement le groupe carboxyle.
La formation du sel dialcali nécessite un excès de base, tandis qu’une exposition ultérieure au dioxyde de carbone entraîne la reformation du groupe hydroxyle libre.
La chélation avec certains ions métalliques, comme Fe(III), forme des complexes de couleur violette. Cette propriété permet à l’acide salicylique d’être utilisé comme indicateur dans les titrages de Fe(III) utilisant l’EDTA.
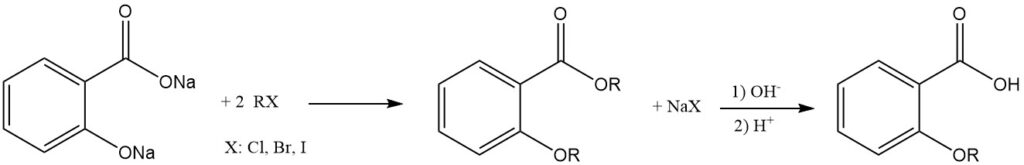
La réaction de l’acide salicylique avec des alcools utilisant des acides forts comme catalyseurs produit des esters avec une formation minimale d’éther comme produit secondaire. L’estérification peut également être réalisée avec des halogénures d’acyle ou des anhydrides d’acide.
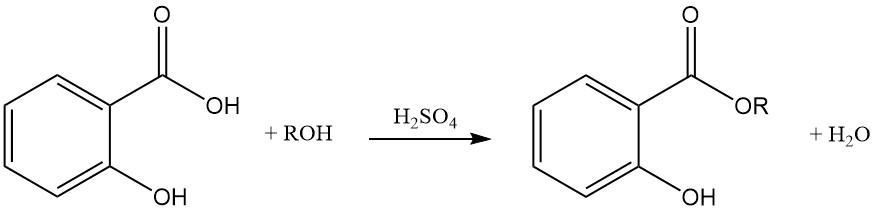
Le salicylate de dialcali réagit avec les halogénures d’alkyle pour donner des éther-esters combinés. Le traitement de ces produits avec une base les hydrolyse en acides alcoxybenzoïques correspondants.
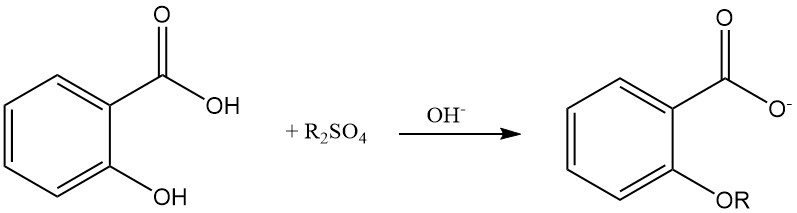
L’éthérification du groupe hydroxyle phénolique de l’acide salicylique est possible en utilisant du sulfate de dialkyle dans une solution aqueuse alcaline.
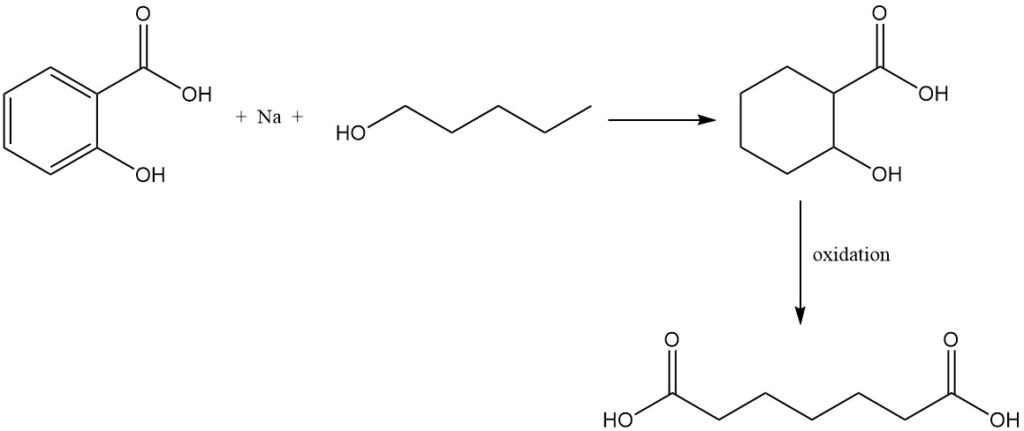
La réduction de l’acide salicylique avec du sodium et de l’alcool amylique forme de l’acide tétrahydrosalicylique qui, lors de l’oxydation, donne de l’acide pimélique.
L’hydrogénation catalytique des esters d’acide salicylique utilisant le nickel de Raney produit des esters d’acide cis-trans-2-hydroxycyclohexane carboxylique.
Les réactions de substitution électrophile favorisent la position 5, la moins encombrée, du cycle aromatique. Cette régiosélectivité permet la synthèse directe de dérivés d’acide salicylique 5-substitués ou 3,5-disubstitués.
Des exemples de substitution électrophile de l’acide salicylique comprennent la nitration, la sulfonation, l’halogénation, l’alkylation, l’acylation et le couplage avec des sels de diazonium, qui produisent généralement des produits 5-substitués.
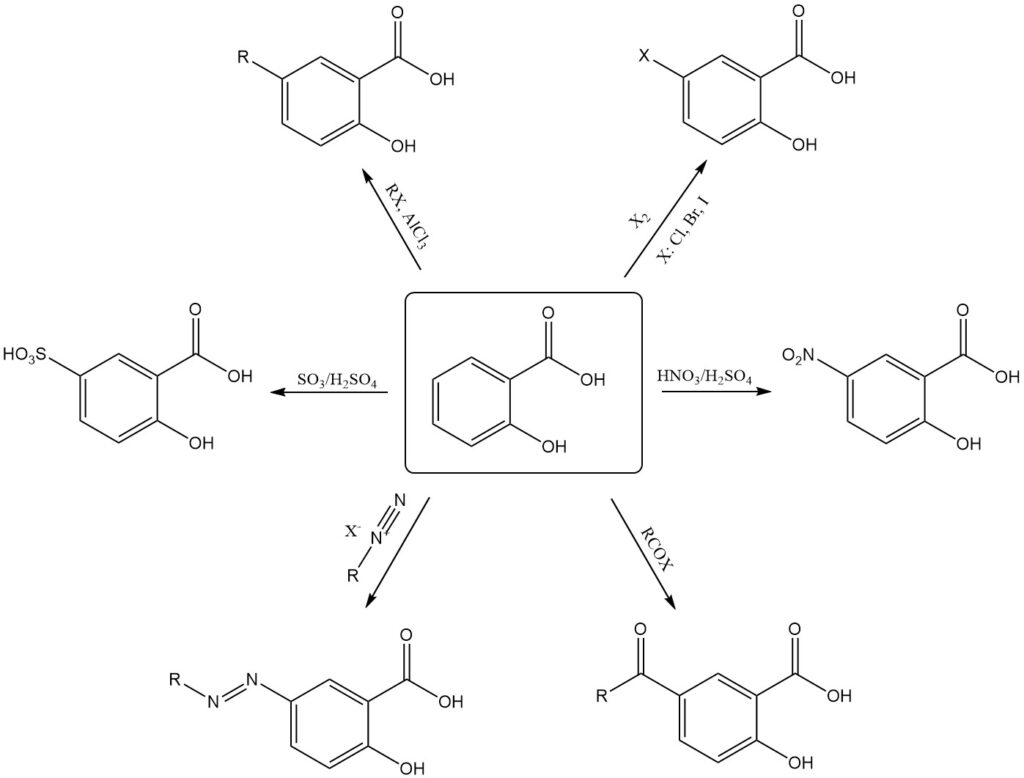
Les dérivés salicyliques substitués en position 3 nécessitent des méthodes indirectes telles que la substitution de l’acide sulfosalicylique en position 5, suivie de l’élimination du groupe acide sulfonique. Cependant, des conditions de réaction plus dures peuvent conduire à une décarboxylation.
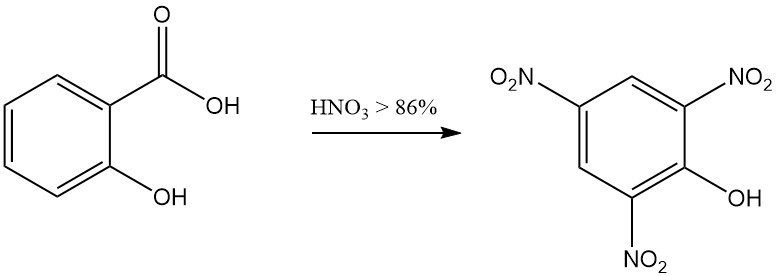
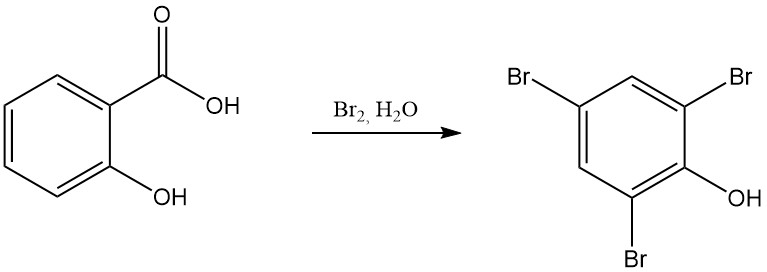
Par exemple, la réaction de l’acide salicylique avec l’acide nitrique fumant entraîne la formation de 2,4,6-trinitrophénol (acide picrique), et la réaction avec le brome en présence d’eau donne du tribromophénol.
La décomposition thermique de l’acide salicylique à son point de fusion ou au-dessus donne du phénol et du dioxyde de carbone. Sous une atmosphère de dioxyde de carbone à 230 °C, le produit principal est le salicylate de phényle. À des températures plus élevées (250 °C), de la xanthone se forme aux côtés du phénol.
3. Production d’acide salicylique
3.1. Production d’acide salicylique par synthèse Kolbe-Schmitt
L’acide salicylique est préparé commercialement via la réaction de Kolbe-Schmitt. Ce procédé consiste à faire réagir du phénoxyde de sodium sec avec du dioxyde de carbone sous pression (5 bars) et à des températures allant de 150 à 160 °C.
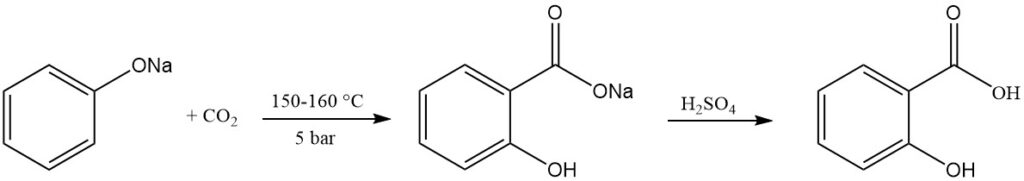
En 1884, Schmitt a découvert que l’utilisation de la pression améliorait le rendement à environ 90 % par rapport à la réaction originale de Kolbe en 1874, qui ne donnait qu’environ 50 % à pression normale. Sans pression, le salicylate disodique et le phénol se forment en quantités égales.
Le mécanisme exact de la réaction de Kolbe-Schmitt reste un sujet de discussion. De nombreuses suggestions ont été proposées dans la littérature, telles que :
- L’acide 4-hydroxyisophtalique peut agir comme intermédiaire, libérant du CO2 ou subissant une carboxylation du phénolate pour former de l’acide salicylique.
- La formation d’un complexe entre le phénol, le CO2 et un métal alcalin pourrait faciliter la substitution électrophile au niveau du phénolate.
La température, le type de métal alcalin utilisé et la pression du CO2 ont tous un impact significatif sur la réactivité et la sélectivité de l’anion phénolate.
Un aperçu simplifié de la synthèse industrielle de l’acide salicylique est présenté dans la Figure 1.
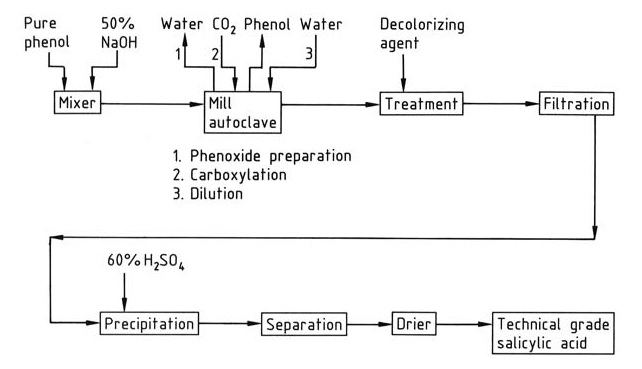
La carboxylation se produit dans des autoclaves équipés d’agitateurs ou de broyeurs. Le mélange réactionnel doit être finement broyé et rigoureusement exempt d’eau pour garantir un rendement optimal. L’eau réduit le rendement en convertissant le phénoxate en phénol et en favorisant la formation de carbonate.
Un léger excès molaire (1 à 2 %) d’hydroxyde de sodium est utilisé pour préparer du phénolate de sodium. Des quantités plus importantes de soude caustique entraînent la formation d’eau. Le phénolate de sodium anhydre est préparé par évaporation d’une solution aqueuse de phénoxyde de sodium dans le mélangeur autoclave lui-même, en appliquant un vide après avoir atteint la pression normale, ou en utilisant un équipement de séchage dédié.
Le dioxyde de carbone utilisé dans la réaction doit avoir une teneur minimale en oxygène (<0,1 %) pour éviter la décoloration et la formation de goudron.
La réaction de carboxylation exothermique convertit le phénoxyde de sodium en acide salicylique. Le salicylate de sodium brut résultant est dissous dans l’eau, traité avec un agent décolorant (par exemple, du charbon actif, de l’aluminium ou de la poudre de zinc), puis précipité avec de l’acide sulfurique.
Le phénol n’ayant pas réagi est récupéré du mélange de salicylate de sodium brut par distillation.
En alternative, le procédé continu utilise une solution de phénoxate anhydre dans un solvant approprié, tel que le phénol lui-même, des alcools supérieurs, des dialkylcétones ou du nitrobenzène.
3.2. Production d’acide salicylique par d’autres procédés
D’autres méthodes alternatives de production d’acide salicylique ont été explorées :
- Oxydation à l’air de l’o-crésolate à 230 °C avec un catalyseur à base de cuivre ou du benzoate de cuivre à 175-215 °C.
- Le chauffage direct du benzoate de cuivre alcalin peut produire du salicylate.
- L’hydrolyse de l’acide 2-benzoyloxybenzoïque, un intermédiaire du procédé Dow pour la production de phénol, conduit à la formation d’acide salicylique.
- La fermentation des composés aromatiques polycycliques comme le naphtalène par certains micro-organismes peut produire de l’acide salicylique.
4. Utilisations de l’acide salicylique
L’acide salicylique est principalement utilisé comme précurseur de l’acide acétylsalicylique (aspirine), le produit pharmaceutique le plus largement distribué au monde. De plus, les esters, amides et sels de l’acide salicylique sont des matières premières pour d’autres produits pharmaceutiques.
L’acide salicylique de qualité technique est utilisé comme intermédiaire dans la production de produits agrochimiques, de colorants, de produits en caoutchouc et de résines phénoliques.
L’acide salicylique lui-même possède des effets thérapeutiques dans le traitement des affections rhumatismales. Il est généralement administré sous forme de sel de sodium hautement soluble à cette fin.
En raison de ses propriétés kératolytiques (capacité à décomposer la kératine), l’acide salicylique est utilisé dans divers produits de soins de la peau pour nettoyer et éliminer les squames.
L’acide salicylique est un bactéricide utilisé dans certains désinfectants ou conservateurs. Son utilisation dans les produits alimentaires est toutefois interdite.
Récemment, il a été utilisé comme régulateur de la croissance et de la floraison des plantes et contre divers stress abiotiques et biotiques.
L’acide acétylsalicylique représente environ 55 % du marché total de l’acide salicylique, suivi des esters et sels (18 %), des résines (10 %) et des colorants et colorants (10 %).
L’introduction de nouveaux analgésiques qui concurrencent directement l’aspirine a eu un impact sur le marché de l’acide salicylique, entraînant une baisse de la consommation d’aspirine. Cependant, la découverte potentielle de nouvelles applications pour l’acide salicylique pourrait stabiliser le marché à l’avenir.
5. Dérivés de l’acide salicylique
L’acide salicylique forme facilement des sels en réagissant avec les carbonates métalliques. Pour éviter la décoloration, il est recommandé de conserver les solutions aqueuses salines légèrement acides. Les sels sont obtenus sous forme solide en concentrant leurs solutions.
5.1. Salicylate de sodium
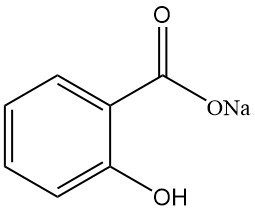
- Formule : NaC7H5O3
- Numéro CAS : 54-21-7
- Masse molaire : 160,11 g/mol
- Apparence : Flocons cristallins blancs, inodores et brillants
- Solubilité :
- Eau : 125 g/100 ml (25 °C)
- Éthanol : 17 g/100 mL (15 °C)
Le salicylate de sodium de qualité technique est produit par l’évaporation d’une solution de salicylate de sodium, et le salicylate de sodium de qualité pharmaceutique est préparé par la double cristallisation de salicylate de sodium hexahydraté à partir d’une solution aqueuse à 45 % à 10 °C.
Il est utilisé comme agent analgésique, antipyrétique et antinévralgique.
De nombreux autres sels salicylates existent, notamment ceux d’ammonium, de magnésium, de calcium et d’aluminium, ainsi que le salicylate de morpholine. Beaucoup de ces sels sont disponibles sous différents noms commerciaux.
5.2. Salicylate de méthyle
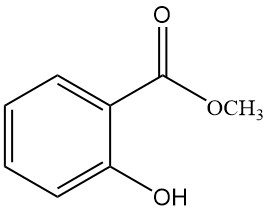
- Formule : C8H8O3
- Numéro CAS : 119-36-8
- Masse molaire : 152,15 g/mol
- Apparence : Liquide incolore et huileux avec une odeur caractéristique
- Point de fusion : -9 °C
- Point d’ébullition : 222 °C
- Densité : 1,184 g/mL
Le salicylate de méthyle est produit en chauffant un mélange d’acide salicylique et de méthanol avec de l’acide sulfurique.
Il est utilisé dans le traitement des névralgies et des rhumatismes, en stimulant la circulation sanguine capillaire, comme insecticide, écran solaire, comme parfum et intermédiaire de synthèse.
5.3. Salicylate de benzyle
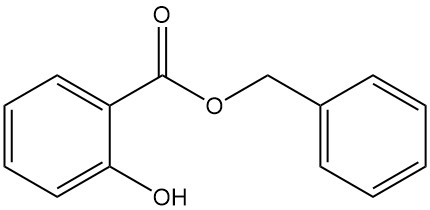
- Formule : C14H12O3
- Numéro CAS : 118-58-1
- Masse molaire : 228,25 g/mol
- Apparence : Liquide clair ou masse cristalline incolore à opaque avec une odeur caractéristique
- Point de fusion : 24 °C
- Point d’ébullition : 318 °C
- Densité : 1,180 g/mL (à 15 °C)
Le salicylate de benzyle est produit par la réaction entre le salicylate de sodium et le chlorure de benzyle ou par la transestérification du salicylate de méthyle avec de l’alcool benzylique.
On le trouve dans les huiles d’ylang-ylang et d’œillet et est utilisé comme additif dans les savons, les détergents et les parfums.
5.4. Salicylate d’isoamyle
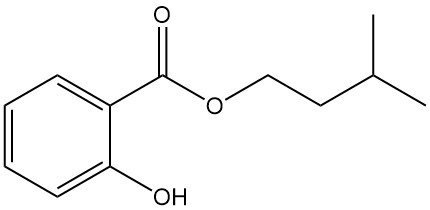
- Formule : C12H16O3
- Numéro CAS : 87-20-7
- Masse molaire : 208,26 g/mol
- Aspect : Liquide incolore au parfum d’orchidées
- Point d’ébullition : 270 °C
- Densité : 1,050 g/mL (à 20 °C)
Le salicylate d’isoamyle est utilisé comme stabilisant de parfum en parfumerie et comme agent antirhumatismal topique.
5.5. Salicylate de phényle
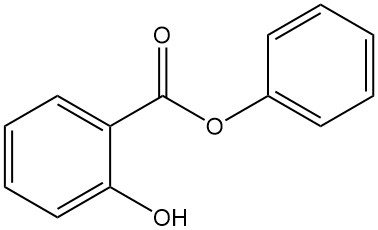
- Formule : C13H10O3
- Numéro CAS : 118-55-8
- Masse molaire : 241,22 g/mol
- Apparence : Poudre cristalline incolore
- Point de fusion : 43 °C
- Point d’ébullition : 172 °C (à 16 mbar)
Le salicylate de phényle est préparé par réaction entre l’acide salicylique et le phénol avec de l’acide sulfurique ou par transestérification du salicylate de méthyle avec du phénoxate de sodium.
Il est utilisé comme antiseptique, conservateur, dans les crèmes solaires, comme agent photoprotecteur général pour les produits synthétiques et comme émollient.
5.6. Acide acétylsalicylique (aspirine)
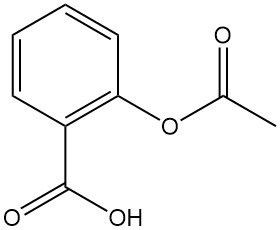
L’acide acétylsalicylique, également connu sous le nom de marque Aspirine, est un dérivé clé de l’acide salicylique. Voici un aperçu de ses propriétés et applications :
Propriétés physiques :
- Formule : C9H8O4
- Masse molaire : 180,15 g/mol
- Aspect : aiguilles incolores ou poudre cristalline (selon le solvant de cristallisation)
- Point de fusion : 143 à 144 °C
- Solubilité : faible dans l’eau (0,25 g/100 ml à 15 °C), mais plus soluble dans l’éthanol (20 g/100 ml à 25 °C)
- Constante de dissociation (K) : 2,8 x 10-4 (à 25 °C)
L’acide acétylsalicylique est synthétisé en faisant réagir l’anhydride acétique avec l’acide salicylique à des températures inférieures à 90 °C. Divers solvants et catalyseurs (acides ou amines tertiaires) peuvent être utilisés dans le procédé.
L’acide acétylsalicylique est un agent antipyrétique (réducteur de fièvre), analgésique, anti-inflammatoire et antirhumatismal bien connu. Il possède également des propriétés antithrombotiques et anticoagulantes, qui réduisent la formation de caillots sanguins.
6. Toxicologie de l’acide salicylique
L’acide salicylique et ses dérivés sont facilement absorbés par la peau et les muqueuses. Les formes esters de l’acide salicylique subissent une hydrolyse dans le corps en raison de l’action d’enzymes appelées estérases.
La voie d’élimination de l’acide salicylique dépend du pH urinaire :
- Urine acide : l’acide salicylique est oxydé en acide gentisique.
- Urine alcaline : L’acide salicylique est éliminé par les reins sous forme d’acide salicyluretique ou de salicylate de glucuronide.
Étant donné que l’absorption peut être plus rapide que l’élimination, l’accumulation d’acide salicylique dans le corps peut se produire dans certaines conditions.
Effets biologiques
L’acide salicylique a une activité kératolytique, ce qui signifie qu’il favorise la desquamation de la couche la plus externe de la peau. Il peut également irriter les tissus cutanés, en particulier au niveau de l’estomac, où il affecte les cellules productrices de mucus. L’utilisation à long terme de salicylates peut ralentir la coagulation sanguine en réduisant l’agrégation plaquettaire.
L’acide salicylique et ses dérivés inhibent la synthèse des prostaglandines, contribuant ainsi à leurs propriétés anti-inflammatoires. Ces composés présentent des effets analgésiques et antipyrétiques.
L’acide salicylique et ses dérivés peuvent agir comme fongicides et agents bactériostatiques.
Des réactions d’hypersensibilité cutanée et pulmonaire aux salicylates sont connues, mais pas toujours de véritables allergies. Une synthèse réduite des prostaglandines peut être impliquée. Une sensibilisation croisée entre différentes formes de salicylate, comme le salicylate de méthyle et l’aspirine, a été observée.
Toxicité
Des doses uniques d’acide salicylique dépassant 10 grammes peuvent être mortelles. La principale préoccupation est la perturbation de l’équilibre acido-basique du corps. Les symptômes comprennent le délire, les tremblements, les problèmes respiratoires, la transpiration, la déshydratation, la fièvre et le coma.
Une intoxication moins grave se manifeste par une hyperventilation, des bourdonnements d’oreilles, des nausées, des vomissements, des problèmes de vision ou d’audition, des étourdissements et des troubles du système nerveux.
Une consommation chronique peut entraîner des problèmes digestifs, des douleurs gastriques et intestinales et parfois des saignements graves et cachés. Une anémie induite par le salicylate, due à une carence en fer due à des saignements cachés, peut également survenir. Chez les patients âgés, l’intoxication chronique peut se manifester par de la confusion et de l’agitation.
Malgré des lésions tissulaires potentielles, l’administration chronique d’acide salicylique pur n’a pas été associée à des problèmes hépatiques ou rénaux.
Des études animales suggèrent que des doses élevées d’acide salicylique et de ses dérivés peuvent présenter des risques de malformations congénitales. Cependant, cela n’a pas été confirmé chez l’homme, et on pense que des conditions d’hygiène et de travail appropriées réduisent ces problèmes.
Références
- Salicylic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_477
- Analgesics (N02); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/9783527306732.a02_269.pub4
- Salicylic Acid: A Regulator of Plant Growth and Development
- Salicylic Acid. – https://www.sciencedirect.com/science/article/abs/pii/B9780080552323625759
