Acide glycolique : production, réactions et utilisations

L’acide glycolique est l’acide α-hydroxycarboxylique le plus simple. Il forme des cristaux incolores, monocliniques et prismatiques. Cet acide présente une solubilité élevée dans divers solvants, notamment l’eau, le méthanol, l’éthanol, l’acétone et l’acétate d’éthyle.
La volatilité de l’acide glycolique est limitée, avec une tendance minimale à s’évaporer lorsqu’il est exposé à la chaleur. Par conséquent, il ne peut pas être efficacement distillé sous vide.
Les efforts pour le distiller entraînent souvent une auto-estérification, accompagnée d’une perte d’eau, conduisant à la formation de di- et polyglycolides.
Table des matières
Propriétés physiques de l’acide glycolique
Sous forme pure, l’acide glycolique est cristallisable et il ne peut pas être distillé sans décomposition, même sous vide.
Les propriétés physiques sont les suivantes :
- Masse molaire = 76 g/mol
- point de fusion = 78-80 °C
- point d’ébullition = 100 °C (décomposition)
- Densité à 25 °C = 1,49
- Indice de réfraction (20 °C) = 1,423
- pKa = 3,81 à 25 °C
Réactions chimiques de l’acide glycolique
L’acide glycolique présente la capacité de subir une dimérisation en éliminant l’eau, entraînant la formation de diester cyclique appelés 1,4-dioxane-2,5-dione. Ces diesters sont communément appelés lactides en raison de leur découverte initiale lors d’études impliquant l’acide lactique.

La polymérisation de l’acide glycolique par polycondensation donne le polyglycolide ou poly(acide glycolique) (PGA), qui est un polymère biodégradable et thermoplastique. Ce type d’estérification, connu sous le nom de formation d’estolide, n’est pas limité aux acides a-hydroxycarboxyliques.

Une autre caractéristique importante de l’acide glycolique est que la proximité de ses deux groupes fonctionnels affaiblit la ou les liaisons C-C intermédiaires. Par conséquent, le traitement de tels composés par l’acide sulfurique conduit à l’élimination de l’acide formique. Lors d’une exposition à de l’acide sulfurique concentré, l’acide formique se décompose, produisant du monoxyde de carbone et de l’eau.
Cette réaction d’élimination se produit avec une grande efficacité, ce qui en fait un outil précieux pour la détermination quantitative de l’acide glycolique.
Le clivage oxydatif est également possible pour l’acide glycolique. Par exemple, lorsqu’il est traité avec du peroxyde d’hydrogène en présence d’ions fer (II), l’acide glycolique subit facilement l’élimination du dioxyde de carbone.
L’acide glycolique peut être déshydrogéné catalytiquement en acide glyoxylique en phase vapeur.
Lorsque l’acide glycolique est mis à réagir avec PCl3, il forme du chlorure de chloroacétyle (ClCH2COCl).
Production d’acide glycolique
L’acide glycolique est généralement synthétisé par l’hydrolyse de l’acide monochloroacétique fondu à l’aide d’une solution aqueuse à 50 % d’hydroxyde de sodium à des températures allant de 90 à 130 °C.
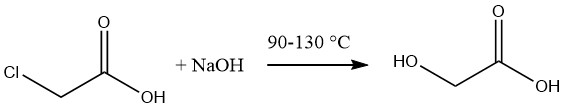
La solution résultante d’acide glycolique a une concentration approximative de 60%, accompagnée d’une teneur en chlorure de sodium de 12-14%. L’élimination du sel peut être réalisée par évaporation suivie d’une extraction de l’acide à l’aide d’acétone.
Des approches alternatives ont été explorées dans lesquelles l’hydrolyse est conduite avec des catalyseurs acides à des températures plus élevées de 150 à 200 ° C, en utilisant de l’eau ou de la vapeur sous pression.
Dans ce procédé, du chlorure d’hydrogène est formé comme sous-produit à la place du chlorure de sodium, qui peut être séparé par distillation. Cependant, ce procédé nécessite l’utilisation de quantités importantes d’eau, ce qui présente un inconvénient important.
Aux États-Unis, la production commerciale d’acide glycolique (par Du Pont) implique le traitement du formaldéhyde ou du trioxyméthylène avec du monoxyde de carbone et de l’eau en présence de catalyseurs acides sous des pressions supérieures à 30 MPa.

Une autre méthode, précédemment employée par Degussa, implique la réduction électrolytique de l’acide oxalique.
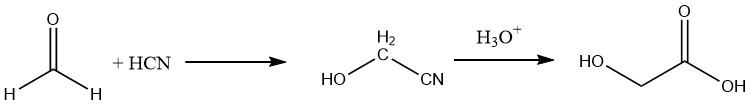
De plus, l’acide glycolique peut être préparé avec un rendement d’environ 90% en hydrolysant le nitrile correspondant, qui est obtenu par réaction du formaldéhyde avec l’acide cyanhydrique.
Une étude récente montre que l’acide glycolique peut être produit par un processus d’oxydation sélective de l’éthylène glycol (EG) à l’aide de nanocatalyseurs bimétalliques PtMn/MCM-41 hautement efficaces.
Utilisations de l’acide glycolique
L’acide glycolique est disponible dans le commerce sous forme de solutions aqueuses, à des concentrations de 57% (Hoechst) ou 70% (Du Pont). La consommation annuelle globale de ces solutions est d’environ 2000-3000 tonnes.
Dans diverses industries, l’acide glycolique trouve une application dans la teinture, l’impression et l’imperméabilisation des textiles. Sa capacité à former des chélates avec les ions calcium(II) le rend particulièrement adapté au détartrage masquant dans l’industrie du cuir. Il est également utilisé dans les mordants d’alun et de chrome, ainsi que dans les opérations de transformation de la fourrure.
En raison de sa faible nature corrosive et de ses propriétés bactéricides, l’acide glycolique est couramment incorporé dans les agents nettoyants acides. Il est particulièrement efficace pour nettoyer les récipients à lait, les équipements de traitement du lait, les fontaines à boire et pour éliminer la rouille et le tartre dans les échangeurs de chaleur et les canalisations.
L’acide glycolique présente des effets inhibiteurs sur la croissance des bactéries oxydant le fer. Son utilisation élimine le besoin d’ajout simultané d’agents chélatants et de bactéricides.
Les propriétés complexantes de l’acide glycolique le rendent également adapté à des applications telles que les produits de polissage du cuivre, agent de gravure pour plaques lithographiques, et dans la formulation de bains d’électropolissage et de galvanisation.
Dérivés de l’acide glycolique
Le glycolate de méthyle et le glycolate d’éthyle sont deux esters d’acide glycolique couramment utilisés comme matières premières pour la synthèse en laboratoire d’acide glycolique pur. Dans le passé, ils étaient également utilisés comme solvants pour les résines et la nitro- ou acétylcellulose. En dehors de ces esters, seuls la carboxyméthylcellulose et le glycolate de n-butyle ont une importance commerciale.
Glycolate de n-butyle
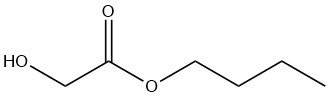
Le glycolate de n-butyle est un liquide incolore miscible avec la plupart des solvants organiques. Sa solubilité dans l’eau est limitée à 8 % en poids à 20 °C, bien que le composé lui-même puisse contenir jusqu’à 25 % en poids d’eau.
Production de glycolate de n-butyle
La production de glycolate de n-butyle implique le traitement du chloroacétate de sodium avec de l’alcool n-butylique à des températures allant de 125 à 160 ° C, suivi d’une distillation sous vide.
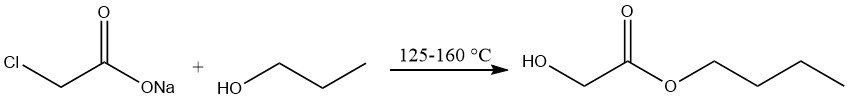
Utilisations du glycolate de n-butyle
Le glycolate de n-butyle trouve une application principale en tant qu’additif dans les vernis, apprécié pour sa faible volatilité. Certains noms commerciaux du glycolate de n-butyle incluent Polysolvan-O (Hoechst) et GB-Ester (Wacker).
Il confère des propriétés d’étalement lisse et un brillant élevé aux vernis nitrocellulosiques. Dans le cas de l’acétylcellulose, il agit efficacement comme un inhibiteur de rougissement dans des conditions d’humidité élevée.
En raison de ses propriétés de mélange favorables, le glycolate de n-butyle est également utilisé comme additif dans les résines alkydes et les peintures à base d’huile.
Le glycolate de n-butyle est considéré comme non dangereux.
Référence
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- Process for manufacture of glycolic acid. – https://patents.google.com/patent/US2152852A/en
- Glycolic Acid Production from Ethylene Glycol. – https://pubs.acs.org/doi/10.1021/acssuschemeng.1c03717
