Acide gluconique : propriétés, réaction, production et utilisations
Qu’est-ce que l’acide gluconique ?
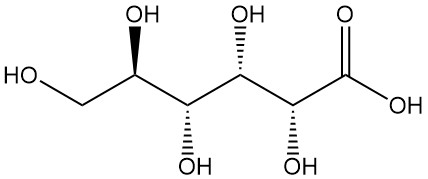
L’acide gluconique, également connu sous le nom d’acide 1,2,3,4,5-pentahydroxypentane-1-carboxylique, est un acide organique de formule C6H12O7. Il s’agit d’une poudre cristalline blanche et inodore que l’on trouve naturellement chez l’homme et d’autres organismes, ainsi que dans des produits alimentaires tels que le vin et le miel.
L’acide gluconique a été découvert pour la première fois dans les années 1870 par Hlasiwetz et Habermann lors de l’oxydation du glucose avec du chlore, et il a été isolé sous la forme de ses sels de baryum et de calcium.
Plus tard, les chercheurs ont découvert que l’acide gluconique pouvait être produit en traitant divers mono-, di- et polysaccharides avec des agents oxydants tels que l’halogène élémentaire, les sels de cuivre (II) ou d’hexacyanoferrate (III), ou l’oxyde de mercure (II).
Les sous-produits de ces réactions dépendent du type de sucre et de l’oxydant utilisé, mais peuvent inclure l’acide formique, l’acide glycolique, l’acide oxalique et le dioxyde de carbone.
Dans les années 1880, Butroux a découvert que l’acide gluconique était produit, avec l’acide acétique, par l’action oxydante d’Acetobacter aceti sur le glucose, qui s’est également avérée caractéristique d’autres bactéries.
Molliard a été le premier à signaler la présence d’acide gluconique dans des cultures d’Aspergillus niger, autrefois connu sous le nom de Sterigmatocystis nigra. La méthode privilégiée pour produire de l’acide gluconique et ses dérivés repose aujourd’hui sur des souches d’Aspergillus, d’après les travaux de plusieurs chercheurs.
L’oxydation anodique a été proposée dans les années 1930 comme méthode de préparation du gluconate de calcium, suivie plus tard par des études sur l’oxydation catalytique du glucose à l’aide d’air ou d’oxygène.
Table des matières
1. Propriétés physiques de l’acide gluconique
La cristallisation de l’acide D-gluconique sous sa forme libre est difficile et, selon certaines études, la cristallisation de la substance anhydre n’est possible qu’en dessous de 30 °C, et celle du monohydrate à 0–3 °C.
La masse moléculaire de l’acide gluconique est de 196,16 g/mol.
La forme anhydre de l’acide gluconique est une poudre cristalline blanche, inodore, dont le point de fusion se situe entre 120 et 131 °C en raison de la formation d’anhydrides intramoléculaires et d’une rotation spécifique de [α]D20 = -6,7° et [α]D25 = -5,4°.
Il est très soluble dans l’eau, légèrement soluble dans l’éthanol et insoluble dans les solvants non polaires. La solution aqueuse commerciale d’acide gluconique à 50 % a un pH de 1,82 et une densité de 1,23 g/cm3.
L’acide D-gluconique forme des lactones lors du stockage sur un dessiccateur à température ambiante ou par chauffage au-dessus de 50 °C et subit une pyrolyse au-dessus de 200 °C.
Il existe en équilibre avec deux lactones (1,5-lactone (1) et 1,4-lactone (2)) en solution aqueuse et à l’état solide. L’acide libre a une constante de dissociation (KA) de 1,99 x 10-4 et un pKa de 3,70.
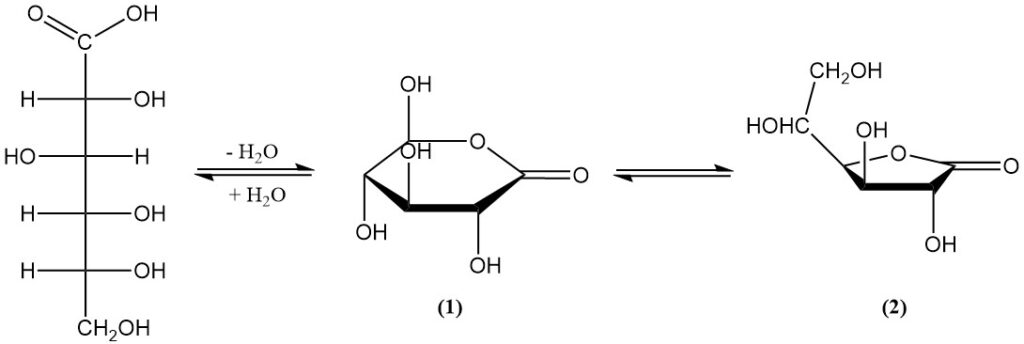
La 1,5-lactone (1) est un solide cristallin blanc légèrement sucré, dont le point de fusion est de 153 °C et dont la rotation spécifique est de [α]D20 = +66,2°. Elle est très soluble dans l’eau (et elle augmente avec la température) et légèrement soluble dans certains solvants organiques.
La 1,4-lactone (2) se présente sous la forme de fines aiguilles dont le point de fusion est de 134–136 °C et dont la rotation spécifique est de [α]D20 = +67,8°. Sa solubilité dans la plupart des solvants est faible.
2. Réactions chimiques de l’acide gluconique
L’oxydation des lactones d’acide gluconique ou du sel de calcium avec des oxydants doux comme l’acide nitrique ou le peroxyde d’hydrogène conduit à un mélange d’acides oxogluconiques, principalement avec des groupes cétones aux positions 2 et 5.
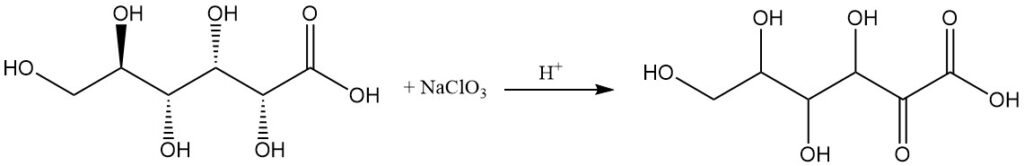
L’oxydation anodique, l’oxydation avec du chlorate de sodium dans une solution acide ou la fermentation par des bactéries spécifiques, comme les espèces d’Acetobacter, peuvent produire de l’acide 2-oxo-D-gluconique comme produit principal.
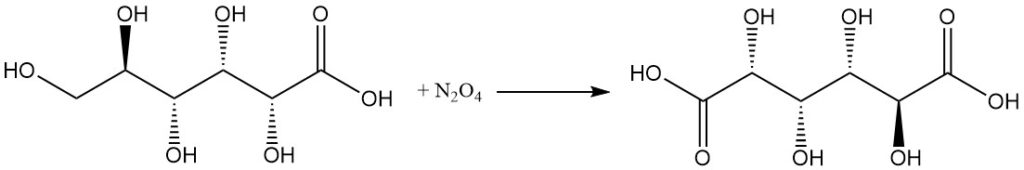
La réaction avec l’acide nitrique concentré ou N2O4 convertit l’acide gluconique en acide glucarique.
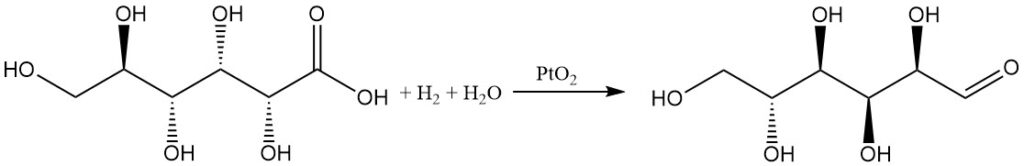
L’hydrogénation de l’acide gluconique dans l’eau avec un catalyseur à base d’oxyde de platine donne du D-glucose avec un rendement modéré, tandis que la 1,5-lactone donne un rendement élevé.
Le reflux de l’acide gluconique avec de l’acide iodhydrique concentré et du phosphore rouge produit de l’acide hexanoïque.
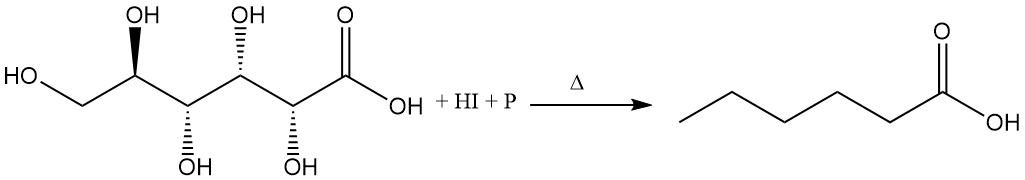
Les groupes fonctionnels de l’acide gluconique peuvent théoriquement réagir avec divers réactifs (alcools, acides, etc.) ; cependant, une réaction complète est nécessaire pour obtenir des dérivés stables. Les réactions partielles créent des mélanges instables susceptibles d’hydrolyse et ont une valeur pratique limitée.
L’acide gluconique et ses sels alcalins sont précieux en raison de leur capacité à former des complexes stables avec des cations polyvalents. Les exemples incluent les sels gluconates de calcium, de cuivre, de fer et de manganèse.
Les études de résonance magnétique nucléaire suggèrent que les groupes carboxyle et hydroxyle sont impliqués dans la formation de complexes avec ces cations.
3. Production d’acide gluconique
L’acide D-gluconique est produit industriellement par l’oxydation du glucose ou de matières premières riches en glucose. Le processus d’oxydation peut être chimique, électrolytique, catalytique ou biochimique.
3.1. Production d’acide gluconique par oxydation chimique du glucose
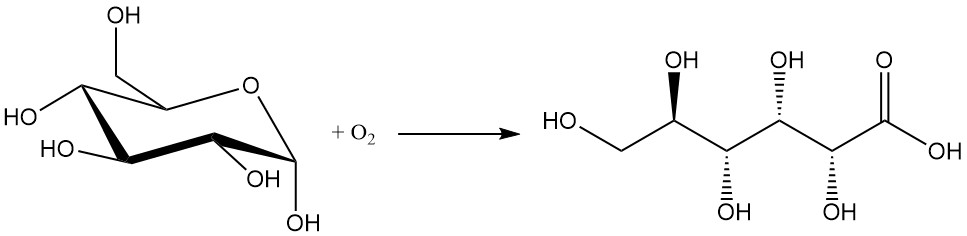
L’oxydation chimique du glucose est la méthode la moins préférée en raison de ses faibles rendements (entre 60 et 80 %) et de la formation de sous-produits indésirables. L’isolement et la purification du produit souhaité sont difficiles.
Les oxydants couramment utilisés dans ce procédé comprennent le peroxyde d’hydrogène, l’ozone et l’oxygène.
3.2. Production d’acide gluconique par oxydation électrochimique du glucose
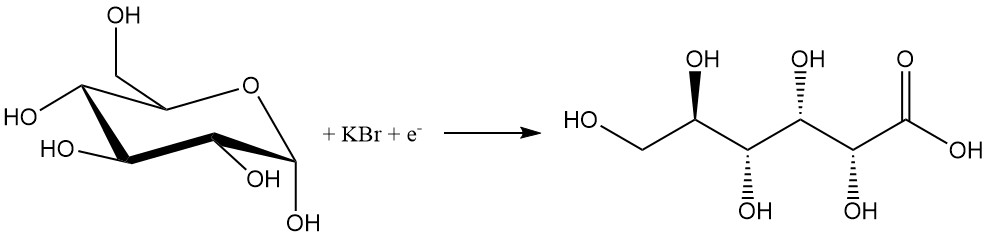
Similairement aux méthodes chimiques, le procédé électrochimique présente une faible sélectivité en raison de l’utilisation d’halogènes.
Une solution de glucose contenant 10 % de bromure est électrolysée à une densité de courant de 1 à 20 A/dm2 pour produire 80 à 97 % d’acide gluconique. Des bases comme le carbonate de calcium ou les hydroxydes sont ajoutées pour neutraliser l’acide
qui en résulte.
Le coût élevé de l’électricité rend cette méthode moins compétitive.
3.3. Production d’acide gluconique par oxydation catalytique du glucose
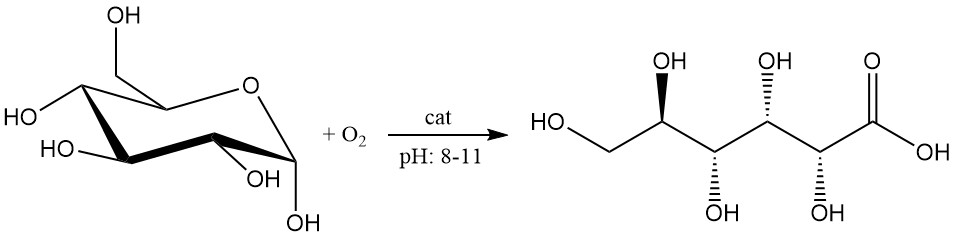
L’oxydation catalytique du glucose a connu des progrès récents et est considérée comme prometteuse pour la production à l’échelle industrielle.
La solution de glucose à une concentration de 1 à 2 mol/L est oxydée par l’oxygène ou l’air à un pH compris entre 8 et 11.
A l’origine, les métaux du groupe du platine sur des supports, tels que le charbon actif et l’oxyde d’aluminium, étaient utilisés comme catalyseurs. Cependant, certains défis qui sont apparus en utilisant ce type de catalyseur comprennent la désactivation du catalyseur, le besoin de glucose pur et la formation de sous-produits.
Le dopage de ces catalyseurs avec des éléments comme le plomb, le sélénium ou le bismuth améliore l’activité et la sélectivité, et le charbon actif est le support préféré pour ces catalyseurs.
L’utilisation de ces catalyseurs pour oxyder une solution de glucose 2 M en acide gluconique avec de l’oxygène à 50 °C et un pH de 9,5, des rendements élevés (> 99,5 %) et une pureté (> 99,5 %) ont été obtenus avec des besoins de purification minimes.
Ces catalyseurs sont également réutilisables, avec une perte d’activité minimale.
La viabilité économique de cette méthode dépend fortement du coût, de l’activité, de la sélectivité et de la durée de vie du catalyseur, ainsi que de la purification du produit et des besoins énergétiques.
Malgré les suggestions précédentes, l’oxydation photochimique du glucose en acide gluconique n’est pas viable.
3.4. Production d’acide gluconique par fermentation
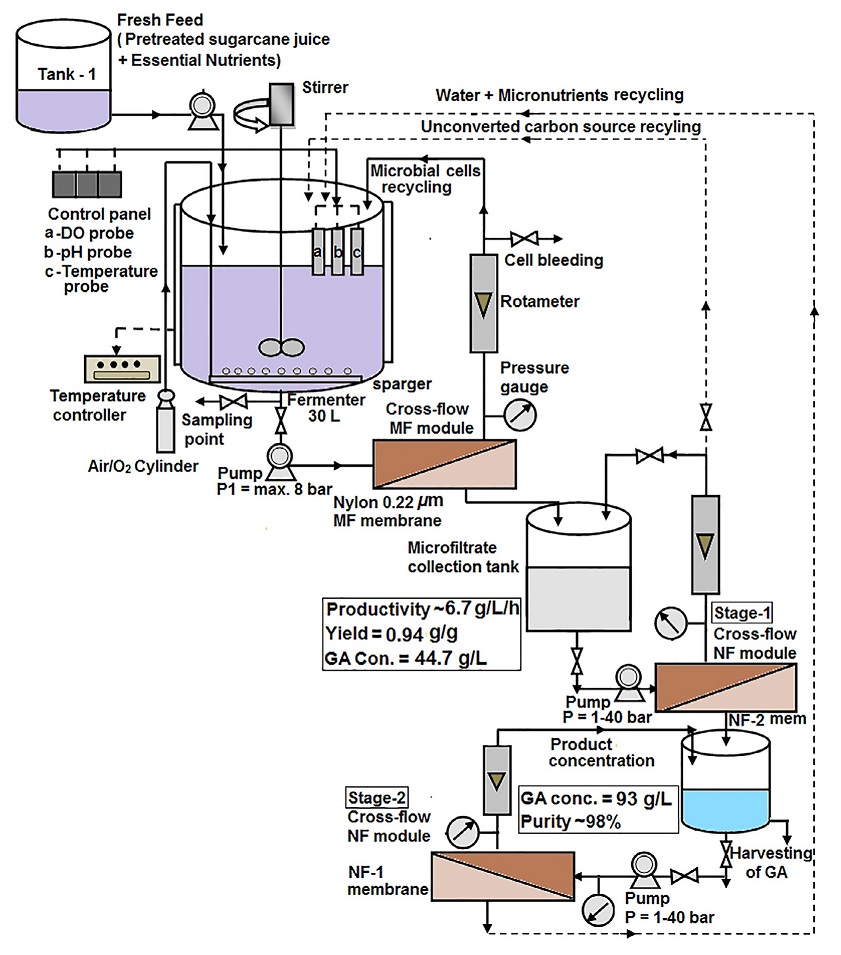
L’acide D-gluconique est produit commercialement par fermentation biologique à l’aide de deux organismes principaux : Aspergillus niger et Gluconobacter suboxydans.
3.4.1. Procédé Aspergillus niger
Le glucose est oxydé en acide gluconique par l’enzyme glucose oxydase dans les cellules fongiques. Cette enzyme utilise la flavine adénine dinucléotide comme cofacteur, produisant finalement du peroxyde d’hydrogène. La catalase, une autre enzyme présente dans le champignon, décompose le peroxyde d’hydrogène en eau et en oxygène.
L’acide gluconique formé peut exister en équilibre avec sa forme lactone. Le pH optimal pour ce processus est d’environ 5,6.
La production à grande échelle implique la fermentation d’un bouillon nutritif stérilisé contenant du glucose, du sulfate de magnésium, du phosphate de potassium et une source d’azote. Le bouillon est inoculé avec une culture d’Aspergillus niger.
Pendant la fermentation, l’activité de la glucose oxydase augmente rapidement, ce qui entraîne une augmentation correspondante de la production d’acide gluconique. Le processus dure généralement de 40 à 100 heures, et le maintien d’un bon apport en oxygène et d’un contrôle approprié du pH est important pour un rendement efficace.
Après la fermentation, la biomasse fongique est éliminée par filtration et la solution d’acide gluconique est purifiée par diverses étapes telles que la décoloration et la filtration. Selon le produit final souhaité, la solution peut être cristallisée pour obtenir de l’acide gluconique ou séchée par atomisation pour produire une solution concentrée.
3.4.2. Procédé Gluconobacter suboxydans
Ce procédé utilise deux enzymes glucose déshydrogénases pour la conversion du glucose en acide gluconique. Contrairement à la méthode Aspergillus niger, Gluconobacter suboxydans nécessite moins d’aération en raison de sa plus grande affinité pour l’oxygène.
De plus, cet organisme tolère des conditions plus acides, ce qui permet l’isolement direct de l’acide gluconique libre du bouillon de fermentation.
3.4.3. Autres méthodes et traitement en aval
Bien que n’étant pas encore commercialement viables, certains procédés utilisant des bactéries méthylotropes acidophiles comme Acetobacter methanolicus sont à l’étude pour la production directe d’acide gluconique. Des recherches sont également en cours sur l’utilisation d’enzymes ou de micro-organismes immobilisés à cette fin.
La récupération de l’acide gluconique libre à partir de bouillons de fermentation contenant du gluconate de sodium (le sel de sodium de l’acide gluconique) peut être réalisée par des techniques telles que l’échange de cations ou l’électrodialyse.
La cristallisation à partir d’une solution sursaturée est la principale méthode pour obtenir de l’acide gluconique pur sous sa forme lactone. La déshydratation avec des alcools spécifiques suivie d’une cristallisation est une autre méthode de production de lactone.
4. Utilisations de l’acide gluconique
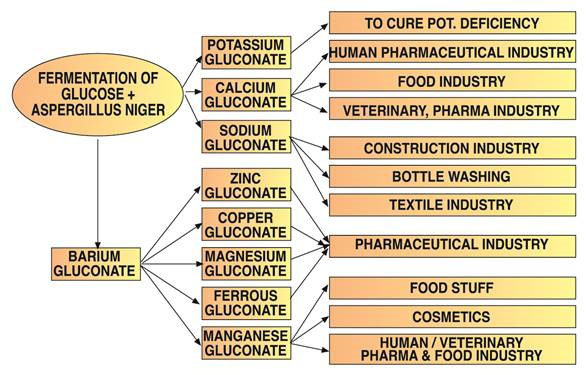
L’acide gluconique est utilisé pour les applications de nettoyage en raison de sa capacité à dissoudre les oxydes métalliques, les hydroxydes et les carbonates, ainsi que de la formation de complexes hydrosolubles avec ces cations.
L’acide gluconique est utilisé pour éliminer les dépôts calcaires et de rouille de divers métaux, notamment le fer galvanisé, les alliages de magnésium et l’acier inoxydable. Il est utilisé pour nettoyer le tartre de bière et de lait de ces surfaces.
En conjonction avec les sels de magnésium, l’acide gluconique agit comme stabilisateur pour les bains de blanchiment au peroxyde dans l’industrie textile.
Les propriétés physiologiques de l’acide D-gluconique le rendent adapté aux applications alimentaires et aux boissons. De faibles concentrations (0,02-0,1 %) inversent efficacement le saccharose sans autres réactions de fructose.
Les oligo-éléments sont souvent administrés sous forme de sels de gluconate en raison de leur biodisponibilité et de leur tolérance élevées. Le gluconate de potassium, disponible sous forme anhydre ou monohydratée, a des utilisations pharmaceutiques spécifiques.
L’acide gluconique 1,5-lactone est un substitut pratique de l’acide libre dans de nombreux exemples. Il offre des avantages dans les environnements acides, tels que le décapage des produits, la salaison des saucisses et la levée des produits de boulangerie.
Le gluconate de sodium est le sel de gluconate le plus courant. Il forme des complexes avec des cations métalliques, sa stabilité augmentant à un pH plus élevé. Il nettoie efficacement diverses surfaces et élimine la graisse, la corrosion, la rouille et les revêtements d’oxyde de l’aluminium, de l’acier, du cuivre et de leurs alliages.
Les solutions alcalines chaudes (95–100 °C) de gluconate de sodium éliminent efficacement la peinture et le vernis sans endommager les surfaces sous-jacentes.
Les solutions de gluconate sont utilisées dans le prétraitement des surfaces pour le brasage nickel-cobalt sur l’aluminium et la préparation de surfaces électrolytiques lisses et brillantes en nickel, étain et zinc. Il remplace de plus en plus l’ion cyanure toxique dans certaines applications.
Le gluconate de sodium, parfois associé à des polyphosphates, est utilisé dans l’industrie du papier comme agent d’encollage qui confère au papier une résistance aux acides. Dans les textiles, il aide à désencoller les tissus en polyester ou en polyamide et à finir les fibres de cellulose naturelle.
La stabilité du gluconate de sodium à des températures et à un pH élevés, associée à sa capacité à séquestrer les agents durcissants à l’eau, en fait un composant utile des nettoyants commerciaux. Il est utilisé dans le lavage des bouteilles et le nettoyage des surfaces en aluminium.
Les fabricants de béton utilisent le gluconate de sodium comme retardateur de durcissement très efficace. Il améliore l’homogénéité du béton, la résistance à l’eau, la résistance au gel et la maniabilité tout en réduisant les fissures.
Un avantage significatif de l’acide gluconique, de sa lactone et de leurs sels est leur biodégradabilité dans les systèmes de traitement des eaux usées. Cela s’étend à leurs complexes métalliques avec l’aluminium, le cuivre, le fer et le zinc. Même les complexes de gluconate de chrome se biodégradent, bien que plus lentement.
Les ions métalliques libérés sont éliminés lors de la purification des eaux usées, réduisant ainsi la mobilisation potentielle des métaux lourds. La biodégradation et la précipitation des hydroxydes (à pH 9-10) contribuent à la destruction des complexes de gluconate de métaux lourds dans les eaux usées.
Références
- Gluconic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a12_449
- S. Banerjee et al., Fermentative production of gluconic acid: A membrane-integrated Green process, Journal of the Taiwan Institute of Chemical Engineers (2018), https://doi.org/10.1016/j.jtice.2018.01.030
