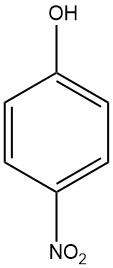
Le 4-nitrophénol (également connu sous le nom de p-nitrophénol ou 4-hydroxynitrobenzène) est un composé aromatique de formule chimique C6H5NO3. C’est un nitrophénol, ce qui signifie qu’il contient à la fois un groupe nitro (-NO2) et un groupe hydroxyle (-OH) attaché à un cycle benzénique.
Le 4-nitrophénol est un solide cristallin jaune à incolore avec une odeur phénolique douce. Il est soluble dans l’eau, l’éthanol et d’autres solvants organiques.
Table des matières
1. Propriétés physiques du 4-nitrophénol
Le p-nitrophénol possède une forme α métastable qui peut être observée sous forme cristalline lorsque le toluène est chauffé au-dessus de 63 °C. La forme β plus stable est obtenue lorsque le toluène est refroidi en dessous de 63°C. Le P-nitrophénol n’est pas facilement volatil avec la vapeur, mais il est plus soluble dans l’eau que son ortho-isomère.
Certaines des propriétés physiques du 4-nitrophénol sont présentées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Formule chimique | C6H5NO3 |
| Masse molaire | 139,11 g/mol |
| Apparence | Solide cristallin jaune en forme d'aiguille |
| Point de fusion | 114°C |
| Point d'ébullition | 216°C |
| Solubilité dans l'eau (100°C) | 30 % |
| Solubilité dans l'eau (25°C) | 16 g/L |
| Densité | 1,48 g/cm³ |
| pKa | 7.15 |
| Point d'éclair | 105°C |
| Température de décomposition du sel de sodium | 156°C |
2. Réactions chimiques du 4-nitrophénol
Le 4-nitrophénol est un composé relativement stable. Sa réactivité est due à la présence de groupes nitro et hydroxyle sur le cycle aromatique, ce qui lui permet de subir diverses réactions chimiques, comme suit :
Réduction
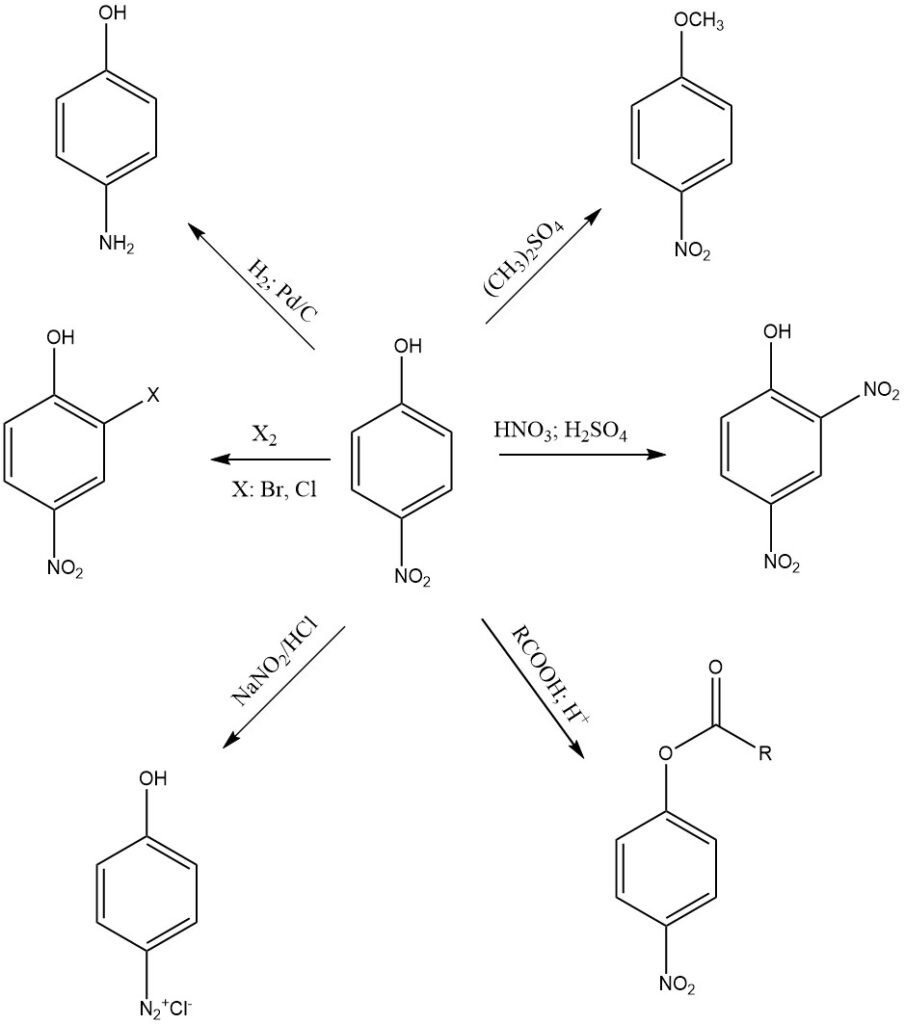
L’une des réactions les plus courantes du 4-nitrophénol est la réduction du groupe nitro en amine. Le 4-nitrophénol peut être réduit en 4-aminophénol dans diverses conditions. Les agents réducteurs courants comprennent le dithionite de sodium, le zinc et le fer dans du HCl concentré ou de l’hydrogène gazeux.
Alkylation
Le 4-nitrophénol peut être alkylé pour former divers dérivés. Les agents alkylants courants comprennent le sulfate de diméthyle et l’iodure de méthyle. Les dérivés alkylés du 4-nitrophénol sont souvent utilisés comme intermédiaires dans la synthèse d’autres composés organiques.
Estérification
Le 4-nitrophénol peut subir une estérification, où il réagit avec les acides carboxyliques pour former des esters. Cette réaction est généralement catalysée par un acide, tel que l’acide sulfurique (H2SO4).
Nitration
Le 4-nitrophénol est nitré en présence d’acide nitrique et d’acide sulfurique pour former le 2,4-dinitrophénol. Une nitration supplémentaire produit de l’acide picrique, qui est un explosif plus puissant que le 2,4-dinitrophénol, et il est utilisé dans diverses applications industrielles et militaires.
Diazotation
Le 4-nitrophénol peut également participer aux réactions de diazotation, un processus qui convertit le groupe amino (-NH2) du 4-aminophénol en un sel de diazonium (-N2+X-). Cette réaction est utilisée dans la synthèse de divers colorants et composés aromatiques avec des groupes diazo.
Réactions acido-basiques
Le 4-nitrophénol est acide en raison de son groupe hydroxyle. Il réagit avec des bases fortes comme l’hydroxyde de sodium pour former des ions 4-nitrophénolate.
Le 4-nitrophénol subit également des réactions sur le cycle aromatique telles que l’halogénation, la sulfonation, l’acylation et l’alkylation, en particulier en position ortho du groupe (-OH).
3. Production de 4-nitrophénol
3.1. Hydrolyse du 4-chloronitrobenzène
Le 4-chloronitrobenzène est chauffé en autoclave avec une solution de soude à 8,5%. La réaction exothermique atteint 170°C et est maintenue pendant 8 heures. La solution est ensuite refroidie et acidifiée pour donner du 4-nitrophénol avec un rendement de 95 %.

Le processus produit du 4-nitrophénol de haute pureté et comprend les étapes suivantes :
- Hydrolyse basique du 4-chloronitrobenzène
- Concentration du milieu réactionnel
- Acidification pour obtenir le composé 4-nitrophénol à partir de son sel
- Décantation liquide/liquide pour éliminer la phase aqueuse obtenue après acidification
- Cristallisation du composé 4-nitrophénol
- Séparation du produit
L’étape de concentration élimine les impuretés volatiles et l’étape de décantation élimine les impuretés solubles dans l’eau. L’étape de cristallisation purifie davantage le 4-nitrophénol en éliminant toutes les impuretés restantes.
Ce procédé produit un 4-nitrophénol avec une faible teneur en impuretés liposolubles (telles que le 4-chloronitrobenzène) et en impuretés hydrosolubles (telles que le chlorure de sodium et le sulfate de sodium). Le 4-nitrophénol est également exempt d’impuretés sulfureuses, ce qui est avantageux pour les réactions catalytiques d’hydrogénation ultérieures.
3.2. Nitration du phénol
Le phénol réagit avec l’acide nitrique en présence d’acide sulfurique pour produire un mélange de 2-nitrophénol et de 4-nitrophénol. Le mélange est ensuite distillé pour séparer les deux isomères. Le 4-nitrophénol obtenu à l’issue de l’étape de distillation est ensuite purifié par cristallisation ou recristallisation.

Un processus plus efficace pour produire du 4-nitrophénol à partir de phénol dans un milieu acide nitrique est une méthode qui comporte deux étapes : la nitrosation et la nitration. Dans l’étape de nitrosation, le phénol réagit avec l’acide nitreux pour produire du p-nitrosophénol.
Lors de l’étape de nitration, le p-nitrosophénol réagit avec l’acide nitrique pour produire du 4-nitrophénol. Le procédé est réalisé dans un milieu acide nitrique dont la concentration est comprise entre 5 et 30 % en poids, et la température est maintenue dans la plage comprise entre 0 et 10 °C pendant la nitrosation et entre 15 et 30 °C pendant la nitration.
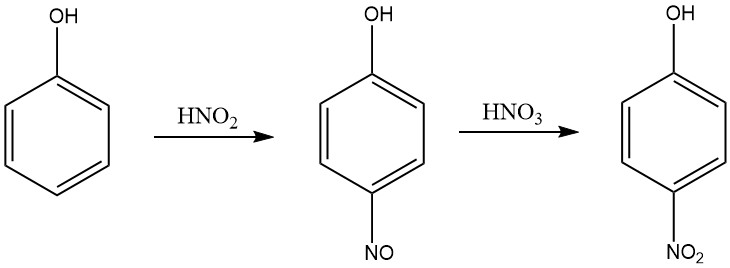
L’acide nitreux est produit dans l’acide nitrique aqueux par addition d’oxydes d’azote, tels que l’oxyde nitrique, le tétroxyde d’azote ou le trioxyde d’azote. Le 4-nitrophénol est séparé du mélange réactionnel par cristallisation.
Ce procédé est avantageux car il produit du 4-nitrophénol avec une faible teneur en isomères ortho.
4. Utilisations du 4-nitrophénol
La réduction du 4-nitrophénol en 4-aminophénol est moins utilisée car les procédés permettant de réduire directement le nitrobenzène sont plus courants.
Le 4-nitrophénol réagit avec les chlorures de dialkylthiophosphorique à 125°C dans le chlorobenzène pour former un groupe d’insecticides comprenant le parathion. Mais ce composé a été remplacé par des alternatives moins toxiques comme le méthylparathion et des substances apparentées.
Le 4-nitrophénol réagit avec le 4-chloro-3-nitrobenzotrifluorure pour former du fluorodifen, qui est apparenté au nitrofène. Cet herbicide est utilisé pour traiter les cultures de riz semées.
Le 4-nitrophénol est utilisé dans d’autres applications, notamment :
- Produits pharmaceutiques : le 4-nitrophénol est utilisé comme intermédiaire dans la synthèse du paracétamol (également connu sous le nom d’acétaminophène), un analgésique et un réducteur de fièvre en vente libre courant.
- Fongicides : le 4-nitrophénol est un précurseur de certains fongicides, tels que le dinocap et le binapacryl.
- Colorants : le 4-nitrophénol est utilisé pour produire une variété de colorants, notamment des colorants jaunes, orange et rouges.
- Tannage du cuir : le 4-nitrophénol est utilisé pour foncer le cuir.
5. Toxicologie du 4-nitrophénol
| Exposition | DL50 |
|---|---|
| Dermique, cobaye | >1 g/kg |
| Oral, souris | 282 mg/kg |
| Orale, rat | 202 mg/kg |
| Peau de rat | 1 024 mg/kg |
| Inhalation, rat | > 4,7 mg/l/4H |
| Sensibilisation cutanée, cobaye | Aucun sensibilisé |
- Effets aigus : l’inhalation ou l’ingestion de 4-nitrophénol peut provoquer des maux de tête, de la somnolence, des nausées et une cyanose (couleur bleue des lèvres, des oreilles et des ongles). Le contact avec les yeux peut provoquer une irritation.
- Effets chroniques : aucune information n’est disponible sur les effets chroniques du 4-nitrophénol chez l’homme ou l’animal par inhalation ou exposition orale.
- Effets sur la reproduction/le développement : Aucune information n’est disponible sur les effets sur la reproduction ou le développement du 4-nitrophénol chez l’homme.
- Risque de cancer : aucune information n’est disponible sur les effets cancérigènes du 4-nitrophénol chez l’homme. Il n’y avait aucune preuve d’activité cancérigène chez des souris exposées par voie cutanée au 4-nitrophénol pendant 18 mois dans une étude du National Toxicology Program (NTP).
Références
- Nitro Compounds, Aromatic, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
- Process for preparation of a nitrophenol. – https://patents.google.com/patent/US20080045756A1/en
- Preparation of p-nitrophenols. – https://patents.google.com/patent/US3510527A/en
- https://www.epa.gov/sites/default/files/2016-09/documents/4-nitrophenol.pdf
- https://fscimage.fishersci.com/msds/96371.htm


