Nitración de compuestos aromáticos
1. Desentrañando la historia de las reacciones de nitración aromática
A principios del siglo XIX, se lograron avances significativos en la síntesis de compuestos nitro aromáticos. Mitscherlich en 1834 obtuvo con éxito tales compuestos sometiendo hidrocarburos derivados del alquitrán de hulla a ácido nítrico fumante.
Laurent continuó este trabajo en 1835, centrándose en la nitración de naftaleno, el hidrocarburo aromático puro más disponible en ese momento. En 1838, Dale presentó sus hallazgos sobre compuestos nitro mixtos derivados del benceno crudo durante la reunión anual de la Asociación Británica para el Avance de la Ciencia.
Sin embargo, no fue hasta 1845 que Hofmann y Muspratt informaron sobre su investigación sistemática sobre la nitración del benceno, dando como resultado mono y dinitrobencenos utilizando una mezcla de ácidos nítrico y sulfúrico.
Tabla de contenido
La producción inicial de nitrobenceno se llevó a cabo a pequeña escala y se destiló cuidadosamente para producir un líquido amarillo con aroma a almendra amarga. Este producto, conocido como ‘esencia de mirbane’, se vendía a fabricantes de jabones y perfumes.
El proceso de reducción de hierro de Bechamp, que aumentó la disponibilidad de anilina, se publicó en 1854. Posteriormente, el descubrimiento de la anilina malva por parte de Perkin en 1856 marcó el comienzo de la industria europea de tintes de anilina, que sirvió como base para la industria mundial de colorantes sintéticos, con ventas estimadas. de $6 x 109 en 1988.
El desarrollo y la ampliación de los procesos de nitración y reducción, iniciados por Perkin y continuados por muchos otros, redujeron significativamente el precio comercial de la anilina de 50 Fr/kg en 1858 a 10 Fr/kg en 1863.
En 1871, la producción europea de anilina había alcanzado las 3.500 t/a. En 1985, la producción europea de anilina aumentó a 500.000 t/a, y su uso en colorantes representó sólo el 4% de la producción total de anilina.
La mayor parte del crecimiento se atribuyó a los productos químicos del caucho y a los isocianatos, que consumieron más del 50% de la producción de nitrobenceno para la fabricación de diisocianato de metileno difenilo.
Los compuestos nitroaromáticos naturales son limitados en número; el cloranfenicol fue el primero en reconocerse en 1949, extraído de cultivos de Streptomyces venezuelae, un moho del suelo.
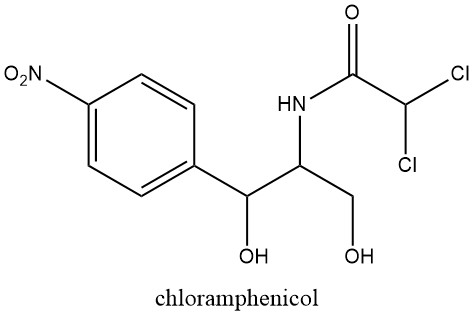
Este descubrimiento impulsó más investigaciones sobre la actividad farmacológica del grupo nitro, tras el descubrimiento anterior de las propiedades antibacterianas de los derivados del nitrofurano en 1943.
Muchos productos farmacéuticos y agroquímicos sintéticos también contienen grupos nitroaromáticos, aunque el papel preciso del grupo nitro en estos compuestos a menudo sigue sin estar claro.
El método principal para introducir grupos nitro en sistemas aromáticos es la nitración.
Si bien hay algunos métodos indirectos disponibles, como la oxidación de compuestos nitrosos o amino, la sustitución de grupos de diazonio (reacción de Sandmeyer), la reordenación de nitraminas y las reacciones de desplazamiento nucleofílico, tienen una importancia industrial limitada.
Los procesos unitarios, como la sulfonación, la halogenación o la aminación, se aplican comúnmente a materiales de partida nitro primarios, principalmente derivados de nitrobenceno, nitrotoluenos y nitroclorobencenos, para producir varios compuestos nitro importantes.
El desplazamiento nucleofílico de grupos nitro activados tiene cierto potencial sintético y su nucleofugicidad puede ser comparable a la de los sustituyentes flúor. Ciertos compuestos nitro fácilmente disponibles, como el 1,3-dinitrobenceno, reaccionan con reactivos específicos para formar derivados útiles.
Los nitrocompuestos o sus derivados sirven como intermediarios para colorantes, agroquímicos, productos farmacéuticos, productos químicos finos, materiales sintéticos y explosivos, con pocas salidas importantes para la producción a gran escala.
2. Reacción de nitración
El proceso de nitración puede describirse como la introducción irreversible de uno o más grupos nitro (NO2) en un núcleo aromático, reemplazando un átomo de hidrógeno.
La nitración es una reacción de sustitución electrófila, representada por la ecuación:
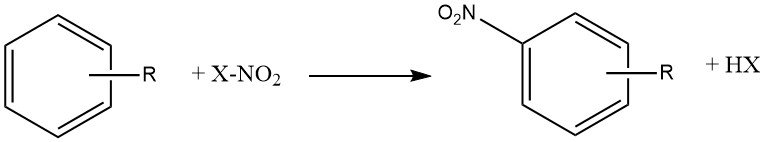
La introducción del grupo nitro desactiva el anillo hacia una mayor sustitución electrofílica, lo que hace que la dinitración sea poco común en las condiciones utilizadas para la mononitración.
Generalmente se requieren condiciones más vigorosas para la diniración, lo que requiere exceso, ácido más fuerte y temperatura más alta. Estas condiciones se aplican a menudo a compuestos mononitro aislados, en lugar de llevar a cabo reacciones graduales in situ.
La reacción de nitración es altamente exotérmica, como lo demuestra la mononitración de benceno (ΔH = -117 kJ/mol) y naftaleno (ΔH = -209 kJ/mol). En consecuencia, es uno de los procesos unitarios operados industrialmente más potencialmente peligrosos.
El calor generado durante la nitración puede hacer que el ácido nítrico degrade exotérmicamente materiales orgánicos en productos gaseosos con violencia explosiva.
Los compuestos de nitroarilo, especialmente aquellos con múltiples grupos nitro, plantean riesgos potenciales debido a su alto contenido de oxígeno.
Algunos compuestos de polinitro, como el trinitrotolueno y el ácido pícrico, son detonables y tienen una larga historia de uso como explosivos. Además, los compuestos nitroaromáticos pueden sufrir reacciones de descomposición violenta cuando se calientan con álcali.
El proceso de nitración se puede realizar de forma discontinua o por lotes. Las reacciones por lotes son adecuadas para requisitos de menor tonelaje y se realizan en nitradores diseñados para manipular diversos productos.
Por razones de seguridad, estos reactores suelen tener una capacidad limitada a unos 6.000 litros y están equipados con agitadores y sistemas de refrigeración eficientes.
Por otro lado, la reacción continua, adecuada para productos intermedios de gran tonelaje como nitrobenceno y nitrotoluenos, ofrece ventajas en términos de seguridad y rentabilidad.
La producción de nitroaromáticos se basa principalmente en procesos de alto rendimiento, y más del 80% del coste total se atribuye a las materias primas. Por lo tanto, los ahorros operativos son limitados.
Sin embargo, se han realizado mejoras en áreas como el reciclaje de ácido sulfúrico, un requisito integral en los procesos de nitración eficientes, y el control y separación de isómeros, lo que contribuye a mejorar la eficiencia del proceso.
3. Agentes nitrantes
Por razones prácticas y económicas, la nitración a escala industrial se lleva a cabo comúnmente utilizando un ácido mixto, que es una combinación de ácidos nítrico y sulfúrico. Ocasionalmente, se utilizan otras combinaciones, tales como ácido nítrico acuoso, ácido nítrico en ácido acético o ácido nítrico en anhídrido acético.
En ciertos estudios de respaldo importantes, se pueden usar componentes ácidos alternativos como ácido perclórico, ácido fluorhídrico o trifluoruro de boro, pero su aplicación es limitada. Estas reacciones alternativas pueden tener lugar en disolventes orgánicos inertes como clorohidrocarburos o sulfolanos para crear mezclas de reacción homogéneas.
La fuerza del agente nitrante (X-NO2) disminuye a medida que disminuye la electronegatividad de X. La especie más activa en estos sistemas es el ion nitronio (NO2+). En el sistema común, la ecuación general es una combinación de varios equilibrios presentes en las mezclas HNO3 – H2SO4 – H2O, que deben considerarse al evaluar la reactividad del sustrato y el grado de nitración requerida.
Para la mononitración aromática a gran escala, un agente nitrante típico consiste en 20% de ácido nítrico, 60% de ácido sulfúrico y 20% de agua, a menudo denominado «ácido mixto 20/60/20». Alternativamente, en algunas situaciones, se puede describir como 15 % en moles de ácido nítrico, 30 % en moles de ácido sulfúrico y 55 % en moles de agua.
El sustrato aromático líquido y el producto nitrado normalmente forman una fase separada del ácido mixto acuoso. Por lo tanto, una agitación eficiente es crucial para maximizar el contacto con la fase orgánica y minimizar la resistencia a la transferencia de masa.
Los sustratos sólidos se disuelven mejor en la fase de ácido sulfúrico. Es esencial optimizar diversas variables, como la concentración de ácido nítrico, la temperatura y otros parámetros para cada nitración específica para lograr la formación de isómeros deseada y minimizar las reacciones secundarias.
Las reacciones de radicales libres, normalmente empleadas en fase de vapor con ácido nítrico o dióxido de nitrógeno como agente nitrante, no se utilizan habitualmente en la nitración aromática. Son más adecuados para la nitración alifática.
4. Mecanismos de reacción de nitración
Se han llevado a cabo numerosos experimentos sobre la nitración aromática desde que la escuela Ingold-Hughes confirmó en 1950 que el ion nitronio (NO2+) era la especie activa, utilizando análisis de espectros Raman.
Si bien la temperatura y el grado de mezcla desempeñan papeles cruciales en todos los agentes nitrantes, otras variables a menudo conducen a resultados inconsistentes. En la nitración comercial que utiliza HNO3-H2SO4, las constantes de velocidad relativas exhiben un amplio rango, lo que da como resultado tiempos de reacción que varían desde varios segundos para sustratos activos hasta varias horas para sustratos inactivos.
Se ha argumentado que en las condiciones no ideales de la producción a gran escala, la transferencia de masa puede tener más control sobre la nitración que la cinética, desafiando la suposición de muchos estudios de laboratorio de que la resistencia a la transferencia de masa es insignificante.
Además, una suposición anterior de que la tasa de nitración se alinea con la formación en equilibrio del ion nitronio fue cuestionada debido a la comprensión de que pueden aplicarse diferentes mecanismos a diferentes concentraciones de ácido.
La Figura 1 ilustra el mecanismo que puede explicar todos los datos disponibles sobre la nitración de sustratos simples como el benceno y el tolueno (excluyendo fenoles o polialquilbencenos). Este mecanismo implica cuatro constantes de velocidad y tres reacciones reversibles importantes, lo que hace que la cinética sea muy compleja, incluso si la reacción está totalmente controlada cinéticamente.
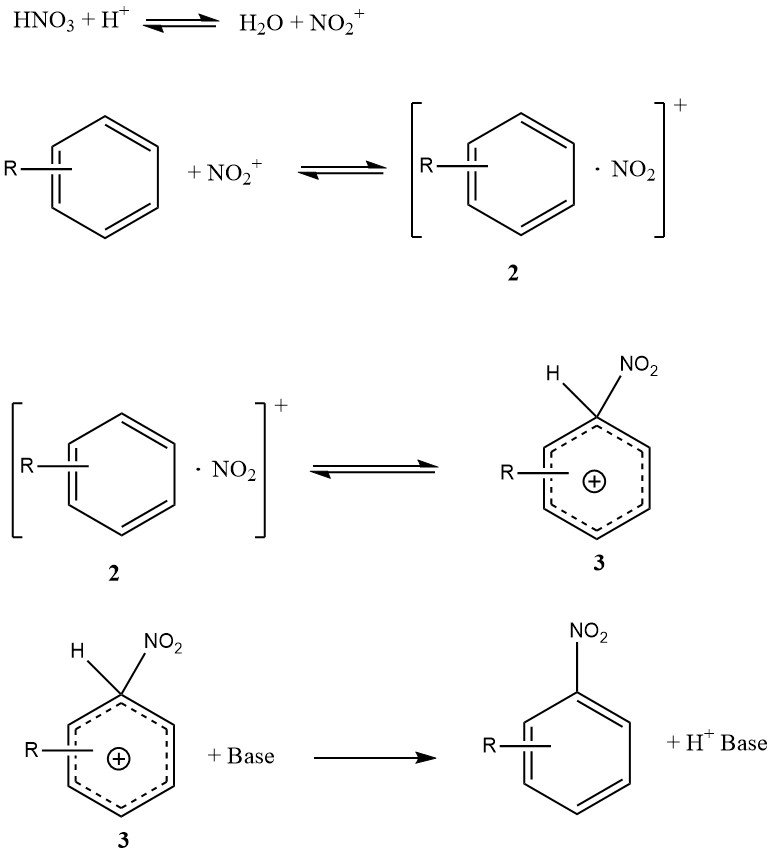
El complejo de encuentro o par de encuentro (2) es una característica novedosa de este mecanismo. Es un complejo molecular de naturaleza menos específica en comparación con el concepto anterior de complejo p intermedio. Es importante destacar que el complejo de encuentro (2) desempeña un papel cinético y, de hecho, puede determinar la velocidad.
La conversión del complejo s (3), a veces denominado intermedio de Wheland, en el producto no limita la velocidad porque la reacción de nitración no exhibe un efecto isotópico cinético primario.
En condiciones específicas, la formación del ion nitronio podría determinar la velocidad, pero para sustratos reactivos en ácido sulfúrico acuoso, la formación del complejo de encuentro (2) es predominantemente el paso determinante de la velocidad.
Por el contrario, la nitración de tolueno, benceno y otros compuestos aromáticos menos reactivos sigue una ley de velocidad general en la que la formación del complejo s (3) es principalmente el paso determinante de la velocidad.
En el caso del fenol, cuando el anillo está altamente activado hacia el ataque electrofílico, el ion nitrosonio (NO+) se vuelve significativo y conduce a la formación de un compuesto nitroso intermedio. Este intermedio se oxida aún más con ácido nítrico para producir el derivado nitro mientras se regenera el ácido nitroso.
Otra excepción al mecanismo general es el ataque ipsoelectrófilo en una posición sustituyente. Con di- y polialquilbencenos, se puede formar el ion ipso-nitroarenio (4) en lugar del intermedio de Wheland convencional (3).
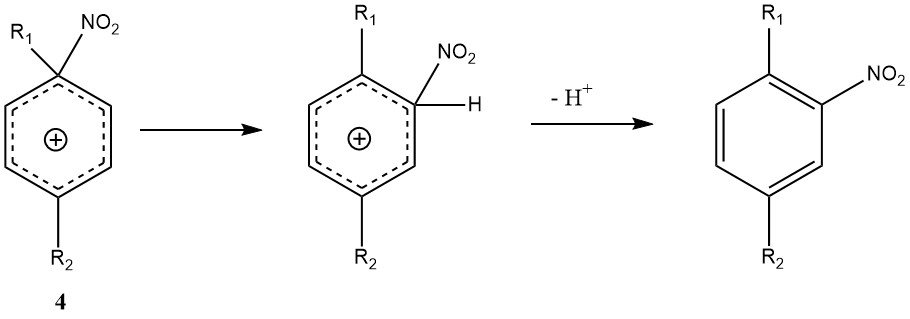
La transposición de 4 al intermedio de Wheland puede ocurrir, pero va acompañada de reacciones secundarias como la nitrodesalquilación, lo que hace que la nitración de polialquilbencenos produzca potencialmente productos de mezcla más variables que otras nitraciones.
Una mejor comprensión de la formación de intermediarios de ipso-Wheland ha llevado a su utilización en otras reacciones, particularmente con nucleófilos.
Referencia
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
Preguntas más frecuentes
La reacción de nitración es un proceso químico en el que se introducen uno o más grupos nitro (NO2) en un núcleo aromático mediante la sustitución de un átomo de hidrógeno. Es una reacción de sustitución electrófila comúnmente utilizada para modificar compuestos aromáticos uniéndoles grupos nitro, lo que puede alterar significativamente sus propiedades y reactividad.
Los principales químicos utilizados en la nitración son el ácido nítrico (HNO3) y el ácido sulfúrico (H2SO4), que juntos forman una mezcla conocida como ácido mixto. Otros productos químicos que pueden usarse ocasionalmente incluyen ácido nítrico acuoso, ácido nítrico en ácido acético o ácido nítrico en anhídrido acético. Se pueden utilizar ácido perclórico, ácido fluorhídrico o trifluoruro de boro en estudios de respaldo específicos.
En la nitración aromática, el electrófilo responsable del ataque al núcleo aromático es el ion nitronio (NO2+). El ion nitronio se forma por la reacción entre el ácido nítrico y el ácido sulfúrico y actúa como electrófilo, aceptando un par de electrones del anillo aromático durante la reacción de sustitución electrófila.
El ácido sulfúrico en la nitración aromática actúa como catalizador en la formación del ion nitronio (NO2+) a partir de la reacción entre el ácido nítrico y el ácido sulfúrico. Además, el ácido sulfúrico ayuda a deshidratar el ácido nítrico, lo que lo convierte en un agente nitrante más fuerte. Además, el ácido sulfúrico ayuda a disolver y solubilizar el sustrato aromático, lo que permite una reacción eficiente y maximiza el contacto con el agente nitrante.
Los productos principales de la nitración son compuestos nitroaromáticos monosustituidos, que se forman cuando se introduce un grupo nitro en el núcleo aromático. Cinco productos potenciales de la nitración pueden incluir:
1. Nitrobenceno (C6H5NO2)
2. Nitrotoluenos (p. ej., ortonitrotolueno, metanitrotolueno y paranitrotolueno)
3. Nitronaftalenos (por ejemplo, alfa-nitronaftaleno y beta-nitronaftaleno)
4. Nitrofenoles (p. ej., ortonitrofenol, metanitrofenol y paranitrofenol)
5. Nitroanilinas (p. ej., ortonitroanilina, metanitroanilina y paranitroanilina)
